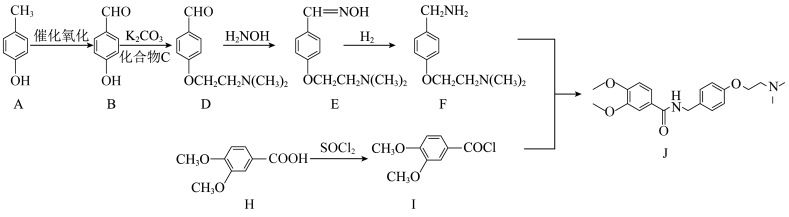
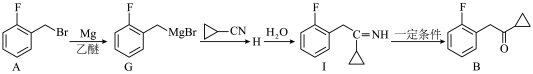
1 . 化合物J可以促进消化道蠕动,是常用的促进胃动力的药物,其合成路线如下。
(1)化合物A的名称是_______ ,其中碳原子的杂化类型为_______ 。
(2)H→I的反应类型为_______ ,化合物J中含氧官能团名称为_______ 。
(3)化合物C的分子式为 ,则C的结构简式为
,则C的结构简式为_______ ,B到D的转化中加入碳酸钾的目的为_______ 。
(4)写出同时符合下列条件的化合物H的一种同分异构体的结构简式_______ 。
①分子中含有苯环,遇 溶液不显色
溶液不显色
②核磁共振氢谱图上有4组峰,峰面积之比为6∶2∶1∶1
(5)结合题干信息以苯甲醛为原料合成药物N-苄基苯甲酰胺(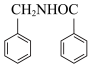 )。基于你设计的合成路线,回答下列问题:
)。基于你设计的合成路线,回答下列问题:
①相关步骤中涉及到醛的氧化,请写出该反应的化学方程式_______ 。
②写出最后一步反应的化学方程式_______ 。
(1)化合物A的名称是
(2)H→I的反应类型为
(3)化合物C的分子式为
 ,则C的结构简式为
,则C的结构简式为(4)写出同时符合下列条件的化合物H的一种同分异构体的结构简式
①分子中含有苯环,遇
 溶液不显色
溶液不显色②核磁共振氢谱图上有4组峰,峰面积之比为6∶2∶1∶1
(5)结合题干信息以苯甲醛为原料合成药物N-苄基苯甲酰胺(
 )。基于你设计的合成路线,回答下列问题:
)。基于你设计的合成路线,回答下列问题:①相关步骤中涉及到醛的氧化,请写出该反应的化学方程式
②写出最后一步反应的化学方程式
您最近一年使用:0次
解题方法
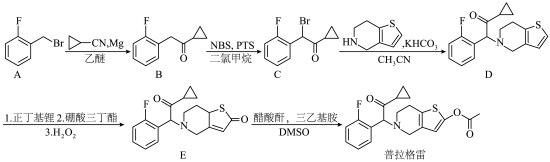
2 . 药物普拉格雷是第三代抗血小板药物,合成路线如下。
(1)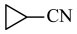 中碳原子的轨道杂化类型有
中碳原子的轨道杂化类型有___________ 种。
(2)普拉格雷中含氧官能团的名称是___________ 。
(3)B→C的反应类型为___________ 。
(4)在C→D的反应过程中, 的作用是
的作用是___________ 。
(5)A→B的具体反应过程如下:___________ 。
(6)化合物E通过共振形成烯醇式结构,如下图。 发生取代反应,生成目标产物普拉格雷,该反应的化学方程式为
发生取代反应,生成目标产物普拉格雷,该反应的化学方程式为___________ 。
(7)满足下列条件的B的同分异构体有种___________ (不考虑立体异构)。
①苯环上有两个取代基,取代基无环状结构;
②F与苯环相连;
③存在酮羰基(但不含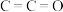 );
);
④有两个甲基。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:2:1的同分异构体的结构简式为___________ 。
(1)
 中碳原子的轨道杂化类型有
中碳原子的轨道杂化类型有(2)普拉格雷中含氧官能团的名称是
(3)B→C的反应类型为
(4)在C→D的反应过程中,
 的作用是
的作用是(5)A→B的具体反应过程如下:
(6)化合物E通过共振形成烯醇式结构,如下图。
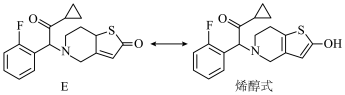
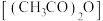 发生取代反应,生成目标产物普拉格雷,该反应的化学方程式为
发生取代反应,生成目标产物普拉格雷,该反应的化学方程式为(7)满足下列条件的B的同分异构体有种
①苯环上有两个取代基,取代基无环状结构;
②F与苯环相连;
③存在酮羰基(但不含
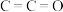 );
); ④有两个甲基。
其中,核磁共振氢谱有4组峰,且峰面积比为6:2:2:1的同分异构体的结构简式为
您最近一年使用:0次
2024-05-18更新
|
136次组卷
|
2卷引用:2024届河南省平许济洛四市高三下学期第四次质量检测理科综合试题-高中化学
解题方法
3 . 中山大学廖培钦教授利用HAB和 、
、 合成了具有异金属不对称Sn…Cu双位点的稳定金属有机框架(
合成了具有异金属不对称Sn…Cu双位点的稳定金属有机框架( ),实现高选择性电催化还原
),实现高选择性电催化还原 生成乙醇。
生成乙醇。 的结构如图所示。
的结构如图所示。

下列有关该图的叙述错误的是
 、
、 合成了具有异金属不对称Sn…Cu双位点的稳定金属有机框架(
合成了具有异金属不对称Sn…Cu双位点的稳定金属有机框架( ),实现高选择性电催化还原
),实现高选择性电催化还原 生成乙醇。
生成乙醇。 的结构如图所示。
的结构如图所示。
下列有关该图的叙述错误的是
| A.只有N原子提供孤电子对与金属形成配位键 |
B.N原子都是 杂化,C原子都是 杂化,C原子都是 杂化 杂化 |
C. 中N元素的第一电离能最大 中N元素的第一电离能最大 |
D. 不能与水分子形成氢键 不能与水分子形成氢键 |
您最近一年使用:0次
2024-04-09更新
|
298次组卷
|
3卷引用:河南省濮阳市2024届高三下学期第二次模拟考试理科综合化学试题
4 . 丁香酚存在于丁香花的花荵中,以丁香酚为原料制取有机物 的路线如下:
的路线如下:
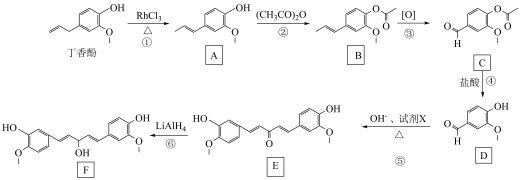
已知: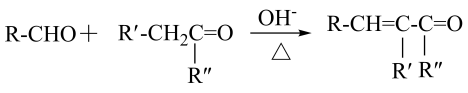
(1)丁香酚的分子式为_______ ,丁香酚分子中碳原子的杂化类型为_______ 。
(2) 中的含氧官能团是
中的含氧官能团是_______ (填名称),⑥的反应类型为_______ 。
(3)写出满足下列条件的 的所有同分异构体的结构简式
的所有同分异构体的结构简式_______ 。
①含苯环且环上只有两个取代基
②属于酯类化合物
③核磁共振氢谱有3组峰,且峰面积之比为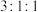
(4)反应⑤的方程式中 与
与 的系数比为
的系数比为 ,试剂
,试剂 的结构简式为
的结构简式为_______ 。 分子中共平面的原子数最多有
分子中共平面的原子数最多有_______ 个。
(5)设计用呋喃甲醛(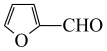 )和环己醇为原料
)和环己醇为原料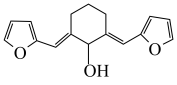 的合成路线
的合成路线_______ (无机试剂任选)。
 的路线如下:
的路线如下:
已知:
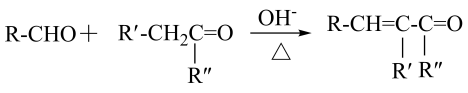
(1)丁香酚的分子式为
(2)
 中的含氧官能团是
中的含氧官能团是(3)写出满足下列条件的
 的所有同分异构体的结构简式
的所有同分异构体的结构简式①含苯环且环上只有两个取代基
②属于酯类化合物
③核磁共振氢谱有3组峰,且峰面积之比为
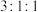
(4)反应⑤的方程式中
 与
与 的系数比为
的系数比为 ,试剂
,试剂 的结构简式为
的结构简式为 分子中共平面的原子数最多有
分子中共平面的原子数最多有(5)设计用呋喃甲醛(
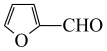 )和环己醇为原料
)和环己醇为原料 的合成路线
的合成路线
您最近一年使用:0次
5 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)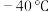 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键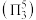 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数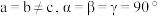 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键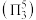 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数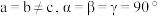 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10473次组卷
|
10卷引用: 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)
河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
解题方法
6 . 我国某科研工作者制备了一种高性能的钾离子电池负极材料(Bi-MOF),如图所示。回答下列问题:

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为_______ ,能量最高的电子所占据的原子轨道的电子云轮廓图为_______ 形。
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为_______ 形; 的立体构型为
的立体构型为_______ 形,H2O的键角_______ (填“>”、“<”或“=”) 的键角。
的键角。
(3)C、N、O的第一电离能由小到大的顺序为_______ ;BTC中C原子的杂化类型有_______ 。
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0, ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。

①2号原子的坐标为_______ 。
②设NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3。

(1)铋的原子序数为83,则基态铋原子的外围电子排布图为
(2)Bi(NO3)3·5H2O中H2O的VSEPR模型为
 的立体构型为
的立体构型为 的键角。
的键角。(3)C、N、O的第一电离能由小到大的顺序为
(4)该电池负极材料充电时,会形成钾铋合金(化学式为K3Bi),其晶胞结构如图,晶胞参数为anm、bnm、cnm,以晶胞参数为单位长度建立原子分数坐标,表示晶胞中的原子位置,若1号原子的坐标为(0,0,
 ),3号原子的坐标为(1,0,
),3号原子的坐标为(1,0, )。
)。
①2号原子的坐标为
②设NA为阿伏加德罗常数的值,该晶体的密度为
您最近一年使用:0次
2023-05-26更新
|
114次组卷
|
3卷引用:河南省驻马店市2022-2023学年高二下学期5月月考化学试题
解题方法
7 . 各种材料的应用使人们的生活变得丰富多彩。
I.某有机发光材料的结构如图1所示。
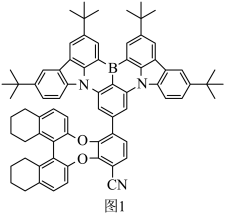
(1)基态N原子的价层电子排布图为_______ ,其中能量最高的电子所占据的原子轨道有_______ 个伸展方向。
(2)B原子与其直接相连的3个碳原子构成的空间结构为_______ 形。
(3)C原子的杂化类型为_______ 。
(4)该物质中第二周期元素的第一电离能由大到小的顺序为_______ (填元素符号)。
II.我国某科研团队首次成功合成单金属内面体偶氮富勒烯(La@C81N)。单晶X射线衍射实验研究表明La@C81 N具有对称性的82原子笼,结构如图2所示。
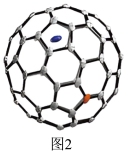
(5)基态La(镧)原子的价层电子排布式为5d1 6s2,与Sc(钪)位于同族,则La位于元素周期表的_______ 区。
(6)1640年Descartes首先证明了“欧拉定理”,即顶点数+面数一棱数=2。1个C81N82原子笼中含_______ 个正六边形、_______ 个正五边形。
III.硒氧化铋是很好的二维半导体材料,其晶胞结构如图3所示。
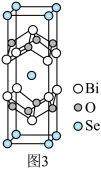
(7)①晶胞中与O最近且等距离的Bi原子数为_______ 。
②已知晶胞参数分别为anm、bnm、cnm,阿伏加德罗常数为NA,则该晶胞的密度为_______ g·cm-3。
I.某有机发光材料的结构如图1所示。

(1)基态N原子的价层电子排布图为
(2)B原子与其直接相连的3个碳原子构成的空间结构为
(3)C原子的杂化类型为
(4)该物质中第二周期元素的第一电离能由大到小的顺序为
II.我国某科研团队首次成功合成单金属内面体偶氮富勒烯(La@C81N)。单晶X射线衍射实验研究表明La@C81 N具有对称性的82原子笼,结构如图2所示。

(5)基态La(镧)原子的价层电子排布式为5d1 6s2,与Sc(钪)位于同族,则La位于元素周期表的
(6)1640年Descartes首先证明了“欧拉定理”,即顶点数+面数一棱数=2。1个C81N82原子笼中含
III.硒氧化铋是很好的二维半导体材料,其晶胞结构如图3所示。

(7)①晶胞中与O最近且等距离的Bi原子数为
②已知晶胞参数分别为anm、bnm、cnm,阿伏加德罗常数为NA,则该晶胞的密度为
您最近一年使用:0次
解题方法
8 . 阿散酸(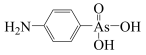 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
(1)基态As原子核外电子排布式为___________ ,As的第一电离能比Se的大的原因为___________ 。
(2) 的中心原子的杂化方式为
的中心原子的杂化方式为___________ , 的空间构型为
的空间构型为___________ 。
(3)与 互为等电子体的分子为
互为等电子体的分子为___________ (填化学式,任写一种即可)。
(4)液氨可作制冷剂,汽化时吸收大量的热的原因是___________ 。
(5)NaCl晶体在50~-300GPa的高压下和Na或Cl2反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为___________ 。
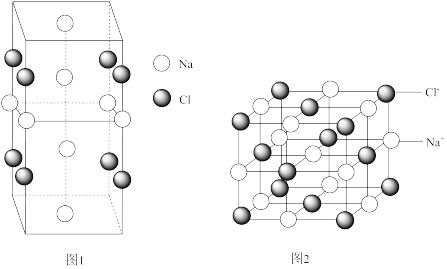
(6)已知NaCl晶胞(如图2)中Na+和Cl-间最短距离为acm,阿伏加德罗常数的值为NA,NaCl晶体的密度为___________ g·cm-3.
 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:(1)基态As原子核外电子排布式为
(2)
 的中心原子的杂化方式为
的中心原子的杂化方式为 的空间构型为
的空间构型为(3)与
 互为等电子体的分子为
互为等电子体的分子为(4)液氨可作制冷剂,汽化时吸收大量的热的原因是
(5)NaCl晶体在50~-300GPa的高压下和Na或Cl2反应,可以形成不同的晶体,其中一种晶体的晶胞如图1所示,该晶体的化学式为

(6)已知NaCl晶胞(如图2)中Na+和Cl-间最短距离为acm,阿伏加德罗常数的值为NA,NaCl晶体的密度为
您最近一年使用:0次
9 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
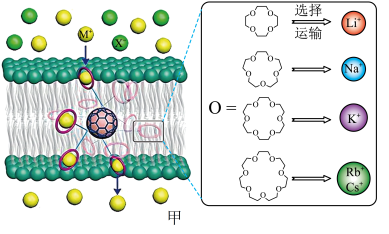
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
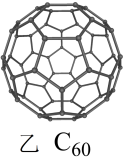
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
(5)铷晶胞为体心立方堆积,如图丙所示。
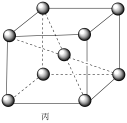
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
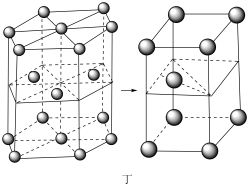
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
2022高三·全国·专题练习
真题
解题方法
10 . 配位化合物X由配体L2-(如图)和具有正四面体结构的[Zn4O]6+构成。______ 。
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为______ 形;每个L2-中采取sp2杂化的C原子数目为______ 个,C与O之间形成σ键的数目为______ 个。
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入______ 。(假设X晶胞形状不变)。
(4)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。______ 。
②X晶体中Zn2+的配位数为______ 。
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为_____ nm。
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为_____ g•cm-3(列出化简的计算式)。
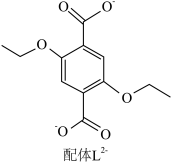
(2)L2-所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为
(3)X晶体内部空腔可吸附小分子,要增强X与H2O的吸附作用,可在L2-上引入
| A.-Cl | B.-OH | C.-NH2 | D.-CH3 |
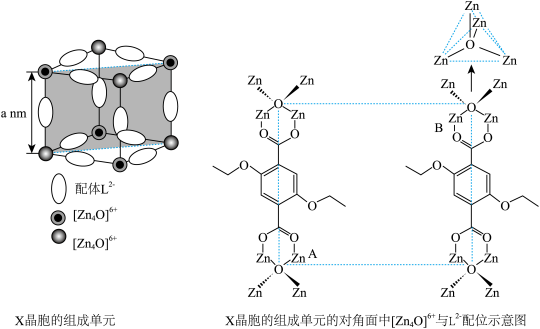
②X晶体中Zn2+的配位数为
③已知ZnO键长为dnm,理论上图中A、B两个Zn2+之间的最短距离的计算式为
④已知晶胞参数为2anm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对分子质量分别为M1和M2,则X的晶体密度为
您最近一年使用:0次



