名校
解题方法
1 . 物质的结构决定其性质,下列实例与解释不 相符的是
| 选项 | 实例 | 解释 |
| A | 邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点 | 分子间氢键使熔沸点升高,分子内氢键使熔沸点降低 |
| B |  与 与 形成配合物 形成配合物 |  中的 中的 有空轨道,可接受 有空轨道,可接受 中 中 的孤电子对 的孤电子对 |
| C |  的沸点高于 的沸点高于 |  原子半径小, 原子半径小, 键能大 键能大 |
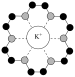
| D | 超分子冠醚(18-冠-6)如图所示,其空穴与 尺寸适配 尺寸适配
| 两者能通过弱相互作用(非化学键)形成超分子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 唑草酮是一种药性强、易降解、污染少的除草剂,其中一种合成路线为:
(1)A中含有官能团的名称为___________ 。
(2)A与B反应得到C和___________ (填结构简式),该反应的目的是___________ 。
(3)F→G的化学方程式为___________ 。
(4)已知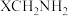 中
中 键极性越大,则碱性越弱,则下列物质的碱性由弱到强的顺序为
键极性越大,则碱性越弱,则下列物质的碱性由弱到强的顺序为___________ (填标号)。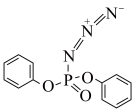 其中杂化轨道类型为
其中杂化轨道类型为 的原子有
的原子有___________ 个。
(6)C的同分异构体中符合下列条件的有___________ 种(不考虑立体异构)。
(7)参照上述合成路线,设计以苯胺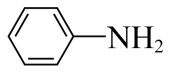 为原料合成
为原料合成 的路线
的路线___________ (无机试剂任选)。

(1)A中含有官能团的名称为
(2)A与B反应得到C和
(3)F→G的化学方程式为
(4)已知
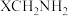 中
中 键极性越大,则碱性越弱,则下列物质的碱性由弱到强的顺序为
键极性越大,则碱性越弱,则下列物质的碱性由弱到强的顺序为a.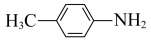 b.
b.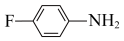 c.
c.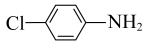
 其中杂化轨道类型为
其中杂化轨道类型为 的原子有
的原子有(6)C的同分异构体中符合下列条件的有
①分子骨架为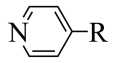 ,且R结构中含有一个“
,且R结构中含有一个“ ”和一个“
”和一个“ ”
”
(7)参照上述合成路线,设计以苯胺
 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
名校
解题方法
3 . 硼是一种重要的化工原料,硼制品广泛应用于化工、冶金、光学玻璃、医药、橡胶及轻工业。
请回答下列问题:
(1)工业上硼的冶炼流程: )的溶解度如下表:
)的溶解度如下表:
①流程中第一步涉及反应的化学方程式为:_______ 。
②流程中,加入硫酸生成 ,冷却降温到10℃,经过的“操作1”是
,冷却降温到10℃,经过的“操作1”是_______ 再洗涤、干燥,得到 。检验
。检验 是否洗涤干净的操作为
是否洗涤干净的操作为_______ 。
③制备单质B过程中易生成含硼化合物杂质,该杂质的化学式是_______ 。
(2)硼酸( )是一种具有片层状结构的白色晶体,层内的
)是一种具有片层状结构的白色晶体,层内的 分子间通过氢键相连(如下图),则
分子间通过氢键相连(如下图),则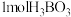 的晶体中有
的晶体中有_____ mol氢键。硼酸( )是一元弱酸,在溶液中能电离生成
)是一元弱酸,在溶液中能电离生成 ,硼酸的电离方程式为:
,硼酸的电离方程式为:_______ ;室温时测得 硼酸溶液的pH=5,则硼酸的电离常数
硼酸溶液的pH=5,则硼酸的电离常数
_______ 。 )是最简单的硼烷。可以在乙醚介质中使用
)是最简单的硼烷。可以在乙醚介质中使用 (离子化合物)还原
(离子化合物)还原 获得,
获得, 中Al原子的杂化方式为
中Al原子的杂化方式为_______ ,制备乙硼烷的化学方程式为_______ (产物中含氢化合物只有一种)。
请回答下列问题:
(1)工业上硼的冶炼流程:

 )的溶解度如下表:
)的溶解度如下表:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 80 |
| 溶解度/g | 2.77 | 3.65 | 4.87 | 6.77 | 8.90 | 23.54 |
②流程中,加入硫酸生成
 ,冷却降温到10℃,经过的“操作1”是
,冷却降温到10℃,经过的“操作1”是 。检验
。检验 是否洗涤干净的操作为
是否洗涤干净的操作为③制备单质B过程中易生成含硼化合物杂质,该杂质的化学式是
(2)硼酸(
 )是一种具有片层状结构的白色晶体,层内的
)是一种具有片层状结构的白色晶体,层内的 分子间通过氢键相连(如下图),则
分子间通过氢键相连(如下图),则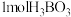 的晶体中有
的晶体中有 )是一元弱酸,在溶液中能电离生成
)是一元弱酸,在溶液中能电离生成 ,硼酸的电离方程式为:
,硼酸的电离方程式为: 硼酸溶液的pH=5,则硼酸的电离常数
硼酸溶液的pH=5,则硼酸的电离常数

 )是最简单的硼烷。可以在乙醚介质中使用
)是最简单的硼烷。可以在乙醚介质中使用 (离子化合物)还原
(离子化合物)还原 获得,
获得, 中Al原子的杂化方式为
中Al原子的杂化方式为
您最近一年使用:0次
2024-03-31更新
|
187次组卷
|
2卷引用:湖南省娄底市2023-2024学年高三下学期一模考试化学试题
4 . 2022年度诺贝尔化学奖授与了点击反应。K。B.Sharpless教授发现,在亚铜的催化下,末端炔烃可以高区域选择性地与叠氮化合物发生高效的点击反应,这一反应目前已经应用于生物化学等交叉领域。点击反应代表性示例如下:
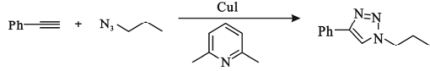 (Ph-:苯基)
(Ph-:苯基)
科学家以环己醇为原料,经过多步转化和点击反应合成化合物G,请按要求回答下面的问题。
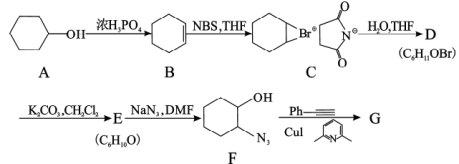
(1)有机物A转化为有机物B的反应类型为___________ ;浓硫酸也可用作该转化的催化剂,此处转化不使用浓硫酸作催化剂,其原因有___________ 。
(2)有机物C经水解反应开环后得到有机物D,有机物D的结构简式为___________ 。
(3)有机物E为双环化合物,其所含官能团的名称为___________ 。
(4)叠氮酸根( )的结构可表示为:
)的结构可表示为: ;其中心原子N的杂化类型为
;其中心原子N的杂化类型为___________ 。
(5)有机物F转化为有机物G的反应方程式为___________ 。
(6)满足下列条件的有机物A的同分异构体有___________ 种(不考虑立体异构)。
条件1:含一个五元环;
条件2:含有两个手性碳原子。
(7)根据点击反应信息和相关知识,设计以苯乙烯和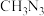 为原料合成
为原料合成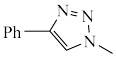 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)___________ 。
 (Ph-:苯基)
(Ph-:苯基)科学家以环己醇为原料,经过多步转化和点击反应合成化合物G,请按要求回答下面的问题。

(1)有机物A转化为有机物B的反应类型为
(2)有机物C经水解反应开环后得到有机物D,有机物D的结构简式为
(3)有机物E为双环化合物,其所含官能团的名称为
(4)叠氮酸根(
 )的结构可表示为:
)的结构可表示为: ;其中心原子N的杂化类型为
;其中心原子N的杂化类型为(5)有机物F转化为有机物G的反应方程式为
(6)满足下列条件的有机物A的同分异构体有
条件1:含一个五元环;
条件2:含有两个手性碳原子。
(7)根据点击反应信息和相关知识,设计以苯乙烯和
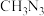 为原料合成
为原料合成 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)
您最近一年使用:0次
5 . 有机化合物X的结构简式如图所示,下列说法正确的是
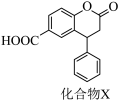

A.X的分子式为 ,1个分子中采取 ,1个分子中采取 杂化的原子数为4 杂化的原子数为4 |
| B.化合物X最多能与2mol NaOH反应 |
| C.在酸性条件下水解,水解产物含有2个手性碳原子 |
| D.分子中所有碳原子可能共平面 |
您最近一年使用:0次
解题方法
6 . 有机一无机杂化铅卤钙钛矿(CH3NH3PbI3 )作为染料敏化剂应用在太阳能电池中,为开发太阳能提供了方向。
(1)Pb位于第六周期IV A族,其基态原子的价电子排布图为_______ 。
(2)CH3NH3PbI3中涉及的短周期元素的电负性由大到小的顺序为_______ (填元素符号)。沸点:CH4_______ (填“ 高于”或“低于”)NH3,原因是_______ 。
(3)有机阳离子CH3NH 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是_______ 、_______ ; 的立体构型为
的立体构型为_______ 。
(4)CH3NH3PbI3的立方晶胞结构如图所示,晶胞中1个Pb2+周围距离最近的I—数目为_______ , 已知晶胞边长为a pm,则CH3NH 与I—之间最短的距离为
与I—之间最短的距离为_______ pm,CH3NH3PbI3的摩尔质量为Mg·mol-1,NA为阿伏加德罗常数的值,则CH3NH3PbI3晶胞的密度为_______ (用含a、M、NA的代数式表示)g·cm-3。

(1)Pb位于第六周期IV A族,其基态原子的价电子排布图为
(2)CH3NH3PbI3中涉及的短周期元素的电负性由大到小的顺序为
(3)有机阳离子CH3NH
 可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是
可通过CH3NH2制备,CH3NH2中C和N的杂化类型分别是 的立体构型为
的立体构型为(4)CH3NH3PbI3的立方晶胞结构如图所示,晶胞中1个Pb2+周围距离最近的I—数目为
 与I—之间最短的距离为
与I—之间最短的距离为
您最近一年使用:0次
名校
解题方法
7 . 2022年春晚中舞蹈诗剧《只此青绿》感动国人。回答下列问题:
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_______ 种。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是_______ (填元素符号),CN-中C原子的杂化方式_______ ,[Fe(CN)6]4-中σ键和π键的数目之比为_______ 。
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是_______ ,S2-配位数为_______ 。若晶胞参数a nm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为_______ (用含a和d的式子表示)。
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是_______ ,为了能观察到溶液Ⅰ中[Cu(H2O)4]2+呈蓝色,可采取的方法是_______ 。
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为_______ (用a、b、c中的字母表示)。
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=_______ mol•L-1 (已知:Cu(OH)2的Ksp=2.2×10-20)
④向溶液Ⅱ中通入NH3至过量观察到的现象是_______ 。
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=
④向溶液Ⅱ中通入NH3至过量观察到的现象是
您最近一年使用:0次
2022-05-12更新
|
366次组卷
|
2卷引用:湖南省桂东县第一中学2021-2022学年高三下学期5月月考化学试题
名校
8 . 氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1) 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
① 电子式
电子式___________ , 分子属于
分子属于___________ (填“极性”或“非极性”)分子,该分子中心原子杂化轨道类型___________ 。
②写出制备 的化学方程式
的化学方程式___________ 。
(2) 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为___________ 。
(3)一定条件下,在水溶液中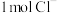 、
、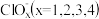 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。
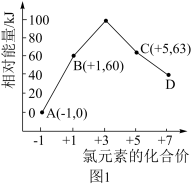
①D是___________ (填离子符号)。
②用离子符号表示B→A+C的热化学方程式___________ 。
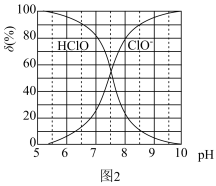
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为___________ 。
(5)以下是 的两种制备方法:方法一:
的两种制备方法:方法一: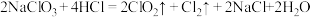
方法二: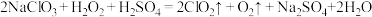
方法二制备的 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是___________ 。
(1)
 为淡棕黄色气体,可由新制的HgO和
为淡棕黄色气体,可由新制的HgO和 反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。
反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。①
 电子式
电子式 分子属于
分子属于②写出制备
 的化学方程式
的化学方程式(2)
 气体可处理污水中的
气体可处理污水中的 。
。 与
与 反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为
反应产生2种无毒气体,反应中氧化剂和还原剂物质的量之比为(3)一定条件下,在水溶液中
 、
、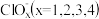 的能量(kJ)相对大小如图1所示。
的能量(kJ)相对大小如图1所示。
①D是
②用离子符号表示B→A+C的热化学方程式
(4)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 ,X为HClO或
,X为HClO或 与pH的关系如图2所示。HClO的电离常数
与pH的关系如图2所示。HClO的电离常数 值为
值为
(5)以下是
 的两种制备方法:方法一:
的两种制备方法:方法一: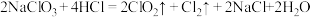
方法二:
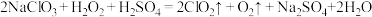
方法二制备的
 更适合用于饮用水的消毒,其主要原因是
更适合用于饮用水的消毒,其主要原因是
您最近一年使用:0次
2022-04-25更新
|
585次组卷
|
3卷引用:湖南省衡阳市衡阳县第一中学2021-2022学年高三下学期期中考试化学试题
9 . 我国科学家预测全固态氟离子电池(CsPb1-xKxF3-x)可能替代锂离子电池。回答下列问题:
(1)基态K原子核外电子云轮廓图呈球形的能级上占据电子总数为_______ 。基态氟离子的电子排布式为_______ 。
(2)常见的含氟分子有HF、SiF4、OF2.其中,属于非极性分子的有_______ (填化学式),氟的电负性大于氯,但是HF的酸性比HCl的弱,其主要原因是_______ (提示:从分子间作用力角度分析)。
(3)我国科学家研究发现,在锂/氟化石墨电池中添加BF3,会提高能量转化效率。放电时,发生反应为LiF(s)+BF3(g)=LiBF4(aq),BF 的空间结构为
的空间结构为_______ ,上述反应中B原子的杂化类型变化为_______ 。
(4)CsF、KF的熔点分别为682℃、858℃,其熔点差异的主要原因是_______ 。
(5)铯、金、氯组成一种晶体,已知金元素有+1、+3价,它的晶胞如图1所示。大灰球为Cs,小黑球为Cl,其余球为Au。该晶体的化学式为_______ ,其中金原子有2种不同的化学环境,形成2种不同的离子,它们是_______ 和_______ 。
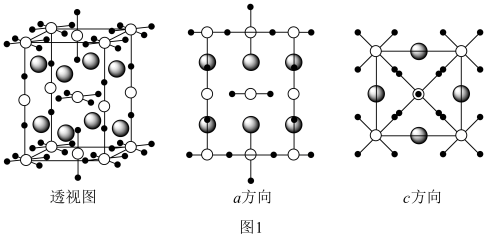
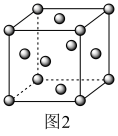
(6)铅单质的面心立方最密晶胞如图2所示。它的晶胞空隙率为_______ (用含π的式子表示;提示:晶胞空隙率=1-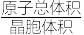 )。
)。
(1)基态K原子核外电子云轮廓图呈球形的能级上占据电子总数为
(2)常见的含氟分子有HF、SiF4、OF2.其中,属于非极性分子的有
(3)我国科学家研究发现,在锂/氟化石墨电池中添加BF3,会提高能量转化效率。放电时,发生反应为LiF(s)+BF3(g)=LiBF4(aq),BF
 的空间结构为
的空间结构为(4)CsF、KF的熔点分别为682℃、858℃,其熔点差异的主要原因是
(5)铯、金、氯组成一种晶体,已知金元素有+1、+3价,它的晶胞如图1所示。大灰球为Cs,小黑球为Cl,其余球为Au。该晶体的化学式为

(6)铅单质的面心立方最密晶胞如图2所示。它的晶胞空隙率为
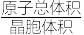 )。
)。
您最近一年使用:0次
名校
解题方法
10 . 我国科学家制备的 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: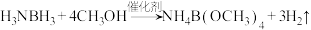
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为_______ 。
(2)已知几种元素的电负性如下表所示。
①上述制氢反应中,有_______ 种元素的原子采取 杂化。
杂化。
② 中键角∠HNH
中键角∠HNH_______ (填“大于”、“小于”或“等于”)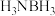 中键角∠HNH。
中键角∠HNH。
③B、C、N、O的电负性依次增大,其主要原因是_______ 。
④在氨硼烷中,H—B键中H带部分_______ (填“正”或“负”)电荷。
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含_______ mol 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为_______ (填元素符号)。

(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为_______ 。

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

① 的空间构型为
的空间构型为_______ , 的配位数为
的配位数为_______ 。
②已知NA为阿伏加德罗常数的值,晶体的密度为_______ (用含a、NA的代数式表示) 。
。
 催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理:
催化剂能实现氨硼烷(H3NBH3)高效制备氢气的目的,制氢原理: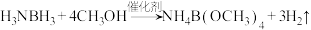
请回答下列问题:
(1)基态Al原子核外电子云轮廓图呈球形、哑铃形的能级上电子数之比为
(2)已知几种元素的电负性如下表所示。
| 元素 | H | B | C | N | O |
| 电负性 | 2.1 | 2.0 | 2.5 | 3.0 | 3.5 |
 杂化。
杂化。②
 中键角∠HNH
中键角∠HNH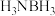 中键角∠HNH。
中键角∠HNH。③B、C、N、O的电负性依次增大,其主要原因是
④在氨硼烷中,H—B键中H带部分
(3)某有机硼化合物的结构简式如图1所示,1mol该有机物中含
 键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
键。组成该有机物的第二周期元素第一电离能由大到小的顺序为
(4)磷化硼是一种新型无机非金属材料,晶胞结构如图2所示。以晶胞参数为单位长度建立坐标系,表示晶胞中各原子的位置,称为原子坐标。a点磷原子的坐标为(0,0,0),b点磷原子的坐标为(1,1,0),则c点硼原子的坐标为

(5)四氢铝钠(NaAlH4)是有机合成中重要的还原剂,晶胞结构如图3所示。

①
 的空间构型为
的空间构型为 的配位数为
的配位数为②已知NA为阿伏加德罗常数的值,晶体的密度为
 。
。
您最近一年使用:0次
2022-04-15更新
|
798次组卷
|
11卷引用:湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题
湖南省湘西自治州2022届高三下学期4月第三次模拟考试化学试题湖南省常德市澧县一中2021-2022学年高三下学期期中考试化学试题湖南省常德市澧县第一中学2021-2022学年高三下学期期中考试化学试题湖南省绥宁县第一中学2022-2023学年高二下学期期中考试化学试题陕西省榆林市 2022届高三第三次模拟考试化学试题(已下线)【直抵名校】02-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点46 原子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点48 晶体结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)