名校
解题方法
1 . 配合物在化学实验中有重要的作用,可以作为催化剂、反应中间体、反应物等参与反应,从而改变反应速率和反应路径
(1)基态Ti原子的价层电子轨道表示式为_____ 。
(2)区分晶态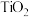 和非晶态
和非晶态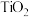 最可靠的科学方法是
最可靠的科学方法是_____ ,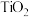 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_____ 。
(3)一种由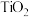 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。_____ ,其中碳原子的杂化方式为_____ 。
②该配合物中心离子是_____ ,配位数为_____ 。
(4)已知配合物的稳定性: ,其原因是
,其原因是_____ 。
(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。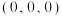 ,B点原子的分数坐标为
,B点原子的分数坐标为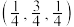 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_____ 。
②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的 ,晶胞密度为
,晶胞密度为_____  (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
(1)基态Ti原子的价层电子轨道表示式为
(2)区分晶态
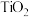 和非晶态
和非晶态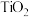 最可靠的科学方法是
最可靠的科学方法是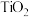 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)一种由
 形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
形成的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。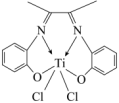
②该配合物中心离子是
(4)已知配合物的稳定性:
 ,其原因是
,其原因是(5)一种由Mg和Fe组成的储氢材料的结构属立方晶系,晶胞参数为
 ,晶胞如图所示(氢未标出)。
,晶胞如图所示(氢未标出)。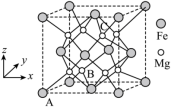
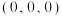 ,B点原子的分数坐标为
,B点原子的分数坐标为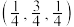 ,则C点原子的分数坐标为
,则C点原子的分数坐标为②该结构中,H原子以正八面体的配位模式有序分布在Fe的周围,H原子与Fe原子之间的最短距离等于晶胞参数的
 ,晶胞密度为
,晶胞密度为 (列出计算式,设阿伏加德罗常数的值为
(列出计算式,设阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
2 . 氮及其化合物应用广泛。回答下列问题:
(1)基态N原子处于最高能级的电子云轮廓图为________ ,能量最低的激发态N3-的核外电子排布式为_________ 。
(2)胍(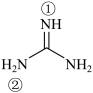 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为___________ ,分子中的大π键可用符号Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为___________ 。胍属于___________ 分子(填“极性”或“非极性”),①号N原子 键角
键角___________ ②号N原子 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是___________ 。
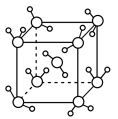
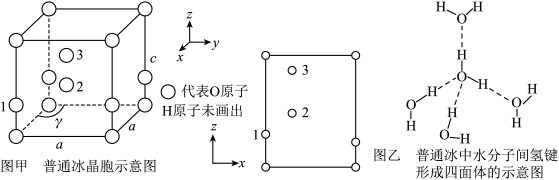
(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为___________ 。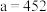 pm,
pm,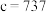 pm,
pm,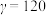 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: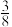 、
、 、
、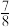 。
。___________ pm。(保留一位小数)
②普通冰晶体的密度为___________ g·cm-3(列出数学表达式,不必计算出结果)。
(1)基态N原子处于最高能级的电子云轮廓图为
(2)胍(
 )为平面形分子,N原子的杂化轨道方式为
)为平面形分子,N原子的杂化轨道方式为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则胍分子中存在的大π键可表示为
),则胍分子中存在的大π键可表示为 键角
键角 键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是
键角(填“>”“<”或“=”),胍易吸收空气中H2O,其原因是(3)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图所示。则该晶体中H2O的配位数为
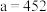 pm,
pm,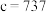 pm,
pm,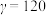 标注为1、2、3的氧原子在Z轴的分数坐标分别为:
标注为1、2、3的氧原子在Z轴的分数坐标分别为: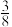 、
、 、
、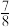 。
。
②普通冰晶体的密度为
您最近一年使用:0次
名校
解题方法
3 . 关于第ⅣA族的元素——碳(C)、硅(Si)、锗(Ge)、锡(Sn)和铅(Pb),它们可形成许多结构各异的物质。回答下列问题:
(1)基态Si原子的价电子轨道表示式为___________ ,有___________ 种不同运动状态的电子。
(2)CH3COOH中C原子的杂化类型是___________ 。
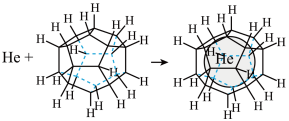
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为___________ 。 、
、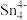 和
和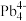 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,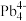 中的键角为
中的键角为___________ 。
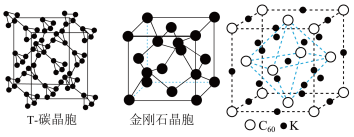
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的___________ 倍。
①该材料的化学式是___________ 。
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=___________ g·cm-3(写出表达式)。
(1)基态Si原子的价电子轨道表示式为
(2)CH3COOH中C原子的杂化类型是
(3)1999年,科学家成功地将一个He原子“装入”了一个C20H20的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为He@ C20H20)。则He@ C20H20中,He与C20H20之间的作用力为
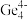 、
、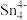 和
和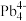 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,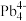 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T-碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,T-碳的密度约为金刚石的一半,T-碳晶体的晶胞、金刚石的晶胞如图所示。则T-碳晶胞的棱长是金刚石晶胞棱长的
①该材料的化学式是
②已知晶胞边长为a=1424pm,则该超导材料的理论密度为ρ=
您最近一年使用:0次
解题方法
4 . 钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度等特性,被美誉为“未来钢铁”“战略金属”。
(1)基态 原子的价层电子排布图为
原子的价层电子排布图为_______ 。
(2)区分晶态 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是_______ , 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为_______ 。
(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。______ ,其中碳原子的杂化方式为_______ 。
②该配合物中心离子是_______ ,0.5mol配合物中含 键的数目为
键的数目为_______ 。
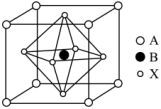
(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子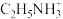 ,另两种离子为
,另两种离子为 和
和 。
。_______ 。
②与 紧邻等距的
紧邻等距的 数为
数为_______ 。
③晶胞中两个最近的 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为_______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)基态
 原子的价层电子排布图为
原子的价层电子排布图为(2)区分晶态
 和非晶态
和非晶态 最可靠的科学方法是
最可靠的科学方法是 与光气
与光气 反应可用于制取四氯化钛,
反应可用于制取四氯化钛, 的空间构型为
的空间构型为(3)Ti的一种配合物丁二酮缩邻氨基酚钛,是高性能的聚烯烃催化剂,其结构如图。
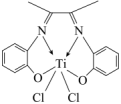
②该配合物中心离子是
 键的数目为
键的数目为(4)某钙钛矿型太阳能光伏电池的有机半导材料的结构如下图所示,其中A为正离子
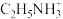 ,另两种离子为
,另两种离子为 和
和 。
。
②与
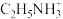 紧邻等距的
紧邻等距的 数为
数为③晶胞中两个最近的
 之间的距离为a pm,晶胞的密度为
之间的距离为a pm,晶胞的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
5 . 硼化物在生产、生活和科研中应用广泛。回答下列问题:
(1)立方氮化硼硬度大,熔点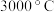 ,其晶体类型为
,其晶体类型为___________ 。
制备氮化硼( )的一种方法为
)的一种方法为 。
。 的空间构型为
的空间构型为___________ ,形成 时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为
时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为___________ (填标号)。 的球棍模型如图1所示。其中B原子的杂化方式有
的球棍模型如图1所示。其中B原子的杂化方式有___________ ,该阴离子中所存在的化学键类型有___________ (填标号)。
(3) 与B组成的金属硼化物结构如图2所示,硼原子全部组成
与B组成的金属硼化物结构如图2所示,硼原子全部组成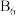 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为___________ ,晶体中 原子的配位数为
原子的配位数为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为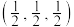 ,已知
,已知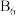 八面体中
八面体中 键的键长为
键的键长为 ,晶胞参数为
,晶胞参数为 ,
, 为阿伏加德罗常数的值,则N点原子的分数坐标为
为阿伏加德罗常数的值,则N点原子的分数坐标为___________ ,该金属硼化物的密度为___________  (列出计算式即可)。
(列出计算式即可)。
(1)立方氮化硼硬度大,熔点
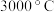 ,其晶体类型为
,其晶体类型为制备氮化硼(
 )的一种方法为
)的一种方法为 。
。 的空间构型为
的空间构型为 时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为
时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式可能为A. 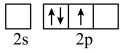 B.
B. 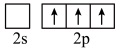 C.
C. 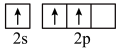 D.
D.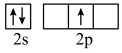
 的球棍模型如图1所示。其中B原子的杂化方式有
的球棍模型如图1所示。其中B原子的杂化方式有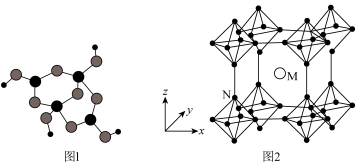
(3)
 与B组成的金属硼化物结构如图2所示,硼原子全部组成
与B组成的金属硼化物结构如图2所示,硼原子全部组成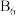 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为 原子的配位数为
原子的配位数为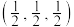 ,已知
,已知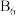 八面体中
八面体中 键的键长为
键的键长为 ,晶胞参数为
,晶胞参数为 ,
, 为阿伏加德罗常数的值,则N点原子的分数坐标为
为阿伏加德罗常数的值,则N点原子的分数坐标为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
6 . 大多有机反应的速率较慢,实际反应中都需要加入一定量的催化剂,其中铜离子、冠醚都是有机反应中的催化剂。回答下列问题:
(1)基态 的价电子排布图为
的价电子排布图为_______ ;与基态 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是_______ (填“ ”或“
”或“ ”),原因为
”),原因为_______ 。
(2)若将 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为_______ ,碳原子的杂化方式为_______ 。 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为_______ 。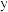 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。_______ 。
②该晶体的空间利用率为_______ (用含a、b的代数式表示);密度为_______ (用含 的代数式表示)
的代数式表示) 。
。
(1)基态
 的价电子排布图为
的价电子排布图为 相比,失去1个电子所需能量较大的是
相比,失去1个电子所需能量较大的是 ”或“
”或“ ”),原因为
”),原因为(2)若将
 转化为螯合物,会降低其催化效果。某
转化为螯合物,会降低其催化效果。某 螯合物的结构简式如图所示,其中
螯合物的结构简式如图所示,其中 的配位数为
的配位数为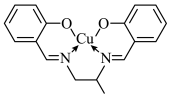
 和
和 的混合溶液中将
的混合溶液中将 筛出(结构简式如图所示),其原理为
筛出(结构简式如图所示),其原理为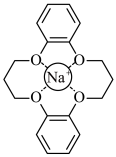
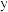 轴投影图如图所示,已知晶胞参数为
轴投影图如图所示,已知晶胞参数为 ,铜原子半径为
,铜原子半径为 ,设
,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。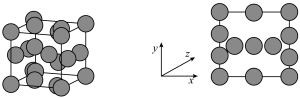
②该晶体的空间利用率为
 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次
2024-04-16更新
|
135次组卷
|
2卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
7 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式___________ 。
(2)D的气态氢化物的VSEPR模型为___________ ,其中心原子的杂化类型为___________ 。
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:___________ (用元素符号作答)。
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
(5)要证明太阳上是否含有R元素,可采用的方法是___________ 。
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有___________ (填元素符号)。
(7)C元素是形成有机物的主要元素,下列分子中含有sp和 杂化方式的是
杂化方式的是___________ (填字母)。
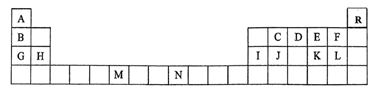
(1)请根据对角线规则写出Be与NaOH 溶液反应的化学方程式
(2)D的气态氢化物的VSEPR模型为
(3)G、H和Ⅰ的第一电离能数值由大到小的顺序为:
(4)C原子在形成化合物时,可采取多种杂化方式。杂化轨道中s轨道成分越多,C元素的电负性越强,连接在该C原子上的H原子越容易电离。下列化合物中,最有可能在碱性体系中形成阴离子的是___________(填编号)。
A. | B. | C. | D.苯 |
(6)与M同周期的所有元素的基态原子中最外层电子数与M原子相同的元素还有
(7)C元素是形成有机物的主要元素,下列分子中含有sp和
 杂化方式的是
杂化方式的是a.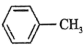 b.
b. c.
c. d.
d.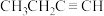
您最近一年使用:0次
名校
解题方法
8 . 2021年10月18日《自然·化学》发表我国科学家研究成果,发现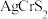 (
( 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态硫原子核外最多有___________ 个电子顺时针旋转,基态铬原子有___________ 种电子运动状态。
(2)氧族元素有氧、硫、硒、碲等元素,这四种元素中,第一电离能最小的是___________ (填元素符号);科学家用亚硒酸盐和硫酸盐跟踪固氮酶,研究反应机理。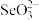 中硒的杂化轨道类型是
中硒的杂化轨道类型是___________ ,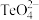 的空间结构模型为
的空间结构模型为___________ ;四种简单氢化物 、
、 、
、 、
、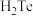 中,键角最大的为
中,键角最大的为___________ ,沸点最高的是___________ 。
(3)配合物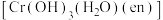 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为___________ (Cr与O、N均形成了配位键),1mol该配合物中含___________ 个 键。
键。
(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为 、
、 ,则C的原子坐标为
,则C的原子坐标为___________ ,已知钙和氧的最近距离为a pm,则该晶体的密度为___________ 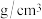 (列出计算式即可)。
(列出计算式即可)。

 (
( 家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:(1)基态硫原子核外最多有
(2)氧族元素有氧、硫、硒、碲等元素,这四种元素中,第一电离能最小的是
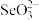 中硒的杂化轨道类型是
中硒的杂化轨道类型是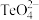 的空间结构模型为
的空间结构模型为 、
、 、
、 、
、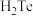 中,键角最大的为
中,键角最大的为(3)配合物
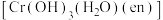 (en为
(en为 )的中心离子配位数为
)的中心离子配位数为 键。
键。(4)复合材料氧铬酸钙的立方晶胞如图所示。已知A、B的原子坐标分别为
 、
、 ,则C的原子坐标为
,则C的原子坐标为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
9 . Co元素的某些化合物在电池、光电材料、催化剂等方面有广泛应用。回答下列问题:
(1)一种具有光催化作用的配合物A结构简式如图所示:
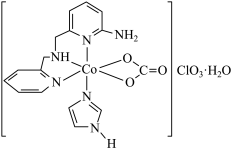
①基态Co原子价电子排布图为___________ 。
②外界 的空间构型为
的空间构型为___________ ,钴元素价态为___________ 。
③配合物A配位数为___________ ,中心离子的杂化方式为___________ (填标号)。
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑( )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是_________ 。
(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为___________ ;NA为阿伏加德罗常数的值,该晶体的密度为___________ g/cm3(用计算式表示)。
(1)一种具有光催化作用的配合物A结构简式如图所示:

①基态Co原子价电子排布图为
②外界
 的空间构型为
的空间构型为③配合物A配位数为
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑(
 )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为
您最近一年使用:0次
2024-01-29更新
|
497次组卷
|
2卷引用:四川省成都市第七中学(林荫校区)2024届高三二诊热身考试理综-化学试题
名校
解题方法
10 . I.我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是______(填字母)。
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有____ 种。
(3)采用空气和Na为原料可直接制备 ,
, 的电子式为
的电子式为________ ,空气与熔融金属Na制备 反应前需依次通过
反应前需依次通过_____ 、_____ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供______ ,在BH3·NH3中B原子的杂化方式为_____ 。
Ⅱ.钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(5)钛元素在元素周期表中的位置______ 。
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有_____ 个;若该晶胞的密度为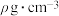 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为______ pm。(用含ρ、 的代数式表示)
的代数式表示)

(1)下列N原子的电子排布图表示的状态中,能量最高的是______(填字母)。
A.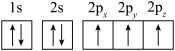 | B.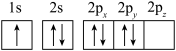 |
C. | D. |
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有
(3)采用空气和Na为原料可直接制备
 ,
, 的电子式为
的电子式为 反应前需依次通过
反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(4)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供
Ⅱ.钛是20世纪50年代发展起来的一种重要的结构金属,钛合金因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。回答下列问题:
(5)钛元素在元素周期表中的位置
(6)氮化钛晶体的晶胞结构如图所示,该晶体结构中与N原子距离最近且相等的Ti原子有
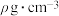 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶胞中Ti原子与N原子的最近距离为
,则晶胞中Ti原子与N原子的最近距离为 的代数式表示)
的代数式表示)
您最近一年使用:0次



