1 . 由醋酸为原料合成某抗病毒药物的路线如图所示:
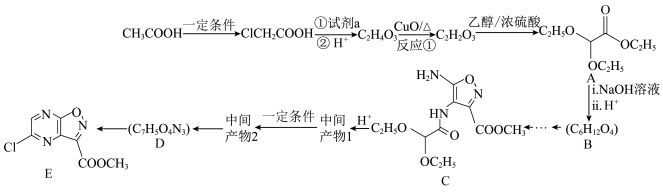
已知: i.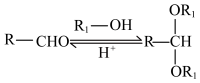
ii. 。
。
回答下列问题:
(1)试剂a是_______ ,反应①的化学方程式是_______ 。
(2)C2H2O3中含有的官能团名称是_______ 。
(3)B的结构简式是_______ ,写出符合下列要求的B的同分异构体:_______ 。
①能发生银镜反应
②核磁共振氢谱中有三组峰
(4)下列说法正确的是_______(填标号)。
(5)上图中由D生成E可看作取代反应,中间产物2和D互为同分异构体,D的结构简式是_______ ,写出中间产物1在一定条件下生成中间产物2的化学方程式:_______ 。

已知: i.

ii.
 。
。回答下列问题:
(1)试剂a是
(2)C2H2O3中含有的官能团名称是
(3)B的结构简式是
①能发生银镜反应
②核磁共振氢谱中有三组峰
(4)下列说法正确的是_______(填标号)。
| A.A能发生取代、氧化反应 |
| B.B中含有手性碳原子 |
| C.C中N原子均采用sp2杂化 |
| D.1mol C与足量NaOH溶液反应,最多消耗1mol NaOH |
您最近一年使用:0次
名校
解题方法
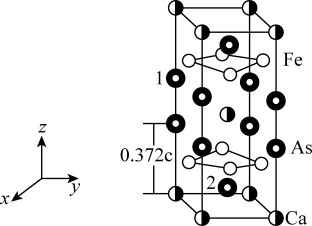
2 . 最近合成的一种铁基超导材料 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有_______ 种不同能级的电子。
(2) 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是_______ 。
(3)Fe可以与CO、NO、 等多种微粒形成配合物。
等多种微粒形成配合物。
①C、N、O的第一电离能由大到小的顺序为_______ 。
②写出 的一种等电子体分子
的一种等电子体分子_______ 。
(4) 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有_______ ,溶质阴离子的中心原子杂化轨道类型为_______ 。
(5)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为a pm、a pm、c pm,晶胞中As原子1分数坐标为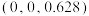 ,则As原子2的分数坐标为
,则As原子2的分数坐标为_______ 。
 ,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
,在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
(1)Fe的基态原子共有
(2)
 的沸点(1935℃)高于
的沸点(1935℃)高于 的沸点(130.2℃)原因是
的沸点(130.2℃)原因是(3)Fe可以与CO、NO、
 等多种微粒形成配合物。
等多种微粒形成配合物。①C、N、O的第一电离能由大到小的顺序为
②写出
 的一种等电子体分子
的一种等电子体分子(4)
 溶液中含有的微粒内部及微粒间作用力除共价键外还有
溶液中含有的微粒内部及微粒间作用力除共价键外还有(5)该材料的化学式为
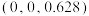 ,则As原子2的分数坐标为
,则As原子2的分数坐标为
您最近一年使用:0次
2022-11-13更新
|
104次组卷
|
2卷引用:福建省宁德市2022-2023学年高三上学期期中区域性学业质量检测化学试题
解题方法
3 . 国内外学者近年来对金属-有机框架(MOFs)作为催化剂光解制氢和还原CO2等方面的研究取得了丰硕的成果。其中Masaya 等人利用Ti- MOF-NH2、H2PtCl6、 DMF 等原料制备了催化剂Pt/Ti- MOF-NH2。回答下列问题:
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是___________ ,处于_____ 区,未成对电子数是________ 。
(2)PtCl 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是___________ , 中心原子采用的杂化类型可能是___________ (填 “dsp2”“sp3”“sp2”或“sp3d2”)。

(3)DMF的结构是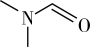 ,σ键与π键的数目比是
,σ键与π键的数目比是___________ ,其中N原子的杂化方式是___________ 。
(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因______ 。
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有___________ 个。若阿伏加德罗常数为NA, 干冰的密度为ρg·cm-3, 则晶胞体对角线长度是___________ cm。
(1)Pt的电子排布式为[Xe]4f145d96s1,则Pt在元素周期表中的位置是
(2)PtCl
 的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
的价层电子对互斥模型如图所示,已知该离子是平面形结构,则该离子中的键角是
(3)DMF的结构是
 ,σ键与π键的数目比是
,σ键与π键的数目比是(4)已知pKa=—lgKa,CCl3CH2OH 的pKa小于CBr3CH2OH,从分子组成与性质之间的关系解释原因
(5)一定条件下, CO2分子可形成干冰晶体,干冰的晶胞模型如图所示。在干冰中,与一个CO2分子紧邻的分子共有

您最近一年使用:0次
名校
4 . 南京理工大学化工学院胡炳成教授团队成功合成世界首个全氮阴离子盐,其局部结构如图所示。下列说法错误的是

A.经 射线衍射可以测得全氮阴离子盐晶体结构 射线衍射可以测得全氮阴离子盐晶体结构 |
| B.全氮阴离子盐两种阳离子中心原子的杂化轨道类型相同 |
C.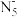 中所有的氮原子在同一平面内 中所有的氮原子在同一平面内 |
D. 的键角比全氮阴离子盐的两种阳离子键角都大 的键角比全氮阴离子盐的两种阳离子键角都大 |
您最近一年使用:0次
2021-07-07更新
|
763次组卷
|
3卷引用:云南省曲靖市第一中学2023-2024学年高二下学期3月月考化学试题
解题方法
5 . 2020年我国“奋斗者”号载人潜水器成功进行万米海试,国产新型材料“钛”牛了!该合金中含钛、铁、镍、铂等十几种元素,具有高强度、高韧性。回答下列问题:
(1)基态Ti原子的核外电子的空间运动状态有___________ 种。TiF4的熔点377℃远高于TiC14(-24.12℃)的原因是___________ 。
(2)邻二氮菲( )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因___________ 。
(3)Ni与Cu的第二电离能:Ni___________ Cu(填“>”或“<”)。含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Ni2+与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________ 个,其中提供孤对电子的原子为___________ (写元素符号)。

(4)①Pt与NH3能够形成顺铂与反铂两种结构,如图所示,由此可判断中心原子Pt杂化方式肯定不是sp3杂化,理由是___________ 。

②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。氯铂酸钾(K2PtC16,式量为486)的立方晶胞结构如图所示,该晶胞中部分PtC1 、K+的分数坐标为PtC1
、K+的分数坐标为PtC1 (0,0,0)、K
(0,0,0)、K (0.25,0.75,0.25)、K
(0.25,0.75,0.25)、K (0.75,0.25,0.25),其中A、B分别代表K+的位置。找出距离PtC1
(0.75,0.25,0.25),其中A、B分别代表K+的位置。找出距离PtC1 (0,0,0)最近的K+
(0,0,0)最近的K+___________ (用分数坐标表示)。用NA表示阿伏加德罗常数的值,若实验测得氯铂酸钾的密度是d g·cm-3,则A、B两个K+的距离为___________ pm(列出计算式即可)。


(1)基态Ti原子的核外电子的空间运动状态有
(2)邻二氮菲(
 )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因
)中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因(3)Ni与Cu的第二电离能:Ni

(4)①Pt与NH3能够形成顺铂与反铂两种结构,如图所示,由此可判断中心原子Pt杂化方式肯定不是sp3杂化,理由是

②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。氯铂酸钾(K2PtC16,式量为486)的立方晶胞结构如图所示,该晶胞中部分PtC1
 、K+的分数坐标为PtC1
、K+的分数坐标为PtC1 (0,0,0)、K
(0,0,0)、K (0.25,0.75,0.25)、K
(0.25,0.75,0.25)、K (0.75,0.25,0.25),其中A、B分别代表K+的位置。找出距离PtC1
(0.75,0.25,0.25),其中A、B分别代表K+的位置。找出距离PtC1 (0,0,0)最近的K+
(0,0,0)最近的K+

您最近一年使用:0次
2021-03-28更新
|
957次组卷
|
4卷引用:云南省丽江市2020-2021学年高二下学期期末教学质量监测理科综合化学试题
云南省丽江市2020-2021学年高二下学期期末教学质量监测理科综合化学试题山东省聊城市2021届高三一模化学试题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)02 物质结构与性质综合题型集训(2) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
名校
解题方法
6 . Fe、Co、Ni 是几种重要的金属元素。请回答下列问题:
(1)基态 Ni 原子的价电子排布式为_______ 。
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4 是_______ 分子(填“极性”或“非极性”)。
(3)实验室常用 KSCN 溶液或苯酚(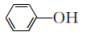 )检验
)检验 。
。
①第一电离能:N_______ O(填“>”或“<”)
②苯酚中碳原子杂化类型为_______ 。
(4)配位化合物 中心原子Co的配位数为
中心原子Co的配位数为_______ ,配位原子为_______ 。
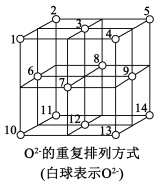
(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为_______ 。
(6)已知 Ni可以形成多种氧化物,其中一种 NixO 晶体的晶胞结构为 NaCl 型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为_______ g·cm-3(NA 表示阿伏加德罗常数的值,只需列出表达式)。
(1)基态 Ni 原子的价电子排布式为
(2)Ni(CO)4常温下为无色液体,沸点42.1℃,熔点-19.3℃,难溶于水,易溶于有机溶剂。推测Ni(CO)4 是
(3)实验室常用 KSCN 溶液或苯酚(
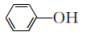 )检验
)检验 。
。①第一电离能:N
②苯酚中碳原子杂化类型为
(4)配位化合物
 中心原子Co的配位数为
中心原子Co的配位数为(5)如图所示,Fe3O4晶体中,O2-围成正四面体空隙(1、3、6、7围成)和正八面体空隙(3、6、7、8、9、12围成),Fe3O4中有一半的
 填充在正四面体空隙中,
填充在正四面体空隙中, 和另一半
和另一半 填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
填充在正八面体空隙中。则没有填充阳离子的正四面体空隙数与没有填充阳离子的正八面体空隙数之比为
(6)已知 Ni可以形成多种氧化物,其中一种 NixO 晶体的晶胞结构为 NaCl 型,由于晶体缺陷导致x=0.88,晶胞参数为a nm,则晶体密度为
您最近一年使用:0次
2021-03-19更新
|
1166次组卷
|
9卷引用:云南省大理州实验中学2022-2023学年高三上学期化学开学考试
云南省大理州实验中学2022-2023学年高三上学期化学开学考试山东省德州市2021届高三下学期高考第一次模拟考试化学试题(已下线)2021年高考化学押题预测卷(新课标Ⅱ卷)(01)(含考试版、答题卡、参考答案、全解全析)山东省日照市2021届高三第二次模拟考试化学试题(已下线)专题18 物质结构与性质综合-备战2022年高考化学真题及地市好题专项集训【山东专用】黑龙江省大庆铁人中学2021-2022学年高三上学期第二次月考化学试题湖南省汨罗市第二中学2021-2022学年高三下学期4月月考化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)新疆维吾尔自治区乌鲁木齐市第一中学2022届高三第一次适应性检测(一模)理综化学试题
7 . Ag2[HgI4]是一种重要的无机热致变色示温材料。回答下列问题:
(1)Hg在元素周期表中位于第六周期,且与Zn同族,则基态Hg原子的价层电子排布式为_____ 。
(2)单质Hg在过量的Cl2中加热可生成HgCl2(熔点280℃,易升华,俗称升汞),则HgCl2的晶体类型为____ 。
(3)HIO3酸性强于HIO的原因是_____ ,IO 的立体构型为
的立体构型为_____ 。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过鳌合配位成环而形成的配合物为螯合物。一种Ag+配合物的结构如图所示。

1mol该配合物中通过鳌合作用与Ag+形成的配位键有_____ mol,该配合物中处于同周期的三种非金属元素,电负性最小的是_____ (填元素符号),其原子的杂化类型为_____ 。
(5)Ag2[HgI4]在低温条件下为四方晶系结构,晶胞参数分别为apm、bpm,a=β=y=90,其晶胞结构如图所示。若Ag2[Hgl4]晶体的密度为ρg·cm-3,则NA=_____ mol-1。

(1)Hg在元素周期表中位于第六周期,且与Zn同族,则基态Hg原子的价层电子排布式为
(2)单质Hg在过量的Cl2中加热可生成HgCl2(熔点280℃,易升华,俗称升汞),则HgCl2的晶体类型为
(3)HIO3酸性强于HIO的原因是
 的立体构型为
的立体构型为(4)含有多个配位原子的配体与同一中心离子(或原子)通过鳌合配位成环而形成的配合物为螯合物。一种Ag+配合物的结构如图所示。

1mol该配合物中通过鳌合作用与Ag+形成的配位键有
(5)Ag2[HgI4]在低温条件下为四方晶系结构,晶胞参数分别为apm、bpm,a=β=y=90,其晶胞结构如图所示。若Ag2[Hgl4]晶体的密度为ρg·cm-3,则NA=

您最近一年使用:0次
名校
解题方法
8 . Fe、Co、Ni是第四周期的重要的金属元素,回答下列问题:
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)_____ I4(Co)(填“>”“<”或“=”),原因是____________________ 。
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为____________
②1mol环戊二烯中有__________ molσ键。
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长__________ nm。
②该晶胞中Fe2+位于S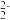 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为______ nm
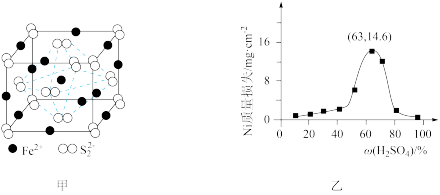
(4)基态Ni2+的价电子排布图为________ 。在一定温度下将Ni片与不同质量分数的硫酸反应,4h后的Ni的质量损失情况如图乙所示,发现当硫酸质量分数大于63%时Ni被腐蚀的速率逐渐降低,其可能原因为__________________ 。
(1)FeCoOx是一种新型光电催化剂,第四电离能大小关系是I4(Fe)
(2)二茂铁是一种具有芳香族性质的有机过渡金属化合物。其在工业、农业、医药、航天、节能、环保等行业具有广泛的应用。环戊二烯可用于制备二茂铁。
①环戊二烯中碳原子的杂化方式为
②1mol环戊二烯中有
(3)①FeS2晶体的晶胞如图甲所示。已知其晶体密度为ρg·cm-3,阿伏加德罗常数的值为NA,晶胞边长
②该晶胞中Fe2+位于S
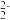 所形成的正八面体的体心,则正八面体的边长为
所形成的正八面体的体心,则正八面体的边长为
(4)基态Ni2+的价电子排布图为
您最近一年使用:0次
名校
解题方法
9 . I.Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为_________ 。
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是_________ 。
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为________ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气: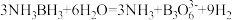 ,
,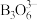 的结构如图所示:
的结构如图所示:
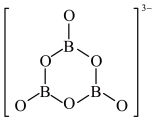
在该反应中,B原子的杂化轨道类型由________ 变为__________ 。
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是__________ 。
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=______ g·cm−3(列出计算式,设NA为阿伏加德罗常数的值)。
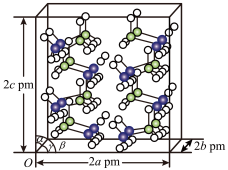
(1)基态Fe2+与Fe3+离子中未成对的电子数之比为
(2)Li及其周期表中相邻元素的第一电离能(I1),I1(Li)> I1(Na),原因是
Ⅱ.氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。
(3)NH3BH3分子中,N—B化学键称为
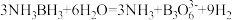 ,
,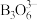 的结构如图所示:
的结构如图所示:
在该反应中,B原子的杂化轨道类型由
(4)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(5)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=

您最近一年使用:0次
2020-11-02更新
|
392次组卷
|
2卷引用:云南省红河州2021届高中毕业生第一次复习统一检测理综化学试题
解题方法
10 . 南京大学某科研团队成功预测并首次大面积合成纳米多孔Cu-Al合金催化剂材料,实现高效率和大产率的电催化还原二氧化碳(CO2)生产乙烯(C2H4)。回答下列问题:
(1)Al元素在周期表中位于________ 区,基态Cu原子的价电子排布式为________ 。
(2)CO2和C2H4中C原子杂化方式分别为________ ,物质的量相同的CO2和C2H4所含σ键数之比为________ 。
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为________ 。
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是________ (填写化学式),从结构的角度解释可能的原因________ 。
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:
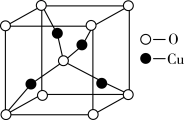
已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=________ g•cm-3(列出计算式即可)。
(1)Al元素在周期表中位于
(2)CO2和C2H4中C原子杂化方式分别为
(3)Cu(OH)2溶于浓氨水形成无色的配离子[Cu(NH3)4]2+,该配离子中配体的立体构型为
(4)工业冶炼铝需要冰晶石,AlF3或NaF均可用于制备冰晶石,AlF3和NaF两种晶体熔点更高的是
(5)Cu与O构成的某种化合物,其晶胞结构如图所示:

已知该晶胞参数为apm,阿伏加 德罗常数的数值为NA,则该晶体的密度ρ=
您最近一年使用:0次



