名校
1 . 前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子的核外电子占据3个能级且每个能级上电子数相等,基态C原子价层电子排布式为 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
(1)基态E原子有___________ 种运动状态不同的电子,D位于元素周期表___________ 区。
(2)在A、B、C、D的简单氢化物中,沸点最高的是___________ (填化学式,下同);键角最大的是___________ 。
(3) 分子中D的杂化类型是
分子中D的杂化类型是___________ ;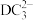 的空间结构为
的空间结构为___________ 。
(4)元素的基态气态原子得到一个电子形成 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:___________ 。
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为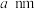 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为___________ ,该晶体密度为___________  。
。
 ,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态
,C、D位于同主族,且基态D原子比基态C原子多2个电子能级,基态 的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:
的核外电子占据的最高能层符号为M且其d轨道达到全充满结构,回答下列问题:(1)基态E原子有
(2)在A、B、C、D的简单氢化物中,沸点最高的是
(3)
 分子中D的杂化类型是
分子中D的杂化类型是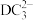 的空间结构为
的空间结构为(4)元素的基态气态原子得到一个电子形成
 价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为
价气态阴离子时所放出的能量称为该元素的第一电子亲和能,单位为 ,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
,习惯规定,放出能量时电子亲和能为正值,吸收能量时电子亲和能为负值。电子亲和能越大,表明越容易得到电子,A、B、C元素的电子亲和能如图所示:
(5)B、E组成的一种立方晶胞如图2所示。已知晶胞参数为
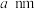 ,设
,设 为阿伏加德罗常数的值,该晶体化学式为
为阿伏加德罗常数的值,该晶体化学式为 。
。
您最近一年使用:0次
名校
解题方法
2 . 离子液体被认为是21世纪最有希望的绿色溶液和功能材料之一,在诸多领域的用途已被研究开发。有几种离子液体由原子序数依次增大的短周期主族元素X、Y、Z、W、R、Q组成。请回答:
(1)基态Z原子的价电子排布式为________ ,基态Y原子占据最高能级的电子云轮廓图为________ 形。
(2)下列说法正确的是____。
(3)试解释 分子中X-W-X键角比
分子中X-W-X键角比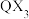 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因________ 。
(4)化合物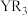 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。
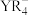 中Y原子的杂化方式为
中Y原子的杂化方式为________ , 晶体中含有
晶体中含有________  氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因________ 。 ,该晶体密度表达式为
,该晶体密度表达式为________  (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
| 元素 | 元素性质或原子结构 |
| X | 电子只有一种自旋取向 |
| Y | 2p能级上有1个电子 |
| Z | 有6个不同运动状态的电子 |
| W | 2p轨道处于半充满状态,简单氢化物易液化,可用作制冷剂 |
| R | 仅有一个未成对电子,简单阴离子含10个电子 |
| Q | 与W位于同一主族 |
(1)基态Z原子的价电子排布式为
(2)下列说法正确的是____。
| A.氢化物的沸点:R>Z | B.分子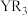 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.元素的电负性:R>X>Z | D.最高价含氧酸的酸性:W>Q |
(3)试解释
 分子中X-W-X键角比
分子中X-W-X键角比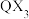 分子中X-Q-X键角大的原因
分子中X-Q-X键角大的原因(4)化合物
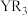 水解生成
水解生成 【也可写作
【也可写作 ,结构如图1】和
,结构如图1】和 。
。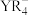 中Y原子的杂化方式为
中Y原子的杂化方式为 晶体中含有
晶体中含有 氢键。当
氢键。当 溶于水,
溶于水, 分子与水中
分子与水中 结合形成配位键,Y原子杂化方式由
结合形成配位键,Y原子杂化方式由 杂化变为
杂化变为 杂化,请用离子方程式解释
杂化,请用离子方程式解释 为一元弱酸原因
为一元弱酸原因 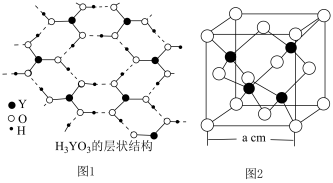
 ,该晶体密度表达式为
,该晶体密度表达式为 (YW的摩尔质量为
(YW的摩尔质量为 )。
)。
您最近一年使用:0次
名校
3 . 欣比克(本维莫德乳膏)是银屑病外用药30年来的新突破,是国家“重大新药创制”国家科技重大专项成果。其合成路线如下:
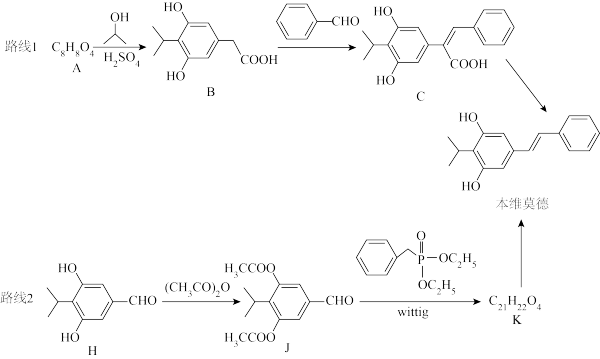
已知: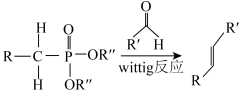
(1)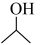 的化学名称为
的化学名称为_______ 。
(2)H中碳原子的杂化方式为_______ 。
(3)B→C涉及两步反应,第①步为加成反应,第②步反应类型为_______ ,写出第①步的反应方程式_______ 。
(4)H→J的目的是_______ 。
(5)K的结构简式为_______ 。
(6)M是A的同分异构体,符合下列条件的M的结构有_______ 种。
A.10 B.16 C.26
Ⅰ.苯环上有三个取代基;
Ⅱ.能发生银镜反应,又能与 溶液发生显色反应;
溶液发生显色反应;
Ⅲ. 能与
能与 反应;
反应;
其中核磁共振氢谱有五组峰,峰面积比为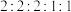 的结构简式为
的结构简式为_______ (写出一种)。
(7)根据上述路线中的相关知识,写出以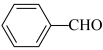 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图_______ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。

已知:

(1)
 的化学名称为
的化学名称为(2)H中碳原子的杂化方式为
(3)B→C涉及两步反应,第①步为加成反应,第②步反应类型为
(4)H→J的目的是
(5)K的结构简式为
(6)M是A的同分异构体,符合下列条件的M的结构有
A.10 B.16 C.26
Ⅰ.苯环上有三个取代基;
Ⅱ.能发生银镜反应,又能与
 溶液发生显色反应;
溶液发生显色反应;Ⅲ.
 能与
能与 反应;
反应;其中核磁共振氢谱有五组峰,峰面积比为
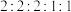 的结构简式为
的结构简式为(7)根据上述路线中的相关知识,写出以
 和
和 为原料制备
为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
名校
解题方法
4 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
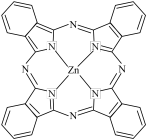
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
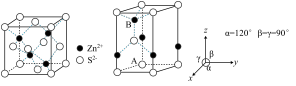
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
解题方法
5 . 寻找室温超导材料一直是科学家们竞相追求的目标, CaFeAsF 、LaH10、H2S等均是近年来的研究热点。回答下列问题:
(1)基态As原子价层电子的电子排布图(轨道表达式)为___________ ,基态La原子价电子排布为5d16s2,成为阳离子时首先失去___________ 轨道电子。
(2)CaFeAsF中,电负性最高的元素是___________ 。
(3)Ca与Fe位于同周期且最外层电子构型相同,Ca的熔点和沸点均比Fe的低,这是因为___________ 。
(4)H2S的的空间构型为___________ ,写出一种与H2S互为等电子体的分子的化学式___________ 。
(5)含砷化合物(以 )中碳原子杂化方式是
)中碳原子杂化方式是___________ , 每个分子中含σ键和π键个数比为___________ 。
(6)Ca、Fe、As构成的超导材料的晶胞结构如图所示,边长为apm,高为cpm,则紧邻的Ca原子之间的距离为___________ pm,该晶体的密度为___________ g•cm-3。

(1)基态As原子价层电子的电子排布图(轨道表达式)为
(2)CaFeAsF中,电负性最高的元素是
(3)Ca与Fe位于同周期且最外层电子构型相同,Ca的熔点和沸点均比Fe的低,这是因为
(4)H2S的的空间构型为
(5)含砷化合物(以
 )中碳原子杂化方式是
)中碳原子杂化方式是(6)Ca、Fe、As构成的超导材料的晶胞结构如图所示,边长为apm,高为cpm,则紧邻的Ca原子之间的距离为

您最近一年使用:0次
解题方法
6 . 铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe原子的核外电子排布式为______________ 。
(2)实验室可用KSCN、苯酚(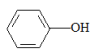 )来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为
)来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为______________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为___________ 。
(3)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含_____ mol  键,与CO互为等电子体的分子是
键,与CO互为等电子体的分子是___________________ (填化学式)。FeSO4常作净水剂和补铁剂, 的立体构型是
的立体构型是_____________________ 。
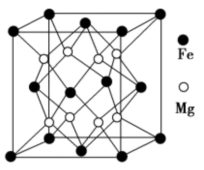
(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。在该晶胞中,与Fe紧邻且最近的Fe数目为_________ 个,若晶胞的参数为d nm,则铁镁合金的密度为_________________ g∙cm-3(不必化简,用NA表示阿伏加德罗常数)。
(1)基态Fe原子的核外电子排布式为
(2)实验室可用KSCN、苯酚(
 )来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为
)来检验Fe3+,C、N、O三种元素的第一电离能由大到小的顺序为(3)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含
 键,与CO互为等电子体的分子是
键,与CO互为等电子体的分子是 的立体构型是
的立体构型是(4)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。在该晶胞中,与Fe紧邻且最近的Fe数目为

您最近一年使用:0次
解题方法
7 . 钴元素的用途广泛,据古文献记载:宜德时期青花瓷使用的颜料“苏勃泥青"是从一种进口钴毒矿[主要成分:(FeCo)xAsS]中提取出来的。
(1)Co的价电子排布式为_______
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于_______ 晶体;砷酸(H3AsO4)分子中As原子的杂化方式为_______ 杂化;砷酸根离子的空间构型为_______ ;第一电离能I1(As)_______ I1(Se)(填“大于”或“小于")。
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是_______ ,每个[Co(NH3)4(H2O)2]3+所含共价键的数目是_______ ,配体NH3的熔沸点大于同族元素氢化物AsH3的原因是_______ 。
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是_______ 。
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为_______ ; 设阿伏加德罗常数的值为NA,则该晶体的密度为_______ (用含a、b、NA的代数式表示) g·cm-3。

(1)Co的价电子排布式为
(2)无水CoCl2的熔点是735°C ,沸点1049°C ,CoCl2属于
(3)[Co(NH3)4(H2O)2]Cl3是一种特殊的配合物,其中心离子的配位数是
(4)钴氰化钾K3[Co(CN)6]是一种浅黄色单斜棱晶体,与配体CN-原子总数相等的等电子体是
(5)金属钴晶体的晶胞结构如图所示,其中正六边形的面积为apm2,棱长为bpm;每个Co距离最近且相等的Co原子数目为

您最近一年使用:0次
解题方法
8 . 点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)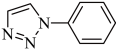 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
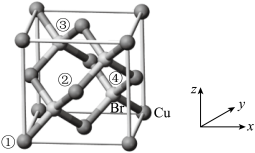
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次
名校
解题方法
9 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。

(1)基态P原子中,电子占据的最高能级符号为________ 。
(2)C、N、O三种元素电负性从大到小的顺序为_____________ ;第一电离能I1(P)_____ I1(Cl)(填“>”或“<”)。
(3)磷酸氯喹中N原子的杂化方式为_____ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___________ 。
(4)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ (用化学式表示)。
(5)CO2在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于____ 晶体。
(6)图3为金刚石晶胞,则1个金刚石晶胞有_________ 个碳原子,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_________ a。




(1)基态P原子中,电子占据的最高能级符号为
(2)C、N、O三种元素电负性从大到小的顺序为
(3)磷酸氯喹中N原子的杂化方式为
(4)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是
(5)CO2在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
(6)图3为金刚石晶胞,则1个金刚石晶胞有



您最近一年使用:0次
名校
解题方法
10 . 硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为______ 。
(2)硼氮苯被称为无机苯,其结构如图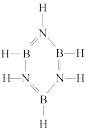 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是___________ 。已知硼氮苯分子在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“大π键”,该“大π键”可表示为__________ (用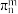 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_______ 。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
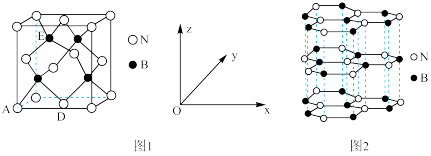
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为___________ 。X-射线衍射实验测得立方氮化硼晶胞边长为a pm,则立方氮化硼晶体中N与B的原子半径之和为________ pm(用含a的式子表示)。
②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为_________ g·cm-3。(已知正六边形面积为 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为
(2)硼氮苯被称为无机苯,其结构如图
 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是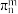 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(
 ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为
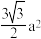 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
您最近一年使用:0次
2020-08-03更新
|
289次组卷
|
3卷引用:广西钦州市第一中学2021届高三8月月考理科综合化学试题



