名校
解题方法
1 . 铁元素在人体健康和新材料研发中有重要的应用。
I.在血液中,以 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图:_________ 。
(2)载氧时,血红蛋白分子中 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是_________ (填字母)。
a. b.
b. c.CO
c.CO
(3)一种最简单的卟啉环结构如图:_________ 。
②比较C和N的电负性大小,并从原子结构角度说明理由:_________ 。
③该卟啉分子在酸性环境中配位能力会减弱,原因是_________ 。
Ⅱ. 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。
(4)该晶体的密度是_________  。
。
(5)距离F最近的Cs的个数为_________ 。
I.在血液中,以
 为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送
为中心的配位化合物铁卟啉是血红蛋白的重要组成部分,可用于输送 ,下图为载氧后的血红蛋白分子示意图:
,下图为载氧后的血红蛋白分子示意图: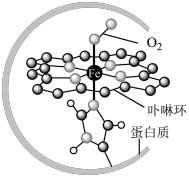
(2)载氧时,血红蛋白分子中
 脱去配位的
脱去配位的 并与
并与 配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与
配位;若人体吸入CO,则CO占据配位点,血红蛋白失去携氧功能。由此推测,与 配位能力最强的是
配位能力最强的是a.
 b.
b. c.CO
c.CO (3)一种最简单的卟啉环结构如图:
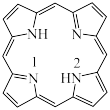
②比较C和N的电负性大小,并从原子结构角度说明理由:
③该卟啉分子在酸性环境中配位能力会减弱,原因是
Ⅱ.
 可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。
可用于制备优良铁磁体材料。下图是一种铁磁体化合物的立方晶胞,其边长为a pm。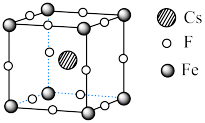
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。
。(4)该晶体的密度是
 。
。(5)距离F最近的Cs的个数为
您最近一年使用:0次
2024-05-27更新
|
279次组卷
|
2卷引用:天津市耀华中学2024届高三下学期第二次模拟化学试题
名校
解题方法
2 .  、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:
(1)钕(Nd)属于镧系元素,则其在元素周期表中处于___________ 区, 的价电子排布图为
的价电子排布图为___________ 。
(2) 的立体构型为
的立体构型为___________ ;F原子核外有___________ 种不同空间运动状态的电子。
(3) 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为___________ 。该物质中是否存在配位键___________ (填“是”或“否”)。
(4) 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。___________ 。
②该晶体密度为 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为___________ pm。
(5) 的制备:称取研细的
的制备:称取研细的 和
和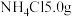 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式___________ 。若上述实验过程中得到 ,则其中所含的
,则其中所含的 键数目为
键数目为___________ 。
(6)已知某温度下 的电离平衡常数:
的电离平衡常数: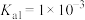 、
、 ,
,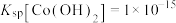 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:___________ 。
 、
、 是新型磁性材料的成分,设
是新型磁性材料的成分,设 为阿伏加德罗常数的值,依据其中有关元素回答问题:
为阿伏加德罗常数的值,依据其中有关元素回答问题:(1)钕(Nd)属于镧系元素,则其在元素周期表中处于
 的价电子排布图为
的价电子排布图为(2)
 的立体构型为
的立体构型为(3)
 是一种还原剂,B原子的杂化方式为
是一种还原剂,B原子的杂化方式为(4)
 的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。
的钙钛矿型晶胞结构如图所示,其中Co填充在F形成的正八面体中心。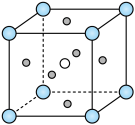
②该晶体密度为
 ,则K和Co之间的最短距离为
,则K和Co之间的最短距离为(5)
 的制备:称取研细的
的制备:称取研细的 和
和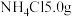 于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的
于烧杯中溶解;将溶液转入三颈烧瓶,分液漏斗中分别装有25mL浓氨水、5mL30%的 溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得
溶液,控制反应温度为60℃,打开分液漏斗,反应一段时间后,得 溶液。写出该反应的离子方程式
溶液。写出该反应的离子方程式 ,则其中所含的
,则其中所含的 键数目为
键数目为(6)已知某温度下
 的电离平衡常数:
的电离平衡常数: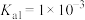 、
、 ,
,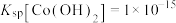 、
、 。写出该温度时向
。写出该温度时向 碳酸钠溶液中逐滴加入
碳酸钠溶液中逐滴加入 溶液,生成沉淀的离子方程式:
溶液,生成沉淀的离子方程式:
您最近一年使用:0次
解题方法
3 . 乙炔是最简单的炔烃,常用氧炔焰来焊接或切割金属。下列有关其化学用语表达错误的是
A.电子式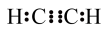 |
B.球棍模型 |
C.C原子杂化轨道电子云轮廓图 |
D.基态C原子价层电子排布图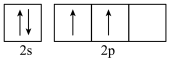 |
您最近一年使用:0次
名校
解题方法
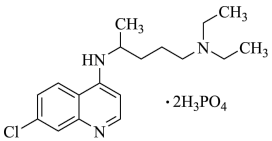
4 . 磷酸氯喹在细胞水平上能有效抑制新型冠状病毒( )的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
(1)基态P原子中,电子占据的最高能级符号为___________ 。
(2)磷酸氯喹中N原子的杂化方式为___________ , 沸点比
沸点比 的沸点高,其原因是
的沸点高,其原因是___________ 。
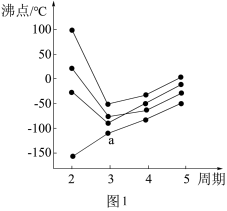
(3)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________ (用化学式表示)。
(4) 在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于___________ 晶体。

(5)图3为 晶胞,
晶胞, 晶体中
晶体中 距离最近且相等的
距离最近且相等的 有
有___________ 个,若晶胞边长为 ,则该晶体的密度为
,则该晶体的密度为___________  。(用
。(用 表示阿伏加德罗常数)
表示阿伏加德罗常数)
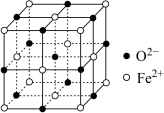
图3
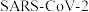 )的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
(1)基态P原子中,电子占据的最高能级符号为
(2)磷酸氯喹中N原子的杂化方式为
 沸点比
沸点比 的沸点高,其原因是
的沸点高,其原因是(3)如图1所示,每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是

(4)
 在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
在高温高压下所形成的晶体其晶胞如图2所示。则该晶体的类型属于
(5)图3为
 晶胞,
晶胞, 晶体中
晶体中 距离最近且相等的
距离最近且相等的 有
有 ,则该晶体的密度为
,则该晶体的密度为 。(用
。(用 表示阿伏加德罗常数)
表示阿伏加德罗常数)
图3
您最近一年使用:0次
名校
解题方法
5 . 某油脂厂废弃的油脂加氢反应的镍催化剂主要含金属Ni、Al、Fe 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O);

回答下列问题:
(1)“碱浸”中NaOH除了能够将铝元素去除外,另一个作用是___________ 。
(2)基态Ni2+的价层电子排布图为___________ ,Ni在元素周期表中位于___________ 区。
(3)“转化”过程宜控制较低温度的原因是___________ ;H2O2的结构如图所示,则 H2O2是_________ 分子(填“极性”或“非极性”),转化过程中的双氧水可用O3代替,O3中的中心O原子的杂化方式为___________ ,O3的空间构型是___________ ,O3是___________ 分子(填“极性”或“非极性”)。

(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH,写出该反应的离子方程式:___________ 。
(5)Ni 和La 的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示。该晶胞中粒子个数比La:Ni=__________ ,该合金储氢后,如下图,1mol该合金可吸附H2的物质的量为___________ 。


回答下列问题:
(1)“碱浸”中NaOH除了能够将铝元素去除外,另一个作用是
(2)基态Ni2+的价层电子排布图为
(3)“转化”过程宜控制较低温度的原因是

(4)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH,写出该反应的离子方程式:
(5)Ni 和La 的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示。该晶胞中粒子个数比La:Ni=

您最近一年使用:0次
解题方法
6 . 非金属元素及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)As4S4俗称雄黄,其中基态砷原子价电子排布式为___________ 。
(2)HOCH2CN分子中含有的σ键与π键数目之比为___________ ,该化合物中碳原子的杂化方式为___________ ,其中位于同一周期元素中第一电离能由大到小的顺序为:___________ 。
(3)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是___________ 。
(4)砷化镓晶体结构如图所示,晶胞参数为a nm,已知阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式___________ g·cm-3

(5)已知氨氮废水中氨元素多以NH 和NH3·H2O的形式存在。某工厂处理氨氮废水流程如下:
和NH3·H2O的形式存在。某工厂处理氨氮废水流程如下:

已知:达标废水中氯元素主要以Cl- 形式存在。
①NaClO电子式为___________ 。
②过程Ⅱ加入NaClO可将废水中的NH3·H2O转化为无污染气体,该反应的化学方程式为___________ 。
(1)As4S4俗称雄黄,其中基态砷原子价电子排布式为
(2)HOCH2CN分子中含有的σ键与π键数目之比为
(3)甘氨酸(H2NCH2COOH)是最简单的一种氨基酸,其相对分子质量为75,而戊烷相对分子质量为72,与甘氨酸相差不大,但甘氨酸易溶解于水,戊烷却难溶解于水,出现这种差异的原因是
(4)砷化镓晶体结构如图所示,晶胞参数为a nm,已知阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式

(5)已知氨氮废水中氨元素多以NH
 和NH3·H2O的形式存在。某工厂处理氨氮废水流程如下:
和NH3·H2O的形式存在。某工厂处理氨氮废水流程如下:
已知:达标废水中氯元素主要以Cl- 形式存在。
①NaClO电子式为
②过程Ⅱ加入NaClO可将废水中的NH3·H2O转化为无污染气体,该反应的化学方程式为
您最近一年使用:0次
2023·天津·模拟预测
7 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。
(1)基态Fe的价层电子排布式为______ 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
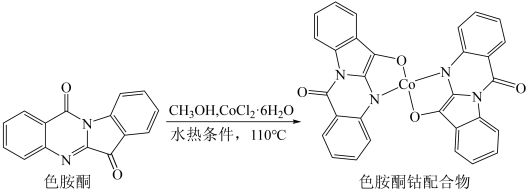
①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为______ 。
②色胺酮分子中N原子的杂化类型为______ 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_______ 作用与色胺酮钴配合物相结合,CH3OH分子内______ π键。(填“有”或“没有”)
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有______ 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为______ g•cm-3。(1nm=10-9m)
(1)基态Fe的价层电子排布式为
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。

①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为
②色胺酮分子中N原子的杂化类型为
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为
您最近一年使用:0次
名校
解题方法
8 . Fe、Co、Ni、Cu、Ag是一系列合金的重要金属元素。
(1)Fe元素位于周期表的_______ 区,基态 其核外电子有多少种空间运动状态
其核外电子有多少种空间运动状态_______ ;元素周期表中,铜、银位于同一副族相邻周期,则基态银原子的价层电子排布式为_______ 。
(2)照相底片定影时,常用定影液硫代硫酸钠( )溶解未曝光的溴化银(AgBr),生成含
)溶解未曝光的溴化银(AgBr),生成含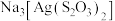 的废定影液。
的废定影液。 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为_______ ,基态S原子中,核外电子占据的最高能级的符号是_______ ,占据最高能级电子的电子云轮廓图为_______ 形。

(3)Co可形成 配合物,1mol
配合物,1mol 中含有σ键的数目为
中含有σ键的数目为_______ 。
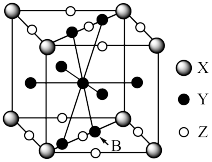
(4)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为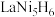 ,晶胞如图所示,则Z表示的微粒为
,晶胞如图所示,则Z表示的微粒为_______ (填化学式),晶胞参数=_______ pm。(用代数式表示,已知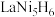 的摩尔质量为
的摩尔质量为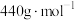 ,晶体密度为
,晶体密度为 ,
, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)Fe元素位于周期表的
 其核外电子有多少种空间运动状态
其核外电子有多少种空间运动状态(2)照相底片定影时,常用定影液硫代硫酸钠(
 )溶解未曝光的溴化银(AgBr),生成含
)溶解未曝光的溴化银(AgBr),生成含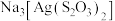 的废定影液。
的废定影液。 离子结构如图所示,其中心硫原子的杂化方式为
离子结构如图所示,其中心硫原子的杂化方式为
(3)Co可形成
 配合物,1mol
配合物,1mol 中含有σ键的数目为
中含有σ键的数目为(4)镧镍合金是重要储氢材料。镧镍合金储氢后所得的晶体的化学式为
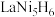 ,晶胞如图所示,则Z表示的微粒为
,晶胞如图所示,则Z表示的微粒为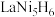 的摩尔质量为
的摩尔质量为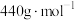 ,晶体密度为
,晶体密度为 ,
, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
9 . 铁、锌、铜等过渡金属元素及其化合物在生产、生活中有着广泛应用。回答下列问题:
(1)基态Cu的核外电子排布式为___________ 。
(2)甘氨酸锌[(H2NCH2COO)2Zn]是 某种饲料添加剂,在该化合物中所涉及到的元素中,第一电离能最大的是______ ; C原子的杂化方式为:___________ 。
(3)Fe3+可与噻吩( )和吡咯(
)和吡咯( )形成配位化合物。试比较二者在水中的溶解度大小:噻吩
)形成配位化合物。试比较二者在水中的溶解度大小:噻吩___________ 吡咯(填“大于 ”或“小于”或“等于”),原因为:_____ 。
(4)硫酸亚铁铵[(NH4)2Fe(SO4)2]俗名摩尔盐,是一种重要的化工原料。固态摩尔盐的晶体类型为___________ ; 的空间构型为
的空间构型为___________ 。
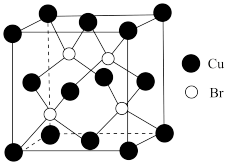
(5)某种铜的溴化物晶体结构如图所示。则该化合物的化学式为___________ ,设晶胞参数为anm,该铜的溴化物晶体的密度为___________ g·m-3。(用含a和NA的式子表示,NA为阿伏加德罗常数)
(1)基态Cu的核外电子排布式为
(2)甘氨酸锌[(H2NCH2COO)2Zn]是 某种饲料添加剂,在该化合物中所涉及到的元素中,第一电离能最大的是
(3)Fe3+可与噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。试比较二者在水中的溶解度大小:噻吩
)形成配位化合物。试比较二者在水中的溶解度大小:噻吩(4)硫酸亚铁铵[(NH4)2Fe(SO4)2]俗名摩尔盐,是一种重要的化工原料。固态摩尔盐的晶体类型为
 的空间构型为
的空间构型为(5)某种铜的溴化物晶体结构如图所示。则该化合物的化学式为

您最近一年使用:0次
名校
解题方法
10 . 2022年春晚中舞蹈诗剧《只此青绿》感动国人。回答下列问题:
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_______ 种。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是_______ (填元素符号),CN-中C原子的杂化方式_______ ,[Fe(CN)6]4-中σ键和π键的数目之比为_______ 。
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是_______ ,S2-配位数为_______ 。若晶胞参数a nm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为_______ (用含a和d的式子表示)。
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是_______ ,为了能观察到溶液Ⅰ中[Cu(H2O)4]2+呈蓝色,可采取的方法是_______ 。
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为_______ (用a、b、c中的字母表示)。
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=_______ mol•L-1 (已知:Cu(OH)2的Ksp=2.2×10-20)
④向溶液Ⅱ中通入NH3至过量观察到的现象是_______ 。
(1)石青,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
(2)亚铁氰化钾,化学式为K4[Fe(CN)6]。[Fe(CN)6]4-中配体CN-的配位原子是
(3)Cu2S晶胞中S2-的位置如图1所示,侧视图如图2所示,Cu+位于S2-所构成的四面体中心。

Cu+填充了晶胞中四面体空隙的百分率是
(4)Cu2+可与H2O、Cl-、NH3等配体形成配位数为4的配离子,如[Cu(H2O)4]2+、[CuCl4]2-、[Cu(NH3)4]2+。某同学按如下步骤完成实验:

①[Cu(H2O)4]2+呈蓝色,但溶液Ⅰ却呈黄绿色,其原因是
②CuCl2溶液中的铜主要以[Cu(H2O)4]2+、[CuCl4]2-形式存在。常温下,将CuCl2溶于浓盐酸中,测定平衡体系中:[Cu(H2O)4]2+浓度为a mol•L-1、Cl-浓度为b mol•L-1、[CuCl4]2-浓度为c mol•L-1,Cl-的转化率为
③常温下,用惰性电极电解浓度较大的CuCl2溶液,当电解到阴极附近出现蓝色Cu(OH)2絮状物,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=
④向溶液Ⅱ中通入NH3至过量观察到的现象是
您最近一年使用:0次
2022-05-12更新
|
366次组卷
|
2卷引用:天津市和平区2022届高三第二次质量调查化学试题



