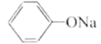
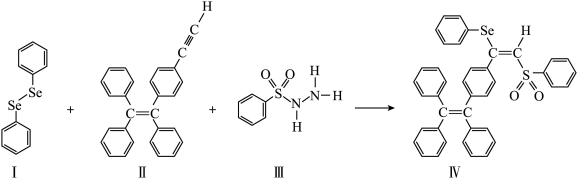
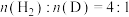1 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:___________ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是___________ 。
(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有___________ 。
A.Ⅰ中有σ键和π键
B.Ⅰ中的 键为极性共价键
键为极性共价键
C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与
E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有___________ 。
(5)硒的两种含氧酸的酸性强弱为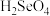
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(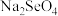 )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为___________ 。
(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(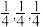 ),则C的原子坐标参数为
),则C的原子坐标参数为___________ 。
(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有
A.Ⅰ中有σ键和π键
B.Ⅰ中的
 键为极性共价键
键为极性共价键C.Ⅱ难溶于水
D.Ⅱ中原子的杂化轨道类型只有sp与

E.Ⅲ含有的元素中,N电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为
 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒;
)可减轻重金属铊引起的中毒; 的立体构型为
的立体构型为(6)CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示,其中原子坐标参数A为(
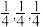 ),则C的原子坐标参数为
),则C的原子坐标参数为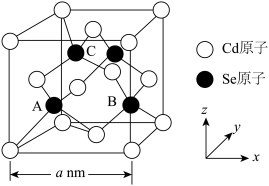
您最近一年使用:0次
2 . 千金藤素常用于防治肿瘤病患者白细胞减少症、抗疟疾、调节免疫功能等,制备其关键中间体(I)的一种合成路线如下:
(1)化合物A的名称为______ ;化合物C中含有的官能团名称为___________ 。
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途________________ 。
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为_____________________ (写出一种)。
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
(5)下列说法正确的是
(6)参照上述路线,以 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
①原料ⅲ为_____________ (写结构简式)。
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为_____________________ 。
③最后一步反应类型为____________ 。
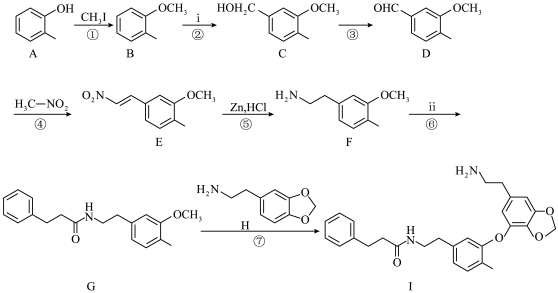
(1)化合物A的名称为
(2)反应②是原子利用率100%的反应,写出化合物ⅰ的一种用途
(3)芳香化合物x为ⅱ的同分异构体,能发生水解反应,且核磁共振氢谱中4组峰的面积之比为6∶2∶1∶1。x的结构简式为
(4)根据化合物D的结构特征,分析预测其主要的化学性质,完成下表。
序号 | 可反应的试剂 | 反应形成的新结构 | 消耗反应物的物质的量之比 |
① | 新制 | 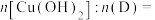 | |
② |
|
|
(5)下列说法正确的是
A.有机物A碳原子杂化方式有 、 、 | B.反应①,有C-I键和H-O键断裂 |
C.1mol化合物B中,含 键16 键16 个 个 | D.产品I属于极性分子,易溶于水和酒精 |
(6)参照上述路线,以
 、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:
、ⅲ(一种二溴代烃)为主要原料合成流程中的物质H,基于你的设计,回答下列问题:①原料ⅲ为
②相关步骤涉及芳香醇转化为芳香醛的反应,对应的化学方程式为
③最后一步反应类型为
您最近一年使用:0次
3 . 固定和利用 能有效地利用资源并减少空气中的温室气体。聚碳酸酯的合成路径如下:
能有效地利用资源并减少空气中的温室气体。聚碳酸酯的合成路径如下:___________ 。化合物X为Ⅱ的同分异构体,X结构中有苯环,分子中有4组核磁共振氢谱吸收峰,且峰面积之比为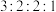 ,能发生银镜反应,则X的命名是
,能发生银镜反应,则X的命名是___________ 。
(2)关于化合物Ⅱ与 反应生成化合物Ⅲ的说法中,不正确的是___________。(填序号)
反应生成化合物Ⅲ的说法中,不正确的是___________。(填序号)
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
(4)化合物V与双酚A(Ⅵ)反应生成高分子Ⅶ 并产生一种可循环的有机物。此物质为化合物___________ (填物质序号),并写出双酚A的结构简式___________ 。
(5)根据上述信息,设计以乙烯为基础原料合成化合物V(DPC)的路线___________ 。(不需注明反应条件,其他试剂任选)
 能有效地利用资源并减少空气中的温室气体。聚碳酸酯的合成路径如下:
能有效地利用资源并减少空气中的温室气体。聚碳酸酯的合成路径如下:
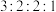 ,能发生银镜反应,则X的命名是
,能发生银镜反应,则X的命名是(2)关于化合物Ⅱ与
 反应生成化合物Ⅲ的说法中,不正确的是___________。(填序号)
反应生成化合物Ⅲ的说法中,不正确的是___________。(填序号)| A.化合物Ⅲ能发生水解反应 |
| B.该反应属于加成反应,符合绿色化学要求,原子利率100% |
| C.化合物Ⅱ、Ⅲ中均不存在手性碳原子 |
D. 属于非极性分子,分子中存在由p轨道“肩并肩”形成的π键 属于非极性分子,分子中存在由p轨道“肩并肩”形成的π键 |
(3)根据化合物V的结构特征,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新有机物结构简式 | 反应类型 |
| a | 加成反应 | ||
| b |
|
(4)化合物V与双酚A(Ⅵ)反应生成高分子Ⅶ 并产生一种可循环的有机物。此物质为化合物
(5)根据上述信息,设计以乙烯为基础原料合成化合物V(DPC)的路线
您最近一年使用:0次
解题方法
4 . 负载金属催化剂对有效提高产率、发展绿色化学技术和有机合成新方法意义重大。其参与合成化合物Ⅸ的路线如下:
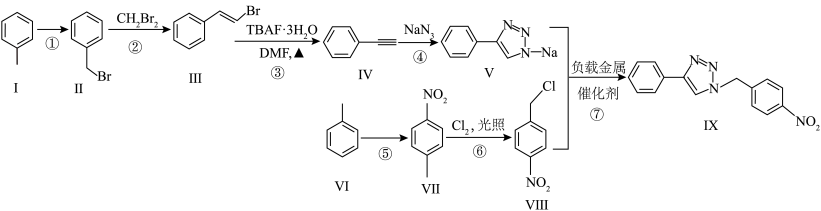
(1)化合物Ⅰ的分子式为________ ,化合物Ⅲ中碳原子的杂化轨道类型为________ 。
(2)化合物Ⅱ发生水解反应生成有机产物的官能团名称为________ ,根据生成新的有机产物的结构特征,分析预测其可能的化学性质,完成下表。
(3)下列关于反应⑦正确的有________(填序号)。
(4)在Ⅷ的芳香同分异构体中,其中含 和
和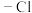 结构的有
结构的有________ 种(不考虑立体异构),核磁共振氢谱图上有四组峰且峰面积之比为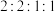 的结构简式为
的结构简式为________ (写一种)。
(5)设计以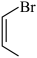 和
和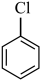 为原料合成
为原料合成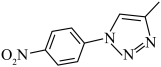 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:
(a)最后一步反应中,有机反应物为________ (写结构简式)。
(b)相关步骤涉及到卤代烃制炔烃的反应,其反应类型为________ 。
(c)从氯苯出发,第一步反应的化学方程式为________ (注明反应条件)。

(1)化合物Ⅰ的分子式为
(2)化合物Ⅱ发生水解反应生成有机产物的官能团名称为
序号 | 反应试剂与条件 | 反应形成的新结构 | 反应类型 |
a | 加成反应 | ||
b | 氧化反应(生成有机产物) |
(3)下列关于反应⑦正确的有________(填序号)。
| A.该反应为原子利用率100%的反应 |
| B.反应过程中,有σ键、π键的断裂和形成 |
| C.反应物Ⅷ的质谱图中最大质荷比为171.5 |
| D.生成物Ⅸ属于极性分子,且无手性 |
(4)在Ⅷ的芳香同分异构体中,其中含
 和
和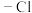 结构的有
结构的有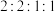 的结构简式为
的结构简式为(5)设计以
 和
和 为原料合成
为原料合成 。基于你设计的合成路线,回答下列问题:
。基于你设计的合成路线,回答下列问题:(a)最后一步反应中,有机反应物为
(b)相关步骤涉及到卤代烃制炔烃的反应,其反应类型为
(c)从氯苯出发,第一步反应的化学方程式为
您最近一年使用:0次
解题方法
5 . 化学小组在实验室利用下图装置制备KClO3和NaClO,并探究两者氧化性强弱和进行系列实验。

回答下列问题:
(1)盛放9 mol•L−1盐酸的仪器名称是___________ ,b中采用的加热方式是___________ 。
(2)c中制备NaClO的化学反应离子方程式是___________ 。
(3)d中浸有Na2S2O3溶液的棉花的作用是___________ 。
(4)甲同学取少量KClO3和NaClO溶液分别置于1号和2号试管中,然后分别滴加少量Na2SO3 溶液。两支试管均无明显现象,但试管2的试管壁发烫。他设计实验进一步验证该条件下KClO3的氧化能力小于NaClO___________ 。[仅供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液]
(5)乙同学研究发现,ClO-与ClO 的中心原子Cl都是
的中心原子Cl都是___________ 杂化,但ClO- 空间结构呈直线型而ClO 呈
呈___________ 。与ClO 相比,ClO- 中氯氧键键能较小,更容易断裂,氧化能力更强。
相比,ClO- 中氯氧键键能较小,更容易断裂,氧化能力更强。
(6)丙同学基于(4)中甲同学的实验事实,用滴定法测定某NaClO溶液的浓度。实验步骤如下:
①量取25.00mL未知浓度的NaClO溶液放入锥形瓶中,加入过量的a mol•L-1 的Na2SO3溶液b mL。
②用c mol•L-1的酸性KMnO4溶液滴定剩余的Na2SO3,发生反应的化学方程式为:2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O。当到达滴定终点时记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL。
③计算该所测NaClO溶液的浓度为___________ mol•L-1(用含a、b、c、v的代数式表示)。
(7)NaClO溶液具有强氧化性,写出其在生产或生活中的一种应用___________ 。

回答下列问题:
(1)盛放9 mol•L−1盐酸的仪器名称是
(2)c中制备NaClO的化学反应离子方程式是
(3)d中浸有Na2S2O3溶液的棉花的作用是
(4)甲同学取少量KClO3和NaClO溶液分别置于1号和2号试管中,然后分别滴加少量Na2SO3 溶液。两支试管均无明显现象,但试管2的试管壁发烫。他设计实验进一步验证该条件下KClO3的氧化能力小于NaClO
(5)乙同学研究发现,ClO-与ClO
 的中心原子Cl都是
的中心原子Cl都是 呈
呈 相比,ClO- 中氯氧键键能较小,更容易断裂,氧化能力更强。
相比,ClO- 中氯氧键键能较小,更容易断裂,氧化能力更强。(6)丙同学基于(4)中甲同学的实验事实,用滴定法测定某NaClO溶液的浓度。实验步骤如下:
①量取25.00mL未知浓度的NaClO溶液放入锥形瓶中,加入过量的a mol•L-1 的Na2SO3溶液b mL。
②用c mol•L-1的酸性KMnO4溶液滴定剩余的Na2SO3,发生反应的化学方程式为:2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O。当到达滴定终点时记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL。
③计算该所测NaClO溶液的浓度为
(7)NaClO溶液具有强氧化性,写出其在生产或生活中的一种应用
您最近一年使用:0次
解题方法
6 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
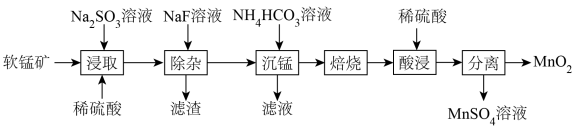
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。
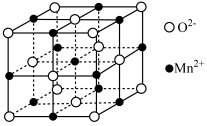

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近一年使用:0次
2023-12-08更新
|
292次组卷
|
2卷引用:广东省佛山市2023-2024学年高三上学期12月月考化学试题
解题方法
7 . Ⅰ.醛、酮在有机合成中是非常重要的中间体。
(1)甲醛所含元素的电负性由小到大的顺序为___________ (用元素符号表示),基态O原子的价层电子轨道表示式为___________ 。
(2)甲醛分子中碳原子的杂化轨道类型为___________ ,甲醛沸点(19.5℃)低于甲醇沸点(64.8℃),其原因是___________ 。
(3)醛、酮的羰基能和一些极性试剂(如HCN)发生加成反应。写出丙酮与HCN在一定条件下发生加成反应的化学方程式为___________ 。
Ⅱ.构建碳骨架在有机合成中是非常重要的一环。
(4)已知共轭二烯与含有双键的化合物相互作用,能生成六元环状化合物,例如 ,在一定条件下,
,在一定条件下,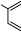 和
和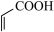 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式___________ 。
(1)甲醛所含元素的电负性由小到大的顺序为
(2)甲醛分子中碳原子的杂化轨道类型为
(3)醛、酮的羰基能和一些极性试剂(如HCN)发生加成反应。写出丙酮与HCN在一定条件下发生加成反应的化学方程式为
Ⅱ.构建碳骨架在有机合成中是非常重要的一环。
(4)已知共轭二烯与含有双键的化合物相互作用,能生成六元环状化合物,例如
 ,在一定条件下,
,在一定条件下,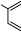 和
和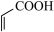 能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
能发生类似上述的反应,生成两种化合物(互为同分异构体),写出任意一种产物的结构简式
您最近一年使用:0次
解题方法
8 . 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。
(1)在基态Ti原子中,核外存在_______ 对自旋相反的电子,核外电子占据最高能层的符号是_______ ,占据该能层电子的电子云轮廓图形状为_______ 。
(2) 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有_______ ;反应中涉及物质的元素中电负性最大的是_______ 。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是_______ 。
(3)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮( )分子中含有π键与σ键数目之比为
)分子中含有π键与σ键数目之比为_______ 。
②甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b._______ 。
(4) 配离子呈黄色。配体之一
配离子呈黄色。配体之一 分子中氧原子的价层电子对互斥模型是
分子中氧原子的价层电子对互斥模型是_______ 。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为_______ 。已知晶体的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为_______ cm(用含 、
、 的式子表示)。
的式子表示)。

(1)在基态Ti原子中,核外存在
(2)
 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应:nCH3CH=CH2
 ,该反应中涉及的物质中碳原子的杂化轨道类型有
,该反应中涉及的物质中碳原子的杂化轨道类型有(3)高分子纳米活性钛无霸是借助紫外线或太阳光的照射,在其表面产生氧化性极强的活性离子,这种活性离子可以分解生活中的一些有害物质(如苯、甲醛、丙酮等)。
①丙酮(
 )分子中含有π键与σ键数目之比为
)分子中含有π键与σ键数目之比为②甲醛易溶于水,原因是:a.甲醛和水都是极性分子,b.
(4)
 配离子呈黄色。配体之一
配离子呈黄色。配体之一 分子中氧原子的价层电子对互斥模型是
分子中氧原子的价层电子对互斥模型是(5)有一种氮化钛晶体的晶胞如图所示,该晶体中Ti原子周围与Ti原子距离最近且相等的N原子的个数为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
解题方法
9 . 科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1)基态V的核外电子排布式为_______ 。
(2)下列状态的铁中,电离最外层一个电子所需能量最大的是_______(填标号)。
(3)在高温下CuO能分解生成 ,试从原子结构角度解释其原因:
,试从原子结构角度解释其原因:_______ 。
(4)70℃时, 会与甘氨酸(
会与甘氨酸( )反应生成甘氨酸铜,其结构如图所示:
)反应生成甘氨酸铜,其结构如图所示:

①要确定甘氨酸铜是晶体还是非晶体,最科学的方法是_______ 。
②图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是_______ (填标号),判断的根据是_______ 。

③顺式—甘氨酸合铜中,Cu的配位数为_______ ,碳原子的杂化方式是_______ 。
(5)图1为立方锌的硫化物晶胞,图2为晶胞沿z轴的1∶1平面投影图:

该化合物的化学式为_______ 晶胞参数为_______ pm(写计算表达式)。
(1)基态V的核外电子排布式为
(2)下列状态的铁中,电离最外层一个电子所需能量最大的是_______(填标号)。
A.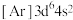 | B.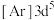 | C. | D. |
 ,试从原子结构角度解释其原因:
,试从原子结构角度解释其原因:(4)70℃时,
 会与甘氨酸(
会与甘氨酸( )反应生成甘氨酸铜,其结构如图所示:
)反应生成甘氨酸铜,其结构如图所示:
①要确定甘氨酸铜是晶体还是非晶体,最科学的方法是
②图a、b、c分别表示C、N、O和F的逐级电离能Ⅰ变化趋势(纵坐标的标度不同)。第一电离能的变化图是

③顺式—甘氨酸合铜中,Cu的配位数为
(5)图1为立方锌的硫化物晶胞,图2为晶胞沿z轴的1∶1平面投影图:

该化合物的化学式为
您最近一年使用:0次
名校
解题方法
10 . 氯吡苯脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
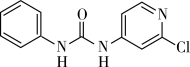
(1)氯元素基态原子核外电子的未成对电子数为_______ 。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为_______ 。
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂_______ 个 键,断裂
键,断裂_______ 个 键。
键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为_______
②NH3分子的空间结构是_______ ,H2O中心原子的杂化类型是_______

(1)氯元素基态原子核外电子的未成对电子数为
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型为
(3)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:

反应过程中,每生成1mol氯吡苯脲,断裂
 键,断裂
键,断裂 键。
键。(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为
②NH3分子的空间结构是
您最近一年使用:0次