1 . 吹沙填海是在填海点的周围用吹沙的方式堆沙造地。海水流出目标圈外,沙留在圈内,渐渐地圈内的海面就被不断吹进的沙填成了陆地,再用强夯机压实松土。高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示:
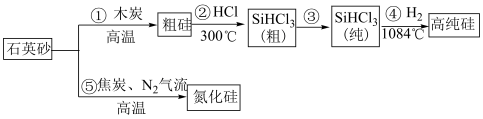
已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为_____ ,其属于______ (填“酸性”或“碱性”)氧化物。化学上常用氧化物的形式表示硅酸盐的组成,例如青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x]可表示为______ 。
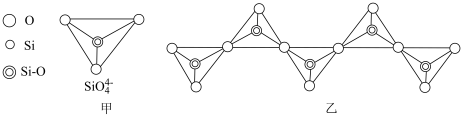
(2)在硅酸盐中,SiO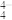 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为______ ,该多硅酸根的最简式为______ 。
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为______ 。
(4)流程③提纯SiHCl3的操作名称为______ 。以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是_______ 、______ (答出两条即可)。
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为______ 。

已知:SiHCl3极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,SiO2的晶体类型为
(2)在硅酸盐中,SiO
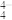 四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
四面体(图甲为其俯视投影图)通过共用顶角氧原子可形成链状、环状等多种结构。如图乙所示为一种无限长单链结构的多硅酸根的一部分,其中Si原子的杂化方式为
(3)工业上用纯净石英砂与C在高温下发生反应制造的粗硅中往往含有SiC,若粗硅中Si和SiC的物质的量之比为2∶1,则①的化学方程式为
(4)流程③提纯SiHCl3的操作名称为
(5)神舟十四号飞船成功发射标志着我国航天事业再上新台阶。氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
您最近一年使用:0次
名校
解题方法
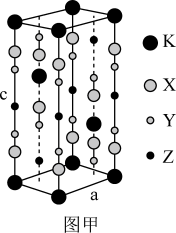
2 . 氟代硼铍酸钾晶体KBBF(KBe2BO3F2)是一种非线性光学晶体材料,广泛应用于激光、光刻录等领域,长方体晶胞如下图甲所示(其中K原子已经给出,氧原子略去)。回答下列问题:
(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
(2)K2O2的阴阳离子比为___________ 。第四周期,与基态钾原子最外层电子数相同的原子有___________ (填元素符号)。
(3)OF2分子中氧原子的杂化类型是___________ ,空间构型为___________ 。
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是___________ 。
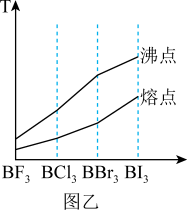
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是___________ 。
(6)指出图甲中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为apm和cpm,则晶体密度为___________ g·cm-3(M代表KBBF的摩尔质量,NA表示阿伏加德罗常数的值)。

(1)下列铍元素的不同微粒,若再失去一个电子需要能量最大的是 ___________。
A. | B.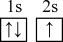 | C.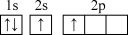 | D.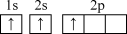 |
(3)OF2分子中氧原子的杂化类型是
(4)KBBF所含元素中非金属元素的电负性由大到小的顺序是
(5)三卤化硼的熔沸点如图乙所示,BF3、BCl3、BBr3、BI3的熔沸点变化的原因是

(6)指出图甲中代表硼原子的字母为
您最近一年使用:0次
2022-02-02更新
|
576次组卷
|
4卷引用:河北省衡水中学2021-2022学年高三下学期二调考试化学试题
河北省衡水中学2021-2022学年高三下学期二调考试化学试题安徽省蚌埠市2021-2022学年高三上学期第二次教学质量检查理综化学试题(已下线)【直击双一流】05-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
名校
解题方法
3 . 金属铜是被人们认识和利用较早的金属之一,西汉《淮南万毕术》中有“曾青得铁则化为铜”的记载,“曾青”是CuSO4溶液。回答下列问题:
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是___ 。
(2)CuSO4溶液中,金属阳离子的最高能层符号为___ ;其中未成对电子数为___ 。
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为___ 。1mol[Cu(H2O)4]2+中含有σ键的个数为___ (NA表示阿伏加 德罗常数的值)。
②CuSO4·5H2O结构中含有的化学键的类型有___ ,所含元素的电负性大小顺序为___ 。
(4)金属铜的晶胞结构如图所示。

①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为___ 。
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为___ pm(NA表示阿伏加 德罗常数的值)。
(1)一些铜盐在灼烧时会产生特殊的颜色,原因是
(2)CuSO4溶液中,金属阳离子的最高能层符号为
(3)CuSO4·5H2O可写成[Cu(H2O)4SO4]H2O,其结构如图所示:

①[Cu(H2O)4]2+中O原子的杂化类型为
②CuSO4·5H2O结构中含有的化学键的类型有
(4)金属铜的晶胞结构如图所示。

①该晶胞结构中含有由Cu原子构成的正八面体空隙和正四面体空隙,则正八面体空隙数和正四面体空隙数的比为
②科研发现硫化铜可以作为一种极为重要的P型半导体,其晶胞结构可以理解为铜晶胞中互不相邻的正四面体形成的空隙被S2-占据,若该晶体的密度为ag·cm-3,则两个最近的S2-之间的距离为
您最近一年使用:0次
名校
解题方法
4 . 【物质结构与性质】
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为____ 。P、O、S的电负性从大到小的顺序为______________ ____ (填标号)。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____ ,Co3+的价层电子排布式为_____ 。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为____ mol-l。
硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的立体构型为
的立体构型为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸(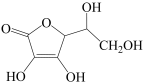 )常被用作碳包覆的碳源,其易溶于水的原因是
)常被用作碳包覆的碳源,其易溶于水的原因是
A.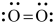 B.
B.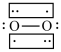 C.
C.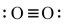 D.
D.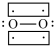
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加 德罗常数为
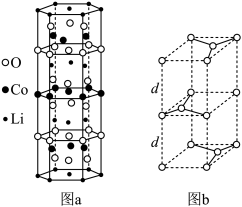
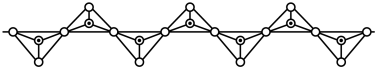
(5)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“
”表示Si原子,“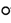 ”表示氧原子,则该长链硅酸根离子的通式为
”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
名校
解题方法
5 . Cu、Fe、Se、Co、Si常用于化工材料的合成。请回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______ ,其核外共有______ 种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________ (用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有____ 、_____ 。
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式_____ ,HCN分子的空间构型为____________ 。
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为_________ ,每个Si原子被_______ 个最小环所共有。
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为____ mol-1。
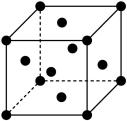
(1)铁离子(Fe3+)最外层电子排布式为
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为
(3)Na3[Co(NO2)6]常用作检验K+的试剂,在[Co(NO2)6]3-中存在的化学键有
(4)C与N能形成一种有毒离子CN-,能结合Fe3+形成配合物,写出一个与该离子互为等电子体的极性分子的分子式
(5)单晶硅的结构与金刚石的结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子间不成键,则得如图所示的金刚砂(SiC)结构。

在SiC晶体中,C原子的杂化方式为
(6)已知Cu的晶胞结构如图,棱长为acm,又知Cu的密度为pg/cm3,则用a、p的代数式表示阿伏伽德罗常数为

您最近一年使用:0次
11-12高三上·河北衡水·阶段练习
解题方法
6 . (I)多项选择题
下列说法中正确的是_______ 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________ 周期第________ 族;其基态原子的电子排布式为________ 。
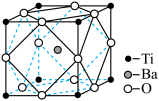
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是___________ ,其中Ti4+的氧配位数为________ ,Ba2+的氧配位数为_________ ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是_______ 晶体。
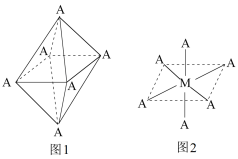
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有_______ 种同分异构体。
(Ⅲ)
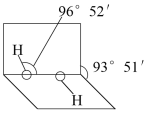
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取______ 杂化。
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:
R3+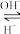 R(OH)3
R(OH)3 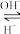 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为_______________________ ;
②[R(OH)4]-中存在的化学键是____________ 。
A.离子键 B.极性键 C.非极性键 D.配位键
下列说法中正确的是
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有

(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
(2)R是1~36号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系:

R3+
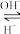 R(OH)3
R(OH)3  [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键
您最近一年使用:0次



