名校
解题方法
1 . “空气变馒头不是梦”,中国科学家在国际上首次实现了 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:
(1) 的空间构型为
的空间构型为_______ ,其中C原子的杂化方式为_______ 。基态氧原子的最外层的成单电子和成对电子之比为_______ 。
(2)试推测
_______ (填“能”或“不能”)溶于 ,理由是
,理由是_______ 。
(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是_______ (用离子方程式表示)。
(4)淀粉在一定条件下可水解成葡萄糖( ),葡萄糖分子中键角
),葡萄糖分子中键角
_______ 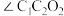 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)干冰的晶胞结构如下图所示,1个 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为_______ 。若干冰晶胞沿x轴投影,试在图中画出 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。_______
 到淀粉的从头合成,不依赖植物光合作用,原料只需
到淀粉的从头合成,不依赖植物光合作用,原料只需 、
、 和电,相关成果发表在《科学》上。请回答下列问题:
和电,相关成果发表在《科学》上。请回答下列问题:(1)
 的空间构型为
的空间构型为(2)试推测

 ,理由是
,理由是(3)淀粉遇碘变蓝。单质碘易溶于KI溶液,原因是
(4)淀粉在一定条件下可水解成葡萄糖(
 ),葡萄糖分子中键角
),葡萄糖分子中键角
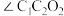 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(5)干冰的晶胞结构如下图所示,1个
 分子周围与其距离相等且最近的
分子周围与其距离相等且最近的 分子个数为
分子个数为 的投影位置(用“·”表示
的投影位置(用“·”表示 分子)。
分子)。
您最近一年使用:0次
2022-05-21更新
|
355次组卷
|
3卷引用:河北省唐山市2022届高三第三次模拟考试化学试题
河北省唐山市2022届高三第三次模拟考试化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编江西省南昌市第十九中学2022-2023学年高二下学期3月第一次月考化学试卷
2 . 硅、硼、铜、硒的单质及化合物在现代工业生产中有着广泛应用。回答下列问题:
(1)基态Cu+的核外价层电子排布式为_______________ ;Be、B、Al的第一电离能由大到小的顺序是______________________________ 。
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se___ Si(填“>”、“<”)。
(3)SeO32-中Se原子的杂化类型为______ ,与其互为等电子体的一种分子的分子式是______________ 。
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为_________ ,Cu(NO3)2中的化学键除了σ键外,还存在_______________ 。
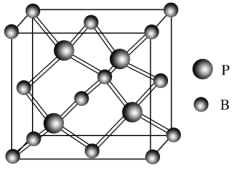
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为___________ ,已知该晶体的晶胞参数a pm,用NA代表阿伏伽德罗常数的值,则该晶体的密度为____ g·cm-3;构成晶体的两种粒子之间的最近距离为__________ pm。
(1)基态Cu+的核外价层电子排布式为
(2)硒、硅均能与氢元素形成气态氢化物,若“Si-H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se
(3)SeO32-中Se原子的杂化类型为
(4)CuSO4和Cu(NO3)2是自然界中重要的铜盐,向CuSO4熔液中加入过量稀氨水,产物的外界离子的空间构型为
(5)磷化硼(BP)是一种耐磨材料,熔点高,其晶胞结构如图所示。该晶胞中B的堆积方式为

您最近一年使用:0次
名校
解题方法
3 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Cu的基态原子价电子排布式为_____________ ,
②Ni的基态原子共___________ 有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,______ (用元素符号表示)。
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为______ ;中心原子的杂化方式为______ 。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.910-2nm和7.810-2nm,则熔点NiO____ FeO (填“>”、“<”或“=”),原因是_______ 。
(3)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示:

①该晶体的化学式为__________ 。
②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm3,设NA为阿伏伽德罗常数的值。则该晶胞的体积是__________ cm3 (用M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3,储氢能力=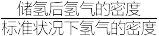 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________ (用M、d、ρ的代数式表示) 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Cu的基态原子价电子排布式为
②Ni的基态原子共
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.910-2nm和7.810-2nm,则熔点NiO
(3)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示:

①该晶体的化学式为
②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm3,设NA为阿伏伽德罗常数的值。则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3,储氢能力=
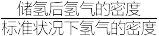 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2018-03-24更新
|
548次组卷
|
3卷引用:【全国校级联考】河北省唐山市五校2018届高三联考A卷理综化学试题
解题方法
4 . 铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为 1 。N、O、S三种元素的第一电离能大小顺序为 2 (填元素符号)。
②SO42-的空间构型为 3 ,与SO42-互为等电子体的有机分子的化学式为 4 。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因 5 ;在该晶体中存在的化学键的种类有 6 。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为 7 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为 8 。

(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为 9 pm,求算阿伏加德罗常数的表达式为 10 。
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:

①NH4CuSO3中金属阳离子的核外电子排布式为
②SO42-的空间构型为
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为

(4)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为
您最近一年使用:0次



