1 . 缺电子化合物是指电子数不符合路易斯结构(路易斯结构是通过共用电子使原子价层电子数达到8,氢原子达到2所形成的稳定分子结构)要求的一类化合物,某科学小组依据 、
、 、
、 分子对此进行研究。
分子对此进行研究。
(1)写出B原子的价层电子轨道表示式_______ 。
(2) 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是_______ ,其_______ (能/不能)提供孤对电子与Fe2+形成配位键。
(3)上述三种化合物中,是缺电子化合物的是_______ 。
(4)NH3分子极易溶于水,是说明理由_______ 。
 、
、 、
、 分子对此进行研究。
分子对此进行研究。(1)写出B原子的价层电子轨道表示式
(2)
 中心原子的轨道杂化类型是
中心原子的轨道杂化类型是(3)上述三种化合物中,是缺电子化合物的是
(4)NH3分子极易溶于水,是说明理由
您最近一年使用:0次
2 . 在工业上次磷酸 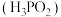 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: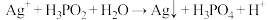 (未配平),已知
(未配平),已知 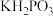 是次磷酸的正盐,请回答下列问题:
是次磷酸的正盐,请回答下列问题:
(1)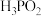 中,
中, 元素的化合价为
元素的化合价为_______ ;该反应中,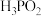 被
被_______ (填“氧化”或“还原”)。
(2)若该反应有 个电子转移,则镀件上银的质量为
个电子转移,则镀件上银的质量为_______  (已知每个银原子质量为
(已知每个银原子质量为 克)。
克)。
(3)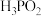 与足量
与足量  溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(4)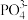 中
中 的价层电子对数为
的价层电子对数为_______ , 采取
采取_______ 杂化方式, 的空间结构为
的空间结构为_______ 。
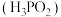 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: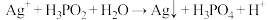 (未配平),已知
(未配平),已知 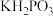 是次磷酸的正盐,请回答下列问题:
是次磷酸的正盐,请回答下列问题:(1)
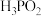 中,
中, 元素的化合价为
元素的化合价为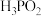 被
被(2)若该反应有
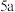 个电子转移,则镀件上银的质量为
个电子转移,则镀件上银的质量为 (已知每个银原子质量为
(已知每个银原子质量为 克)。
克)。(3)
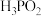 与足量
与足量  溶液反应的离子方程式:
溶液反应的离子方程式:(4)
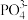 中
中 的价层电子对数为
的价层电子对数为 采取
采取 的空间结构为
的空间结构为
您最近一年使用:0次
解题方法
3 . 回答下列问题。
(1)N2H4是___________ (填“极性”或“非极性”)分子,N2H4中中心原子N杂化类型为___________ 。
(2)乙炔分子的碳原子采取什么杂化方式?___________ ;它的杂化轨道用于形成什么化学键?___________ ;怎样理解它存在碳碳三键?___________ 。
(3)向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为___________ 。
(1)N2H4是
(2)乙炔分子的碳原子采取什么杂化方式?
(3)向绿色的NiSO4溶液中滴加过量的氨水,溶液会变成深蓝色,其原因是溶液中生成了一种六配体的配离子,该配离子的化学式为
您最近一年使用:0次
解题方法
4 . 一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为___________ ,从结构角度来看,Fe2+易被氧化成Fe3+的原因是___________ 。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒___________ (分子或离子);
②硫氰酸分子中硫原子的杂化方式为___________ 。
③异硫氰酸的沸点比硫氰酸沸点高的原因是___________ 。
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为___________ pm(列出计算式即可)。

(1)基态铁原子价电子排布式为
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒
②硫氰酸分子中硫原子的杂化方式为
③异硫氰酸的沸点比硫氰酸沸点高的原因是
(3)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为

您最近一年使用:0次
5 . 氮、磷、硫、氯等非金属元素的单质和化合物在工农业生产中有重要应用。回答下列问题:
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为___________ 。某厂废液中含有2%∼5%的 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是___________ (填标号)。
A. B.
B. C.
C.
(2) 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。
① 为
为___________ 元酸(填“一”二”或“三”),磷原子的杂化方式为___________ 。
②利用 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为___________ (填化学式)。
(3)硫代硫酸钠晶体( ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:___________ 。
(4)氯气与氢氧化钠在70℃时反应,生成物中 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为___________ 。
(1)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为
 ,直接排放会造成污染,下列物质能使
,直接排放会造成污染,下列物质能使 转化为
转化为 的是
的是A.
 B.
B. C.
C.
(2)
 及正盐
及正盐 均可将溶液中的
均可将溶液中的 还原为银,从而可用于化学镀银。
还原为银,从而可用于化学镀银。①
 为
为②利用
 进行化学镀银,反应中氧化剂与还原剂的物质的量之比为
进行化学镀银,反应中氧化剂与还原剂的物质的量之比为 ,则氧化产物为
,则氧化产物为(3)硫代硫酸钠晶体(
 ),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:
),又名大苏打、海波,是一种用途非常广泛的化学试剂,遇酸立即分解,生成淡黄色沉淀,放出的气体能使品红溶液褪色,试写出硫代硫酸钠溶液与稀硫酸反应的离子方程式:(4)氯气与氢氧化钠在70℃时反应,生成物中
 和
和 的物质的量之比为
的物质的量之比为 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
名校
6 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号,下同)。
(2)B、C、N三种元素的电负性从大到小依次为___________ ,化合物 中的σ键和π键的比例是
中的σ键和π键的比例是___________ 。
(3) 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,该配合物的配位原子为
,该配合物的配位原子为___________ (填序号),其中碳原子杂化方式为___________ 。写出一种与外界互为等电子体的分子___________ 。IMI中大π键可表示为___________ (已知苯中的大π键可表示为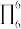 )。
)。
(4)镍能形成多种配合物,其中 是无色挥发性液体,而
是无色挥发性液体,而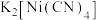 是红黄色单斜晶体。
是红黄色单斜晶体。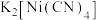 的熔点高于
的熔点高于 的原因是
的原因是___________ 。
(5)红银矿NiAs晶体结构如图所示:

①As原子的配位数是___________ 。
②已知 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为 pm、
pm、 pm,则该晶体的密度为
pm,则该晶体的密度为___________ g/cm3(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是___________(填标号,下同)。
A. | B. |
C. | D. |
(2)B、C、N三种元素的电负性从大到小依次为
 中的σ键和π键的比例是
中的σ键和π键的比例是(3)
 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,该配合物的配位原子为
,该配合物的配位原子为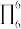 )。
)。(4)镍能形成多种配合物,其中
 是无色挥发性液体,而
是无色挥发性液体,而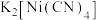 是红黄色单斜晶体。
是红黄色单斜晶体。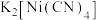 的熔点高于
的熔点高于 的原因是
的原因是(5)红银矿NiAs晶体结构如图所示:

①As原子的配位数是
②已知
 为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为
为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为 pm、
pm、 pm,则该晶体的密度为
pm,则该晶体的密度为
您最近一年使用:0次
名校
解题方法
7 . 通过化学方法,人们不仅能从大自然中提取物质,还能制备出性质更佳优良的材料。氨是一种重要的化工原料,工业上常用浓氨水检验输送氯气的管道是否泄漏。其反应原理为:
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目___________ 。
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:___________ 。
(3)NH3的电子式为___________ ,其中心原子的杂化类型为 ___________ 。
(4)N2分子中含___________ 个π键。
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:___________ 。
化学性质的变化:___________ 。
___________NH3+___________Cl2=___________NH4Cl+___________N2
(1)配平上述反应方程式,并标出电子转移的方向及数目
(2)实验室使用浓盐酸和MnO2制备Cl2,其化学方程式为:
(3)NH3的电子式为
(4)N2分子中含
(5)向饱和氯水中加入少量亚硫酸钠固体,该溶液的性质会发生多种变化。请举例说明:
物理性质的变化:
化学性质的变化:
您最近一年使用:0次
名校
解题方法
8 . 请回答下列问题。
(1)某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于___________ (填“晶体或“非晶体”),可通过___________ 方法鉴别。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO) 4属于___________ 晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则晶体熔点NiO___________ FeO(填“<”或“>”)
(3)铜能与类卤素(SCN)2反应生成Cu(SCN) 2,已知SCN-中C原子为sp杂化,则SCN-的结构简式为___________ 。
(4)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2.其中NO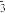 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为___________ 。[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有___________ 。
(1)某种金属互化物具有自范性,原子在三维空间呈周期性有序排列,该金属互化物属于
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO) 4属于
(3)铜能与类卤素(SCN)2反应生成Cu(SCN) 2,已知SCN-中C原子为sp杂化,则SCN-的结构简式为
(4)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2.其中NO
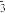 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为
您最近一年使用:0次
名校
解题方法
9 . A和B两种金属的含氮化合物的结构如图所示:

(1)基态Ni原子的核外电子排布式为[Ar]_______ 。
(2)物质A中碳原子的杂化方式为_______ 。
(3)物质A的熔点高于物质B的,主要原因是_______ 。
(4)物质B中不含有的化学键类型有_______。

(1)基态Ni原子的核外电子排布式为[Ar]
(2)物质A中碳原子的杂化方式为
(3)物质A的熔点高于物质B的,主要原因是
(4)物质B中不含有的化学键类型有_______。
| A.金属键 | B.σ键 | C.π键 | D.配位键 |
您最近一年使用:0次
名校
10 . 化合物G可用于药用多肽的结构修饰,其人工合成路线如下:

(1)A分子中碳原子的杂化轨道类型为___________ 。
(2)B的官能团名称为___________ ,B→C的反应类型为___________ 。
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:___________ 。
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为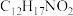 ,其结构简式为
,其结构简式为___________ 。

(1)A分子中碳原子的杂化轨道类型为
(2)B的官能团名称为
(3)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
①分子中含有4种不同化学环境的氢原子;②碱性条件水解,酸化后得2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(4)F的分子式为
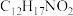 ,其结构简式为
,其结构简式为
您最近一年使用:0次



