名校
1 . 回答下列问题:
(1)LiFePO4的晶胞结构示意图如图1所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有__________ 个。__________ ,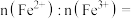
__________ 。
(2)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子 ,其晶胞如图5所示。其中Pb2+与图4中
,其晶胞如图5所示。其中Pb2+与图4中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为anm,则晶体密度为__________ g·cm-3(列出计算式)。
一个晶胞中有__________ 个Sn,找出距离Cd(0,0,0)最近的Sn__________ (用分数坐标表示)。CdSnAs2晶体中与单个Sn键合的As有__________ 个。
(1)LiFePO4的晶胞结构示意图如图1所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有

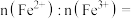
(2)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子
 ,其晶胞如图5所示。其中Pb2+与图4中
,其晶胞如图5所示。其中Pb2+与图4中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是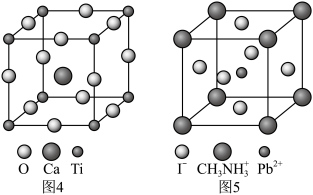
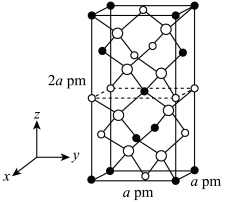
| 坐标 原子 | x | y | z |
| Cd | 0 | 0 | 0 |
| Sn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
您最近一年使用:0次
2 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)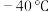 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键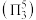 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数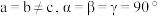 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
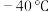 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键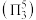 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数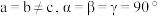 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10330次组卷
|
10卷引用: 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)
河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
名校
解题方法
3 . 银离子导体是发现最早的固体电解质,同时也是应用面最广的固体电解质,如制作库仑计、电子开关、压敏元件、气敏传感器、记忆元件、电容器等电化学器件。
回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置___ 。
(2)第三周期各元素的氯化物熔点、沸点数据如下:
请解释第三周期氯化物沸点从左到右变化的原因:___ 。
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是__ ,构成HIO4的三种元素电负性大小顺序是___ ,在HIO4晶体中存在___ (填字母)
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是___ 。
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是___ ,I-与I-构成的三类孔隙堆积之比为I-:O:T:Tr=1:__ :__ :12。

回答以下问题:
(1)Ag+的价层电子排布式为4d10,写出Ag在周期表中的位置
(2)第三周期各元素的氯化物熔点、沸点数据如下:
| NaCl | MgCl2 | AlCl3 | SiCl4 | PCl3 | S2Cl2 | |
| 熔点/K | 1074 | 987 | 465 | 205 | 181 | 193 |
| 沸点/K | 1686 | 1691 | 453(升华) | 216 | 349 | 411 |
请解释第三周期氯化物沸点从左到右变化的原因:
(3)偏高碘酸HIO4是无机非混合酸中氧化性极强的酸之一,可将Mn氧化为HMnO4,将Fe2+氧化为H2FeO4。HIO4的中心原子杂化形式是
A.离子键 B.极性共价键 C.非极性共价键 D.分子间作用力 E.σ键 F.π键
(4)室温下,AgI属于六方ZnS结构,其中S原子作六方密堆积,Zn原子填充在半数的四面体空隙中。则AgI晶体中I原子的配位数是
(5)400℃以上AgI固体的导电能力是室温的上万倍,可与电解质溶液媲美,经研究发现其在146℃以上转化为一种奇特结构:α—AgI,I-作体心立方堆积,而Ag+则选择性填入I-构成的三类孔隙中:八面体孔隙(O)、四面体孔隙(T)和三角形孔隙(Tr),则平均每个α—AgI晶胞中的Ag+数是

您最近一年使用:0次
2021-05-18更新
|
645次组卷
|
3卷引用:河南省辉县市一中2020-2021学年高二(培优班)下学期第二次阶段性考试化学试题
名校
解题方法
4 . 铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有___ 种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______ 。
(2)已知:2UO2+5NH4HF2 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______ 种。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______ 、_______ 。
②物质 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为______ 。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
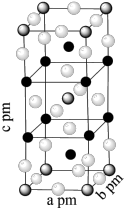
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为______ 。该晶体硬度超过金刚石的原因是_________ 。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为_______ (用含d、r1、r2、NA的代数式表示,不必化简)。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有
(2)已知:2UO2+5NH4HF2
 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有
(3)已知:3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑①写出与NH4+互为等电子体的一种分子和一种离子的化学式
②物质
 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为③分解所得的气态化合物的分子键角由小到大的顺序为
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为
您最近一年使用:0次
2018-04-16更新
|
1703次组卷
|
3卷引用:【全国百强校】河南省信阳高级中学2018届高三第四次模拟考试化学试题
解题方法
5 . 铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:
(1)镓(Ga)价电子排布式为______ ,镓(Ga)与铟(In)同主族第一电离能较小的为______ (用元素符号表示)。
(2)硒属于_______ 区元素。O、S、Se简单氢化物稳定性由强到弱的顺序为______ ,中心原子的杂化方式为___________ ,键角最大的是_____________ 。
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是__________ (填化学式)。
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为__________ 。

图中A原子和B原子坐标(分别为(0,0,0),(0,0, ),则C原子坐标为
),则C原子坐标为_________ 。
(1)镓(Ga)价电子排布式为
(2)硒属于
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为

图中A原子和B原子坐标(分别为(0,0,0),(0,0,
 ),则C原子坐标为
),则C原子坐标为
您最近一年使用:0次
2018-02-23更新
|
688次组卷
|
2卷引用:河南省周口市2018届高三上学期期末抽测调研化学试题



