1 . 卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)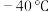 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为_____ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键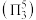 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式_____ ;为 键角
键角_____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)一定条件下, 和
和 反应生成
反应生成 和化合物
和化合物 。已知
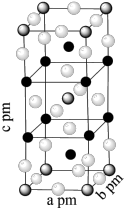
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数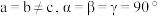 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为_____ 。若阿伏伽德罗常数的值为 ,化合物
,化合物 的密度
的密度
_____  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)
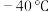 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键
键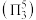 。
。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)一定条件下,
 和
和 反应生成
反应生成 和化合物
和化合物 。已知
。已知 属于四方晶系,晶胞结构如图所示(晶胞参数
属于四方晶系,晶胞结构如图所示(晶胞参数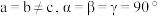 ),其中
),其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为 ,化合物
,化合物 的密度
的密度
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10474次组卷
|
10卷引用:专题20 结构与性质
(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第11讲 氯气和卤族元素(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)(已下线)第20讲化学键(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用) 河南省南阳市第一中学校2024届高三上学期阶段检测化学试题(12月)2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(结构与性质)
解题方法
2 .  是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1) 的价层电子排布式为
的价层电子排布式为___________ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用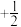 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为___________ 。S可以形成两种常见含氧酸,其通式为 ,判断该两种含氧酸酸性强弱并分析原因
,判断该两种含氧酸酸性强弱并分析原因___________ 。
(3)硫酸铜稀溶液中不存在的作用力有___ (填标号),其中硫酸根的空间构型为___ 。
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力
(4)硫酸铜溶液中滴入氨基乙酸钠 可得到配合物A,结构如图所示。
可得到配合物A,结构如图所示。

①氨基乙酸钠中碳原子的杂化方式为___ , 氨基乙酸钠含有
氨基乙酸钠含有 键的数目为
键的数目为___________ ;
②配合物A中非金属元素电负性由大到小的顺序为___________ 。
(5) (式量为
(式量为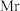 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为___________  (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向
原子沿z轴方向向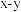 平面投影的位置,在图b中画出S原子在该方向的投影位置
平面投影的位置,在图b中画出S原子在该方向的投影位置___________ (用“●”表示S原子)。

 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:(1)
 的价层电子排布式为
的价层电子排布式为(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
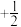 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数。对于基态S原子,其价电子自旋磁量子数的代数和为 ,判断该两种含氧酸酸性强弱并分析原因
,判断该两种含氧酸酸性强弱并分析原因(3)硫酸铜稀溶液中不存在的作用力有
A.配位键 B.金属键 C.共价键 D.氢键 E.范德华力
(4)硫酸铜溶液中滴入氨基乙酸钠
 可得到配合物A,结构如图所示。
可得到配合物A,结构如图所示。
①氨基乙酸钠中碳原子的杂化方式为
 氨基乙酸钠含有
氨基乙酸钠含有 键的数目为
键的数目为②配合物A中非金属元素电负性由大到小的顺序为
(5)
 (式量为
(式量为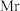 )的晶胞结构如图a所示,阿伏加德罗常数为
)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为
(列计算式),图b为 原子沿z轴方向向
原子沿z轴方向向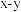 平面投影的位置,在图b中画出S原子在该方向的投影位置
平面投影的位置,在图b中画出S原子在该方向的投影位置
您最近一年使用:0次
2022-04-14更新
|
1740次组卷
|
5卷引用:专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)
(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷03(全国甲卷)广东省佛山市普通高中2022届高三教学质量检测(二)化学试题广东省佛山市2022届高三下学期4月第二次教学质量监测(二模)化学试题(已下线)化学-2022年高考押题预测卷02(福建卷)
解题方法
3 . 磁性材料广泛应用于航空航天高科技领域及电视、电脑、手机等日常生活用品。据报道,苯并[18]冠-6(以X表示,图1)与铯离子可形成一种夹心型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y表示,图2)结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能,是铁磁性和反铁磁性共存于同一晶体中的成功范例。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式_______ (苯并[18]冠-6用X表示,镍配合物用Y表示)。
(2)指出镍离子的杂化轨道类型:_______ 。如图是平面正方形晶体场d轨道能级分裂图,把基态镍离子的d电子填入该图_______ 。

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度_______ g·cm-3.(相对分子质量:X312.4;Y451.4)
(4)①写出镍配合物Y的对称元素_______ 。
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因_______ 。

下图是X、Y与Cs+形成的复合物的晶体结构。在此晶体结构图中,a)为沿b轴看晶胞,b)为沿a轴看晶胞,c)为在c=0的面上镍配合物的二维排列,d)为镍配合物的π-二聚体链。

(1)给出该晶体晶胞的组成,并写出该晶体结构基元的化学式
(2)指出镍离子的杂化轨道类型:

(3)已知该晶体的晶胞参数a=1278.99pm,b=1305.39pm,c=2717.03pm,α=78.3394°,β=77.0109°,r=70.6358°,试计算该晶体的密度
(4)①写出镍配合物Y的对称元素
②指出超分子阳离子中Cs+的配位数,解释其配位数较大的可能原因
您最近一年使用:0次
真题
解题方法
4 . KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是__ (填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为___ 。
(3)已知有关氮、磷的单键和三键的键能(kJ•mol-1)如表:
___ ,其中P采取___ 杂化方式。
(5)与PO 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为__ 。
(6)磷酸通过分子间脱水缩合形成多磷酸,如:___ 。
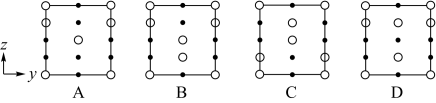
(7)分别用○、●表示H2PO 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
、K+在晶胞xz面、yz面上的位置:__ g•cm-3(写出表达式)。
②晶胞在x轴方向的投影图为__ (填标号)。
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数.对于基态的磷原子,其价电子自旋磁量子数的代数和为(3)已知有关氮、磷的单键和三键的键能(kJ•mol-1)如表:
| N—N | N≡N | P—P | P≡P |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以N2、而白磷以P4(结构式可表示为 )形式存在的原因是
)形式存在的原因是
(5)与PO
 电子总数相同的等电子体的分子式为
电子总数相同的等电子体的分子式为(6)磷酸通过分子间脱水缩合形成多磷酸,如:

(7)分别用○、●表示H2PO
 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO 、K+在晶胞xz面、yz面上的位置:
、K+在晶胞xz面、yz面上的位置:
②晶胞在x轴方向的投影图为
您最近一年使用:0次
2021-06-09更新
|
10150次组卷
|
12卷引用:2021年新高考河北化学高考真题
2021年新高考河北化学高考真题(已下线)专题14 物质结构与性质-备战2022年高考化学学霸纠错(全国通用)2021年河北省高考化学试卷变式题10-18题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题19 物质结构与性质-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)广东省广州市天河区2022届高三第三次模拟考试化学试题(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)专题20 结构与性质(已下线)专题20 结构与性质
解题方法
5 . 氮化物应用广泛,如叠氮化钠(NaN3)是典型的高能量密度含能材料,氮化硼是特殊的耐磨和切削材料,氮化铬、氮化钼等过渡金属氮化物常用作高强度材料。回答下列问题:
(1)Na、N、B中,原子半径由大到小的顺序是___________ 。
(2)基态N原子价层电子的电子排布图为___________ 。基态铬原子核外未成对电子数为___________ 。
(3)NaN3中阴离子N 是直线型离子。1个N
是直线型离子。1个N 中的σ键数目为
中的σ键数目为___________ 。分子或离子中的大π键可用符号Π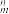 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π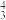 ),则N
),则N 中的大π键应表示为
中的大π键应表示为___________ 。
(4)石墨型(BN)x转变为金刚石型(BN)x时,B原子的杂化轨道类型由___________ 变为___________ 。金刚石型(BN)x的硬度比金刚石大,推测其原因是___________ 。
(5)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
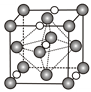
氮化钼的化学式为___________ ,如果让Li+填入氮化钼晶体的八面体空隙,一个晶胞最多可以填入___________ 个Li+。氮化钼晶胞边长为a nm,晶体的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)Na、N、B中,原子半径由大到小的顺序是
(2)基态N原子价层电子的电子排布图为
(3)NaN3中阴离子N
 是直线型离子。1个N
是直线型离子。1个N 中的σ键数目为
中的σ键数目为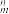 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如CO2分子中存在两个大π键Π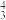 ),则N
),则N 中的大π键应表示为
中的大π键应表示为(4)石墨型(BN)x转变为金刚石型(BN)x时,B原子的杂化轨道类型由
(5)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
您最近一年使用:0次
6 . 碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_________ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为________ 、________ 。
(3)C60属于_________ 晶体,石墨属于________ 晶体。
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的________ 共价键,而石墨层内的C—C间不仅存在_________ 共价键,还有_________ 键。
(5)金刚石晶胞含有________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=________ a,列式表示碳原子在晶胞中的空间占有率________ (用含π分数形式表示,不要求写成百分数)。

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C60属于
(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm,其原因是金刚石中只存在C—C间的
(5)金刚石晶胞含有
您最近一年使用:0次
解题方法
7 . 超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。___________ ;核外未成对电子数是___________ 个。
(2)该超分子中存在的化学键类型有___________ 。
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是___________ (填元素符号),p-甲酸丁酯吡啶配体中C原子的杂化方式有___________ 。
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因___________ 。
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是___________ 。
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。___________ 。已知该晶体的密度是ρg·cm-3,Mo的摩尔质量是M g·mol-1,阿伏伽德罗常数是NA,晶体中距离最近的Mo原子核之间的距离为___________ pm。

(2)该超分子中存在的化学键类型有
A σ键Bπ键C离子键D氢键
(3)该超分子中配体CO提供孤电子对的原子是
(4)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因
(5)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是
(6)已知:某晶胞中各原子的相对位置可用如图所示的原子坐标表示,其中所有顶点原子坐标均为(0,0,0)。

您最近一年使用:0次
2019-04-23更新
|
5690次组卷
|
3卷引用:2020届人教版高三化学二轮复习非选择题专攻练——物质结构与性质
名校
解题方法
8 . 铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有___ 种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______ 。
(2)已知:2UO2+5NH4HF2 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______ 种。
(3)已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______ 、_______ 。
②物质 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为______ 。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为______ 。该晶体硬度超过金刚石的原因是_________ 。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为_______ (用含d、r1、r2、NA的代数式表示,不必化简)。
回答下列问题:
(1)UF4用Mg 或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2 的元素共有
(2)已知:2UO2+5NH4HF2
 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有
(3)已知:3(NH4)4[UO2(CO3)3]
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑①写出与NH4+互为等电子体的一种分子和一种离子的化学式
②物质
 中与CO
中与CO 的碳原子杂化类型相同和不同的碳原子的个数比为
的碳原子杂化类型相同和不同的碳原子的个数比为③分解所得的气态化合物的分子键角由小到大的顺序为
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4 个碳原子位于立方体的面心,4 个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C 原子的配位数为
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为
您最近一年使用:0次
2018-04-16更新
|
1703次组卷
|
3卷引用:河北省衡水中学2018届高三第十五次模拟理科综合化学试题
解题方法
9 . 铜铟镓硒薄膜太阳能电池(GIGS)是第三代太阳能电池的典型代表,已成为全球光伏领域研究的热点之一,回答下列问题:
(1)镓(Ga)价电子排布式为______ ,镓(Ga)与铟(In)同主族第一电离能较小的为______ (用元素符号表示)。
(2)硒属于_______ 区元素。O、S、Se简单氢化物稳定性由强到弱的顺序为______ ,中心原子的杂化方式为___________ ,键角最大的是_____________ 。
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是__________ (填化学式)。
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为__________ 。

图中A原子和B原子坐标(分别为(0,0,0),(0,0, ),则C原子坐标为
),则C原子坐标为_________ 。
(1)镓(Ga)价电子排布式为
(2)硒属于
(3)已知N-N、N=N键能之比为l:4.9,而C-C、C=C键能之比为1:2.34。则N2和C2H2中叁键能较大的是
(4)某晶体的晶胞结构如图所示(在该晶体中通过掺入适量的Ga以替代部分In就可以形GIGS晶体),该晶体的化学式为

图中A原子和B原子坐标(分别为(0,0,0),(0,0,
 ),则C原子坐标为
),则C原子坐标为
您最近一年使用:0次
2018-02-23更新
|
688次组卷
|
2卷引用:河南省周口市2018届高三上学期期末抽测调研化学试题
12-13高三·湖北襄阳·阶段练习
10 . VA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含VA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)白磷单质的中P原子采用的轨道杂化方式是______ 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______ 。
(3)As原子序数为__ ,其核外M层和N层电子的排布式为__ 。
(4)NH3的沸点比PH3___ (填“高”或“低”),原因是__ ,PO 离子的立体构型为
离子的立体构型为___ 。
(5)H3PO4的K1、K2、K3分别为7.6×10﹣3、6.3×10﹣8、4.4×10﹣13.硝酸完全电离,而亚硝酸K=5.1×10﹣4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因___ ;
②硝酸比亚硝酸酸性强的原因___ ;
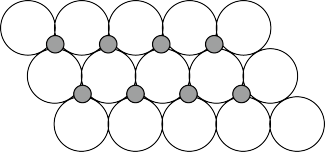
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为__ cm(用含有a的代数式表示),在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为__ g(氧离子的半径为1.40×10﹣10m)。
(1)白磷单质的中P原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
(3)As原子序数为
(4)NH3的沸点比PH3
 离子的立体构型为
离子的立体构型为(5)H3PO4的K1、K2、K3分别为7.6×10﹣3、6.3×10﹣8、4.4×10﹣13.硝酸完全电离,而亚硝酸K=5.1×10﹣4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因
②硝酸比亚硝酸酸性强的原因
(6)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为

您最近一年使用:0次



