1 . 用 表示阿伏加德罗常数的数值。下列说法正确的是
表示阿伏加德罗常数的数值。下列说法正确的是
 表示阿伏加德罗常数的数值。下列说法正确的是
表示阿伏加德罗常数的数值。下列说法正确的是A.2g由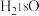 和 和 组成的混合物中含有的中子数为 组成的混合物中含有的中子数为 |
B.100g质量分数为46%的乙醇溶液中 杂化的原子数为 杂化的原子数为 |
C.标准状况下,22.4L 与足量水充分反应,转移的电子数为 与足量水充分反应,转移的电子数为 |
D.标况下,22.4L 中含有的极性键数目为 中含有的极性键数目为 |
您最近一年使用:0次
名校
解题方法
2 . 原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29,请用元素符号或化学式回答下列问题:
(1)E原子价层电子的轨道表达式为_______ ;基态E原子电子占据最高能级的电子云轮廓图为_______ 形。E晶体中原子堆积方式为_______ 。
(2)X、Y、Z的第一电离能由小到大的顺序为_______ 。
(3)已知 与
与 互为等电子体,则1 mol
互为等电子体,则1 mol  中含有π键数目为
中含有π键数目为_______ 。
(4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为_______ 。
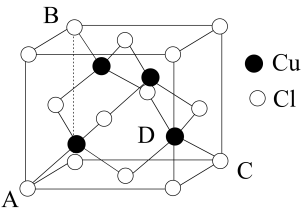
(5)E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该晶体的化学式为_______ 。Z的配位数为_______ 。设晶胞边长为 a cm,该晶体的密度为_______ g/cm3(阿伏加德罗常数用NA表示,列出计算式即可)。

(1)E原子价层电子的轨道表达式为
(2)X、Y、Z的第一电离能由小到大的顺序为
(3)已知
 与
与 互为等电子体,则1 mol
互为等电子体,则1 mol  中含有π键数目为
中含有π键数目为(4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为
(5)E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该晶体的化学式为

您最近一年使用:0次
3 . Ⅰ.青蒿素是烃的含氧衍生物,为无色针状晶体,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿素中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚萃取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(1)操作Ⅰ、Ⅱ中,不会用到的装置是_______ (填序号)。
A. B.
B. C.
C.
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是_______ 。
(3)操作Ⅱ的名称是_______ 。操作Ⅲ的主要过程可能是_______ (填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)下列有关青蒿素研究的说法正确的是_______

(5)青蒿素分子中的含氧官能团除过氧基(-O-O-)外,还有_______ (写名称)
Ⅱ.完成下列填空
(6) 表示的有机物的分子式为
表示的有机物的分子式为_______ ;其中碳原子的杂化方式有_______ 种。
(7) 的系统命名法名称是
的系统命名法名称是_______ ,其一氯代物有_______ 种。
(8)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为_______ ,分子式为_______ 。


(1)操作Ⅰ、Ⅱ中,不会用到的装置是
A.
 B.
B. C.
C.
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是
(3)操作Ⅱ的名称是
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)下列有关青蒿素研究的说法正确的是_______

| A.利用黄花蒿茎叶研究青蒿素结构的基本步骤:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 |
| B.可用X射线衍射测定分子的空间结构 |
| C.元素分析仪可以确定青蒿素中是否含有C、H、O等元素 |
| D.可用质谱法确定分子中含有何种官能团的信息 |
Ⅱ.完成下列填空
(6)
 表示的有机物的分子式为
表示的有机物的分子式为(7)
 的系统命名法名称是
的系统命名法名称是(8)某有机物经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,下图是该有机物的质谱图,则其相对分子质量为

您最近一年使用:0次
名校
解题方法
4 . 翡翠的主要成分为NaAlSi2O6,还含有其他多种金属阳离子,其中Cr3+的含量决定其绿色的深浅,是决定翡翠品质的重要因素之一。
(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为___________ 。
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是___________ ,最小的是___________ (填标号)。
A. B.
B.  C.
C.  D.
D. 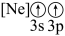
(3)配合物K[Cr(C2O4)(H2O)]中的配体是___________ ,H2O的沸点比CO2的高了许多,主要原因是___________ 。
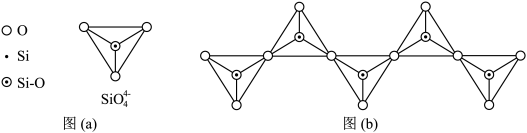
(4)在翡翠等硅酸盐中, 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为___________ ,其化学式为___________ 。低温石英中也存在有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有___________ 。
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是___________ 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为___________ % (列出计算表达式)。

(1)基态Cr3+最外电子层的电子排布图(轨道表示式)为
(2)下列状态的铝中,电离最外层一个电子所需能量最大的是
A.
 B.
B.  C.
C.  D.
D. 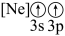
(3)配合物K[Cr(C2O4)(H2O)]中的配体是
(4)在翡翠等硅酸盐中,
 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为
(5)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示,处于顶角位置的是

您最近一年使用:0次
名校
5 . A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道:D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于第VIII族,在地壳中含量排金属中第二位。
(1) 的价电子排布图为
的价电子排布图为___________ 。
(2)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为___________ ,等物质的量B、C、D的这种氢化物的分子中含有 键的个数之比为
键的个数之比为___________ 。
(3)D常见的两种单质D2和D3,其中___________ (填化学式)在水中的溶解度更大。
(4)D、E可形成分子式为ED3的化合物,其空间构型为___________ 。
(5)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为___________ ,预测该化合物熔点___________ 金刚石(填“高于”或“低于”)。
(1)
 的价电子排布图为
的价电子排布图为(2)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为
 键的个数之比为
键的个数之比为(3)D常见的两种单质D2和D3,其中
(4)D、E可形成分子式为ED3的化合物,其空间构型为
(5)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为
您最近一年使用:0次
解题方法
6 . M、P、Q三种元素的相关信息如表:
(1)MO3是常见的M的氧化物,液态MO3有单分子MO3和三聚体(MO3)3两种形式;固态MO3主要以三聚体(MO3)3和无限长链(MO3)n两种形式存在。单分子MO3的空间构型为____ 。
②环状(MO3)3和链状(MO3)n的结构如图所示,环状(MO3)3中M原子的杂化轨道类型为____ ,链状(MO3)n中发生杂化的氧原子有____ 个(用含“n”的式于表示)。常温下,单分子MO3是液体,而链状(MO3)n是固体的原因是____ 。

(2)RH3BH3是目前最具潜力的储氢材料之一。
①RH3BH3能溶于水,其主要原因是____ 。
②RH3BH3分子中与R相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“R—H…H—B”表示.以下物质之间可能形成双氢键的是____ (填序号)。
A.LiH和HCN B.C6H6和CHCl3 C.C2H4和C2H2 D.B2H6和NH3
(3)含元素Q、钇(Y)、氧(O)的某正交相晶胞[YaQbOc]结构如图所示。

a:b:c=____ ,已知1号O原子空间坐标为(0,0, ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, +m,
+m, +n),则3号Fe原子的空间坐标为
+n),则3号Fe原子的空间坐标为____ 。若晶胞参数分别为apm、bpm和cpm,阿伏加德罗常数的值用NA表示,则该晶体的密度为____ g•cm-3(列表达式)。
| 元素 | 相关信息 |
| M | 基态原子的价电子排布式为3s23p4 |
| R | 空气中含量最多的元素 |
| Q | 常见金属元素,基态原子的M层有4个未成对的电子 |
②环状(MO3)3和链状(MO3)n的结构如图所示,环状(MO3)3中M原子的杂化轨道类型为

(2)RH3BH3是目前最具潜力的储氢材料之一。
①RH3BH3能溶于水,其主要原因是
②RH3BH3分子中与R相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“R—H…H—B”表示.以下物质之间可能形成双氢键的是
A.LiH和HCN B.C6H6和CHCl3 C.C2H4和C2H2 D.B2H6和NH3
(3)含元素Q、钇(Y)、氧(O)的某正交相晶胞[YaQbOc]结构如图所示。

a:b:c=
 ),2号O原子空间坐标为(
),2号O原子空间坐标为( ,
, +m,
+m, +n),则3号Fe原子的空间坐标为
+n),则3号Fe原子的空间坐标为
您最近一年使用:0次
名校
解题方法
7 . Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置_______ ,
(2)Ni的价电子排布式为_______ ,属于_______ 区的元素;
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为_______ ;

(4)NiO、FeO属于_______ 晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO_______ FeO(填“<"或“>’’),原因是_______ 。
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有_______ ,_______ ;
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)Mn在元素周期表中的位置
(2)Ni的价电子排布式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
(4)NiO、FeO属于
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为

您最近一年使用:0次
2022-04-02更新
|
222次组卷
|
2卷引用:天津市西青区杨柳青第一中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . 铜及其化合物在人们的日常生活中有着广泛的用途,回答下列问题:
(1)基态铜原子的价电子排布式为___________ 。
(2)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下: 2CuCl+2CO+2H2O= Cu2Cl2·2CO·2H2O,Cu2Cl2·2CO·2H2O是一种配合物。其结构简式如图1所示。

①H2O中氧原子的杂化轨道类型为___________ 。
②该配合物中,CO作配体时配位原子是C而不是O的原因是___________ 。
(3)氧化亚铜的化学式为Cu2O,为一价铜的氧化物,为鲜红色粉末状固体,常用于催化有机物的合成,其立方晶胞如图2所示:

①晶胞中白球Z表示___________ 原子(填名称)
②与O距离相等且最近的O能构成___________ ( 填空间构型)
③体心Z原子的坐标为( ,
, ,
, )。 则P与M两个位置的R原子的坐标分别是
)。 则P与M两个位置的R原子的坐标分别是_____ 、______ 。
(1)基态铜原子的价电子排布式为
(2)在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下: 2CuCl+2CO+2H2O= Cu2Cl2·2CO·2H2O,Cu2Cl2·2CO·2H2O是一种配合物。其结构简式如图1所示。

①H2O中氧原子的杂化轨道类型为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
(3)氧化亚铜的化学式为Cu2O,为一价铜的氧化物,为鲜红色粉末状固体,常用于催化有机物的合成,其立方晶胞如图2所示:

①晶胞中白球Z表示
②与O距离相等且最近的O能构成
③体心Z原子的坐标为(
 ,
, ,
, )。 则P与M两个位置的R原子的坐标分别是
)。 则P与M两个位置的R原子的坐标分别是
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、W、Q为前四周期元素,原子序数依次增大。X元素核外L层只有一个空轨道;Y元素的L层有三个未成对电子,Z的单质是常温下为黄色固体,难溶于水,易溶于 ;W元素是人体中含量最多的金属元素,且是构成骨骼和牙齿的主要元素;Q元素M层全满且N层只有1个电子。
;W元素是人体中含量最多的金属元素,且是构成骨骼和牙齿的主要元素;Q元素M层全满且N层只有1个电子。
(1)写出基态W原子的电子排布式_______ 。
(2)Q元素在周期表的位置_______ 。
(3) 是离子化合物,各服子均满足8电子稳定结构,
是离子化合物,各服子均满足8电子稳定结构, 与
与 互为等电子体,则
互为等电子体,则 的电子式是
的电子式是_______ ,W、X、Y三种元素的电负性由大到小顺序是_______ 。(写元素符号)。
(4)如图为Z单质分子的结构,其分子式为_______ ,Z原子的杂化方式为_______ 。其单质难溶于水,易溶于 的原因为
的原因为_______ 。

 ;W元素是人体中含量最多的金属元素,且是构成骨骼和牙齿的主要元素;Q元素M层全满且N层只有1个电子。
;W元素是人体中含量最多的金属元素,且是构成骨骼和牙齿的主要元素;Q元素M层全满且N层只有1个电子。(1)写出基态W原子的电子排布式
(2)Q元素在周期表的位置
(3)
 是离子化合物,各服子均满足8电子稳定结构,
是离子化合物,各服子均满足8电子稳定结构, 与
与 互为等电子体,则
互为等电子体,则 的电子式是
的电子式是(4)如图为Z单质分子的结构,其分子式为
 的原因为
的原因为
您最近一年使用:0次
解题方法
10 . X、Z、Q、R、T为前四周期元素,且原子序数依次增大。X和Q属同族元素,X和R可形成化合物XR4;R2为黄绿色气体;Z与X同周期且基态原子的s轨道和p轨道的电子总数相等;T2+的3d轨道中有5个电子。请回答下列问题。
(1)Z基态原子的电子排布式是_______ ;Z所在周期元素中,最高价氧化物对应的水化物酸性最强的是_______ (填化学式)。
(2)RZ 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为_______ 。
(3)水中T含量超标,容易使洁具和衣物染色。RZ2可以用来除去水中超标的T2+,生成黑色沉淀TZ2,当消耗0.2molRZ2时,共转移了1mol电子,则反应的离子方程式为_______ 。
(1)Z基态原子的电子排布式是
(2)RZ
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为(3)水中T含量超标,容易使洁具和衣物染色。RZ2可以用来除去水中超标的T2+,生成黑色沉淀TZ2,当消耗0.2molRZ2时,共转移了1mol电子,则反应的离子方程式为
您最近一年使用:0次



