Mn和Ni是构成合金钢金(即铁合金)的主要元素。请回答下列问题:
(1)Mn在元素周期表中的位置_______ ,
(2)Ni的价电子排布式为_______ ,属于_______ 区的元素;
(3)过硫酸盐(S2O )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为_______ ;

(4)NiO、FeO属于_______ 晶体,已知r(Ni2+)>r(Fe2+),则熔点NiO_______ FeO(填“<"或“>’’),原因是_______ 。
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有_______ ,_______ ;
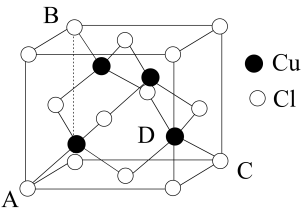
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)Mn在元素周期表中的位置
(2)Ni的价电子排布式为
(3)过硫酸盐(S2O
 )氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
)氧化法常用于测定钢中锰的含量,H2S2O8的结构式如图所示,H2S2O8中S的轨道杂化方式为
(4)NiO、FeO属于
(5)铜盐是自然界中重要的盐,向CuSO4溶液中加入过量稀氨水,所涉及的化学反应有
(6)已知CuCl的晶胞结构如图所示:晶胞中边长为688pm,阿伏加德罗常数的值为NA,则该晶体密度为

更新时间:2022-04-02 22:26:37
|
相似题推荐
【推荐1】某市售照明材料LED晶片是一种发光二极管。材质组成为:GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、GaInN(氮化镓铟)等。请回答下列问题:
(1)砷基态原子的核外电子排布式为______________________ 。
(2)上述非金属元素氢化物的沸点从高到低的顺序为___________ 。
(3)下列说法正确的是___________
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。

①晶胞中砷与镓原子间的化学键类型有___________ 。
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是___________ 。
③一个晶胞的组成为___________ 。
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=___________ 。
(1)砷基态原子的核外电子排布式为
(2)上述非金属元素氢化物的沸点从高到低的顺序为
(3)下列说法正确的是
a.电负性:As<Ga b.SiC与GaAs互为等电子体 c.第一电离能:As>Se>Ga
(4)如图所示为GaAs的晶胞结构,晶体熔点为1237℃。

①晶胞中砷与镓原子间的化学键类型有
②一个镓原子周围所有距离最近且相等的砷原子形成的空间构型是
③一个晶胞的组成为
④已知晶胞棱长a=5.64×10-10m,则该晶胞密度为ρ=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C为短周期主族元素并且原子序数依次增大,且为同周期元素。A元素是非金属元素且原子核外成对电子数是未成对电子数的2倍;B元素最外层有3个未成对电子;C元素核外有3对成对电子。请根据相关信息,用化学用语回答下列问题:
(1)A的基态原子核中核外有___________ 种运动状态不同的电子;B的基态原子中电子占据最高能级的电子云廓图为___________ 。
(2)B的氢化物 的VSEPR模型名称为
的VSEPR模型名称为____ ,其分子空间结构为____ ;A、B、C三种元素的第一电离能由大到小的顺序为____ (填元素符号))。
(3)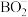 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为____ 。
(4)由A、C形成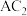 分子中,1mol该分子中含有
分子中,1mol该分子中含有 键的数目为
键的数目为___________ ( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)A的基态原子核中核外有
(2)B的氢化物
 的VSEPR模型名称为
的VSEPR模型名称为(3)
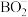 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为(4)由A、C形成
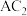 分子中,1mol该分子中含有
分子中,1mol该分子中含有 键的数目为
键的数目为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】甘肃矿产资源丰富,金属冶炼在国民经济发展中有着重要的作用。锰酸锂鲤离子蓄电池是第二代锂离子动力电池,工业上用某软锰矿(主要成分为 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂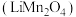 ,流程如图所示:
,流程如图所示:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 元素位于元素周期表中的
元素位于元素周期表中的_______ 区。
(2)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是_______ (写一条即可)。
(3)“还原”步骤得到的溶液中阳离子主要是 ,生成
,生成 的离子方程式为
的离子方程式为_______ ;滤渣1的主要成分为_______ 。
(4)已知某离子浓度[用 表示]形成沉淀与溶液
表示]形成沉淀与溶液 的关系如下图所示:
的关系如下图所示: 调节
调节 的范围是
的范围是_______ 。
(5)“沉锰”得到的是 和
和 滤饼,所得滤液回收可用于
滤饼,所得滤液回收可用于_______ 。
(6)“锂化”是将 和
和 按
按 的物质的量比配料,球磨
的物质的量比配料,球磨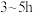 ,然后升温至
,然后升温至 ,保温
,保温 ,自然冷却至室温得产品,写出化学反应方程式:
,自然冷却至室温得产品,写出化学反应方程式:_______ 。
 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂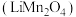 ,流程如图所示:
,流程如图所示:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 元素位于元素周期表中的
元素位于元素周期表中的(2)“酸浸”时,为了提升各物质的浸出速率,除了适当升高温度外,还可以采取的措施是
(3)“还原”步骤得到的溶液中阳离子主要是
 ,生成
,生成 的离子方程式为
的离子方程式为(4)已知某离子浓度[用
 表示]形成沉淀与溶液
表示]形成沉淀与溶液 的关系如下图所示:
的关系如下图所示: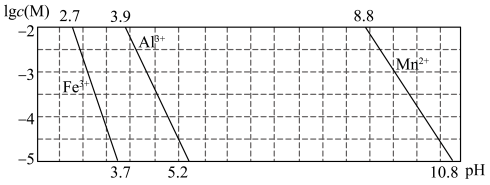
 调节
调节 的范围是
的范围是(5)“沉锰”得到的是
 和
和 滤饼,所得滤液回收可用于
滤饼,所得滤液回收可用于(6)“锂化”是将
 和
和 按
按 的物质的量比配料,球磨
的物质的量比配料,球磨 ,然后升温至
,然后升温至 ,保温
,保温 ,自然冷却至室温得产品,写出化学反应方程式:
,自然冷却至室温得产品,写出化学反应方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
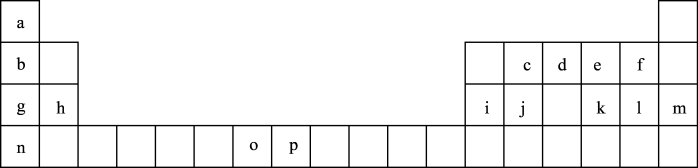
试回答下列问题:
①表中碱性最强的为_______ (写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______ ;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
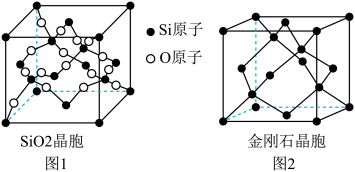
①推测SiO2晶胞中Si采用______ 杂化,O—Si—O的键角为___________ 。
②一个SiO2晶胞中,含有_______ 个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______ Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏加 德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。

试回答下列问题:
①表中碱性最强的为
②基态o原子的价电子排布图为
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。

①推测SiO2晶胞中Si采用
②一个SiO2晶胞中,含有
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石
④假设金刚石晶胞的边长为a pm,NA为阿伏加 德罗常数,试计算该晶胞的密度
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】过渡金属钛(Ti)性能优越,是继铁、铝之后应用广泛的“第三金属”,被誉为“未来钢铁”、“战略金属”。回答下列问题:
(1)下列Ti 原子电子排布式表示的状态中,电离最外层一个电子所需能量最大的是_______ (填标号)。
(2)TiCl4是氧化法制取钛的中间产物,TiCl4分子结构与TiCl4相同,二者常温下都是无色液体,则TiCl4分子的空间结构为_______ 。TiCl4的稳定性比CCl4差,极易水解,原因是_______ (从原子半径、键长和键能的角度分析)。
(3)六氟合钛酸钾(K2TiF6)可用作钛酸和金属钛的制造。六氟合钛酸钾中存在[TiF6]2-,该晶体中不存在的化学键是 _______ (填标号)。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:

①有机物甲中标“*”的碳原子的杂化方式为_______ ,1mol甲分子中含有_______ mol σ键。
②有机物乙中,C、N、O三种元素的第一电离能由大到小的顺序是_______ 。
③有机物乙的沸点高于有机物甲,其主要原因是_______ 。
(5)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。
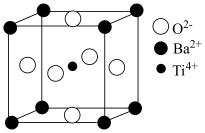
①晶体中一个Ba2+周围距离最近的O2-数目为_______ 。
②已知该晶体的密度为_______ ρg·cm-3,阿伏加德罗常数的值为NA,则该晶体中Ba2+与Ti4+之间的最短距离为 _______ pm (列出计算式)。
(1)下列Ti 原子电子排布式表示的状态中,电离最外层一个电子所需能量最大的是_______ (填标号)。
| A.[Ar]3d²4s¹4p¹ | B.[Ar]3d²4s² |
| C.[Ar]3d³4s²4p¹ | D.[Ar]3d¹4s¹4p² |
(2)TiCl4是氧化法制取钛的中间产物,TiCl4分子结构与TiCl4相同,二者常温下都是无色液体,则TiCl4分子的空间结构为
(3)六氟合钛酸钾(K2TiF6)可用作钛酸和金属钛的制造。六氟合钛酸钾中存在[TiF6]2-,该晶体中不存在的化学键是 _______ (填标号)。
| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下:

①有机物甲中标“*”的碳原子的杂化方式为
②有机物乙中,C、N、O三种元素的第一电离能由大到小的顺序是
③有机物乙的沸点高于有机物甲,其主要原因是
(5)嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛矿的晶胞结构如图所示。

①晶体中一个Ba2+周围距离最近的O2-数目为
②已知该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】《化学世界》刊载了我国科学家的研究成果:在钴锰氧化物 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:___________ 。
(2)Co和Ni都属于第Ⅷ族元素,均能与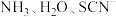 等配体组成配合物。
等配体组成配合物。
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是___________ 。
(3)比较熔点大小:CoO___________ MnO(填“<”,“=”或“>”)
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。 ),则C原子的坐标参数为
),则C原子的坐标参数为___________ 。
②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为___________ g∙cm-3。
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为___________ (填阿拉伯数字序号)。
 的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
的催化作用下,偶氮桥联二呋咱高能炸药也可作固体火箭推进剂,M是合成该推进剂的中间体,M的结构简式如图所示。回答下列问题:
(2)Co和Ni都属于第Ⅷ族元素,均能与
 等配体组成配合物。
等配体组成配合物。①一种Ni2+配离子的结构如图所示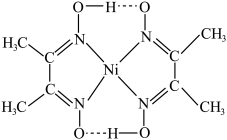 ,该配离子中存在的化学键类型有
,该配离子中存在的化学键类型有
②SCN-与金属离子形成的配合物中配位原子一般是S而不是N,其原因是
(3)比较熔点大小:CoO
(4)KMnF3晶体有钻钛矿型的立方结构,晶胞结构如图1所示。
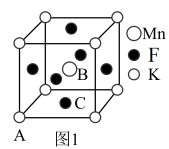
 ),则C原子的坐标参数为
),则C原子的坐标参数为②若阿伏加德罗常数的值为NA,晶胞参数为anm,则晶体密度为
③在KMnF3晶胞结构的另一种表示中,Mn处于各顶角位置。该晶胞结构中,沿立方格子对角面取得的截图如图2所示。F在晶胞中的位置为
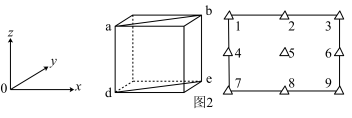
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1)基态砷原子的核外价电子排布式为___________ 。
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为_____________ ,电负性由大到小的顺序为_________________________ 。
(3)H2O与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是____________________________________ 。
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为_____________ ,所含共价键的类型为_____________ ,N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_____________________ 。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为_____________ 。
②A、B点的原子坐标如图所示,则C点的原子坐标为_____________ 。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____________ (列出计算式即可,用NA表示阿伏伽德罗常数的数值)g/cm3。
(1)基态砷原子的核外价电子排布式为
(2)生产农药的原料PSCl3中P、S、Cl的第一电离能由大到小的顺序为
(3)H2O与H2S为同族元素的氢化物,H2O可以形成H3O+或H9O4+等,而H2S几乎不能形成类似的H3S+或H9S4+,其原因是
(4)COS(羰基硫)可用作粮食的熏蒸剂,其中碳原子的杂化轨道类型为
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃ ,其晶胞结构如图所示。

①磷化铝的晶体类型为
②A、B点的原子坐标如图所示,则C点的原子坐标为
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:(NA为阿伏加 德罗常数的值),请用化学用语回答下列问题:
(1)写出D元素在周期表的位置______ ,基态E2+价电子的排布图为_______ ,B元素能量最高的电子其轨道呈_______ 形。
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为___________ 。
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为_____________ ,B、C、D简单离子的半径由大到小的顺序为_________ 。
(4)写出C的核外有18个电子的氢化物的电子式________ 。
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为___________ 。
(6)已知沸点:B2H4>A2H6 ,主要原因为____________________ 。
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________ ;设晶胞边长为a cm,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。

| 元素 | 相关信息 |
| A | 基态原子的价电子排布式为nSnnPn |
| B | 元素原子的核外p电子数比s电子数少1个 |
| C | 最外层电子数是电子层数的3倍 |
| D | 简单离子是第三周期元素中离子半径最小的 |
| E | 价电子层中的未成对电子数为4 |
(2)A与C形成的最高价化合物,中心原子轨道杂化类型为
(3)A、B、C三种基态原子的第一电离能由大到小的顺序为
(4)写出C的核外有18个电子的氢化物的电子式
(5)E可用做某些反应的催化剂,CO易导致E失去催化活性:E+5CO = E(CO)5,E(CO)5熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为
(6)已知沸点:B2H4>A2H6 ,主要原因为
(7)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】 广泛应用于太阳能电池领域,可以
广泛应用于太阳能电池领域,可以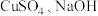 和抗坏血酸为原料制备
和抗坏血酸为原料制备 。
。
(1) 基态核外电子排布式为
基态核外电子排布式为_______ 。
(2)向 溶液中逐滴加入过量氨水,先产生蓝色沉淀后沉淀溶解变成蓝色溶液,生成
溶液中逐滴加入过量氨水,先产生蓝色沉淀后沉淀溶解变成蓝色溶液,生成 ,此过程涉及的离子方程式为
,此过程涉及的离子方程式为_______ ;形成的配合物 中的中心离子是
中的中心离子是_______ ,配体是_______ ,配位数是_______ 。
(3)图1分子中碳原子的轨道杂化类型为_______ 和_______ 。
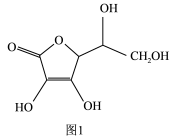
(4)一个 晶胞(见图2)中,氧离子的数目为
晶胞(见图2)中,氧离子的数目为_______ 。

 广泛应用于太阳能电池领域,可以
广泛应用于太阳能电池领域,可以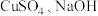 和抗坏血酸为原料制备
和抗坏血酸为原料制备 。
。(1)
 基态核外电子排布式为
基态核外电子排布式为(2)向
 溶液中逐滴加入过量氨水,先产生蓝色沉淀后沉淀溶解变成蓝色溶液,生成
溶液中逐滴加入过量氨水,先产生蓝色沉淀后沉淀溶解变成蓝色溶液,生成 ,此过程涉及的离子方程式为
,此过程涉及的离子方程式为 中的中心离子是
中的中心离子是(3)图1分子中碳原子的轨道杂化类型为

(4)一个
 晶胞(见图2)中,氧离子的数目为
晶胞(见图2)中,氧离子的数目为
您最近一年使用:0次
【推荐1】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________ ,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___ [Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈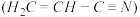 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________ 。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________ (用化学式表示),其理由为_______________ 。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________ , RZ2的密度___________ g/cm3(用a、b表示)。

Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为
(2)Z2X2与XZW反应可得丙烯腈
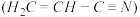 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】根据已学物质结构与性质的有关知识,回答下列问题:
(1)基态铁原子的价电子轨道排布图为__________ 。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+____ Fe3+(填“大于”或“小于”),原因是________________ 。
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为__________ 。
(3)C、H、N、O四种元素中电负性由大到小的顺序是________ (填元素符号下同),前四周期元素中基态原子核外未成对电子数最多的是______________ 。
(4)一种铜的溴化物晶胞结构如下图所示
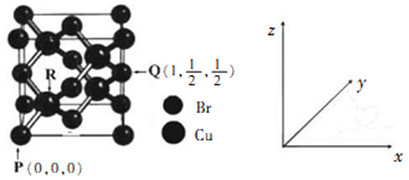
由图可知,该晶体的化学式为________ ,与每个Br紧邻Br有______ 个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_________ 。
(1)基态铁原子的价电子轨道排布图为
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为
(3)C、H、N、O四种元素中电负性由大到小的顺序是
(4)一种铜的溴化物晶胞结构如下图所示

由图可知,该晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】2017年4月26日,中国首艘国产航母在大连正式下水,标志着我国自主设计建造航空母舰取得重大阶段性成果。请回答下列问题:
I、航母用钢可由低硅生铁冶炼而成。
(1)硅原子价层电子的轨道表示式(电子排布图)为_____________ 。
(2)Fe3+比Fe2+稳定的原因是____________ 。
(3)FeO、NiO的晶体结构与NaCl的晶体结构相同。其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm。则熔点FeO________ (填“<”“>”或“=”)NiO,原因是___________________ 。
II、航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
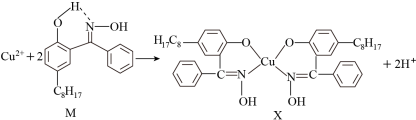
(4)M所含元素的电负性由大到小的顺序为_________________________ (用元素符号表示)。
(5)上述反应中断裂和生成的化学键有________ (填序号)。
A.共价键 B.配位键 C.金属键 D.范德华力
(6)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。

①该晶胞结构中铜原子的配位数是________ 。
②已知该晶体的密度为dg∙cm-3,阿加德罗常数的值为NA,则该立方晶胞的参数是________________ pm。
I、航母用钢可由低硅生铁冶炼而成。
(1)硅原子价层电子的轨道表示式(电子排布图)为
(2)Fe3+比Fe2+稳定的原因是
(3)FeO、NiO的晶体结构与NaCl的晶体结构相同。其中Fe2+与Ni2+的离子半径分别为7.8×10-2nm、6.9×10-2nm。则熔点FeO
II、航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

(4)M所含元素的电负性由大到小的顺序为
(5)上述反应中断裂和生成的化学键有
A.共价键 B.配位键 C.金属键 D.范德华力
(6)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。

①该晶胞结构中铜原子的配位数是
②已知该晶体的密度为dg∙cm-3,阿加德罗常数的值为NA,则该立方晶胞的参数是
您最近一年使用:0次



