名校
解题方法
1 . X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、E的元素符号依次是___________ 、_________ 。
(2)XZ2是_______ (选填极性或非极性)分子, XZ2与YZ2在相同条件下两者在水中的溶解度较大的是___ (写分子式)。
(3)Q的元素名称是_____ ,它属于第____ 周期,它的核外电子排布式为________ ,在形成化合物时它的最高化合价为__________ 。
(4)X和Z的最简单氢化物分别为H2X和H2Z,试判断H2X和H2Z的键角大小关系并说明原因________ 。
(1)X、E的元素符号依次是
(2)XZ2是
(3)Q的元素名称是
(4)X和Z的最简单氢化物分别为H2X和H2Z,试判断H2X和H2Z的键角大小关系并说明原因
您最近一年使用:0次
解题方法
2 . X、Y、Z为三种元素,X能与氢形成气态XH4,其中X的质量分数为75%;且X与Y能形成XY2型化合物。Y的原子核内质子数和中子数相等,在Y的氢化物中,Y的质量分数为88.9%。Z的最高价氧化物的水化物是酸性最强的酸。
(1)X的单质叫做______ ,它属于______ 晶体。
(2)Y的氢化物属于______ 晶体,它的电子式是______ 。
(3)Z元素位于周期表的第______ 周期______ 族,它的氢化物是______ 性分子。
(4)X与Z形成的化合物可用电子式表示为______ ,其分子的空间构型是______ 体,属于______ 性分子,它的晶体属于______ 晶体。
(1)X的单质叫做
(2)Y的氢化物属于
(3)Z元素位于周期表的第
(4)X与Z形成的化合物可用电子式表示为
您最近一年使用:0次
解题方法
3 . 短周期主族元素X、Y、Z、W、M原子序数依次增大,X是地壳中含量最多的元素,Y原子最外层只有一个电子,Z位于周期表 ⅢA族,W与X同主族。下列说法正确的是
| A.由X、W组成的化合物均为非极性分子 | B.ZM3为离子晶体 |
| C.由X、Y组成的化合物中均不含共价键 | D.MX2可用于自来水消毒 |
您最近一年使用:0次
解题方法
4 . W、X、Y、Z为原子序数依次增大的短周期主族元素,W是宇宙中含量最丰富的元素,X是第二周期未成对电子最多的元素,Y最外层有2个未成对电子,其单质常做半导体,Z的第一电离能是同周期主族元素中最大的。下列说法正确的是( )
| A.Y与Z形成的最简单化合物属于非极性分子 |
| B.W与X、Y形成的最简单化合物在水中溶解度:X<Y |
| C.W、X、Y的最高价氧化物沸点最高的是:W的最高价氧化物 |
| D.X、Z的氧化物对应水化物的酸性:X<Z |
您最近一年使用:0次
解题方法
5 . X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳中含量最多的元素,Q的核电荷数是X与Z的核电荷数之和,E是元素周期表中电负性最大的元素。请回答下列问题:
(1)X、Y的元素符号依次为__________ 、__________ 。
(2) 与
与 分别属于
分别属于__________ (填“极性分子”或“非极性分子”,下同)和__________ 。
(3)Q的元素符号是__________ ,它位于第__________ 周期,它的基态原子的核外电子排布式为____________________ ,在形成化合物时它的最高化合价为__________ 。
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:______________________________ 。
(1)X、Y的元素符号依次为
(2)
 与
与 分别属于
分别属于(3)Q的元素符号是
(4)用氢键表示式写出E的氢化物溶液中存在的所有氢键:
您最近一年使用:0次
2020-04-10更新
|
106次组卷
|
2卷引用:第4节 分子间作用力与物质性质——A学习区 夯实基础(鲁科版选修3)
名校
解题方法
6 . 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为____ 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是____________________ 。
(3)E的最高价氧化物分子的空间构型是__________ ,是____ 分子(填“极性”“非极性”)。
(4)F原子的核外电子排布式是________________ 。
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为_________ 。(a)中E原子的配位数为____ 。

(1)A、B、C、D的第一电离能由小到大的顺序为
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是
(3)E的最高价氧化物分子的空间构型是
(4)F原子的核外电子排布式是
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子),其化学式为

您最近一年使用:0次
真题
解题方法
7 . NaCN超标的电镀废水可用两段氧化法处理:
Ⅰ.NaCN与NaClO反应,生成NaOCN和NaCl
Ⅱ.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________ (选填“酸性”、“碱性”或“中性”);原因是______________________ 。
(2)写出第二次氧化时发生反应的离子方程式。____________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__________ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________ 、__________ 和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________ ;H、C、N、O、Na的原子半径从小到大的顺序为_______ 。
(6)HCN是直线型分子,HCN是___________ 分子(选填“极性”或“非极性”)。HClO的电子式为___________ 。
Ⅰ.NaCN与NaClO反应,生成NaOCN和NaCl
Ⅱ.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为
(2)写出第二次氧化时发生反应的离子方程式。
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是
(6)HCN是直线型分子,HCN是
您最近一年使用:0次
2019-01-30更新
|
547次组卷
|
2卷引用:2016年全国普通高等学校招生统一考试化学(上海卷精编版)
8 . 过氧化氢的水溶液俗称双氧水,它的用途很广,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)过氧化氢属于________ (极性/非极性)分子。
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经_______ 操作即可制得,则上述最适合的过氧化物是________ 。
(3)几乎所有古代艺术家的油画都是以铅白2PbCO3·Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式________ 。
(4)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,
①则该反应的化学方程式为____________________ ,
②过氧化氢比理论用量稍多,其目的是_____ 。
③反应温度最好控制在30 -70℃,温度不易过高,其主要原因是_____________________ 。
(5)下图是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为____________ 。

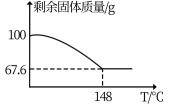
(6)过氧化氢与碳酸钠的加合物 Na2CO3·xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100 g Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为________ 。
(1)过氧化氢属于
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢溶液可取上述某种过氧化物与适量稀硫酸作用,然后经
(3)几乎所有古代艺术家的油画都是以铅白2PbCO3·Pb(OH)2为底色,但若空气中含H2S气体,铅白就会变黑,可以用H2O2将黑色物氧化成颜色相近的PbSO4而修复,写出铅白在空气中变黑的化学方程式
(4)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,
①则该反应的化学方程式为
②过氧化氢比理论用量稍多,其目的是
③反应温度最好控制在30 -70℃,温度不易过高,其主要原因是
(5)下图是硼氢化钠(NaBH4)一过氧化氢燃料电池示意图,该电池负极的电极反应方程式为

(6)过氧化氢与碳酸钠的加合物 Na2CO3·xH2O2比较稳定,方便储存,可用于消毒、漂白,现称取100 g Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为

您最近一年使用:0次
9 . 短周期元素 W、X、Y 和 Z 的原子序数依次增大。金属元素 W 是制备一种高效电池的重要材料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地壳中含量最丰富的金属元素,Z 原子的最外层电子 数是其电子层数的 2 倍。
(1)W 元素的原子核外共有_____ 种不同运动状态的电子、_____ 种不同能量的电子。
(2)元素 Z 与元素 X 形成共价化合物 XZ2是____ (选填“极性”或“非极性”)分子,其电子式为_____ 。
(3)Y 原子的最外层电子排布式为_____
(4)两种非金属元素中,非金属性较强的元素是_____ (写元素符号),试写出一个能说明这一事实的 化学方程式______________________________________ 。
(1)W 元素的原子核外共有
(2)元素 Z 与元素 X 形成共价化合物 XZ2是
(3)Y 原子的最外层电子排布式为
(4)两种非金属元素中,非金属性较强的元素是
您最近一年使用:0次
名校
10 . (1)下列各组分子中,属于含极性键的非极性分子的是 _______________
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是______ ,配离子 [Cu(NH3)4]2+中提供孤对电子的原子是_______________ 。
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为____ ,Ni(CO)4是_____ (填“极性”或“非极性”)分子。
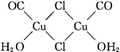
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为____ ;氯化亚铜的盐酸溶液可定量吸收CO形成配合物Cu2(CO)2Cl2·2H2O(结构如图所示),该反应可用于测定空气中CO的含量,每个Cu2(CO)2Cl2·2H2O分子中含有____ 个配位键,____ 个σ键。
BF3 、 H2S 、 CH3Cl 、 NH3 、 CS2、 C60、 C2H4 、 HCl
(2)按所示格式填写下表中的空格:
原子序数 | 原子的价电子排布式 | 周期 | 族 |
17 | ① | 第三 | ② |
③ | 3d54s1 | ④ | ⅥB |
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是
(4)镍的羰基配合物Ni(CO)4是获得高纯度纳米镍的原料,该配合物中镍原子的的价电子排布式为3d10,则其杂化轨道类型为
(5)氯化亚铜是一种白色固体,实验测得其蒸气密度是同条件下氢气密度的99.5倍,则氯化亚铜的分子式为
您最近一年使用:0次



