名校
解题方法
1 . 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
Ⅰ.利用反应:6NO2+8NH3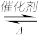 7N2+12H2O处理
7N2+12H2O处理
Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)
Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)硫离子的电子结构示意图为_____ ,氨气分子的电子式为______ ,氨气分子属于______ 分子(填“极性”或者“非极性”)。
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为_____________ ,能证明其递变规律的事实是_______ 。
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=______________ 。
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是______ 。
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
Ⅰ.利用反应:6NO2+8NH3
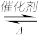 7N2+12H2O处理
7N2+12H2O处理Ⅱ.一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)-Q (Q>0)
SO3(g)+NO(g)-Q (Q>0)Ⅲ.CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)(1)硫离子的电子结构示意图为
(2)C、O、S这三种元素中属于同周期元素的非金属性由强到弱的顺序为
a.最高价氧化物对应水化物的酸性 b.气态氢化物的沸点
c.单质与氢气反应的难易程度 d.其两两组合形成的化合物中元素的化合价
(3)对于Ⅰ中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均速率v(NO2)=
(4)对于Ⅱ中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.NO2浓度保持不变
c.NO2和SO3的体积比保持不变 d.混合气体的平均相对分子质量保持不变
您最近一年使用:0次
2020-09-20更新
|
610次组卷
|
4卷引用:湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题
湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题(已下线)第二章 化学反应速率与化学平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题河南省周口恒大中学2023-2024学年高二上学期9月月考化学试题
解题方法
2 . 下表为元素周期表的短周期部分
请参照元素a﹣h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有______ 种不同伸展方向的电子云,最外层共有______ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)______ >______ ;b、c 两元素非金属性较强的是(写元素符号)______ ,写出证明这一结论的一个化学方程式______ 。
(3)d、e元素形成的四原子化合物的电子式为______ ;b、g元素形成的分子bg2为______ 分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)______ (填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是______ 。
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:______ 。若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为______ mol。
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
(1)h原子核外有
(2)比较d、e元素常见离子的半径大小(用化学式表示)
(3)d、e元素形成的四原子化合物的电子式为
(4)上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,相同条件下,0.1mol/L 盐R中c(ca4+)
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL﹣35mL)间发生的离子方程式:
您最近一年使用:0次
名校
3 . 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
(1)过氧化氢的分子结构如图(Ⅱ),则过氧化氢属于__ (极性/非极性)分子.过去曾经有人认为过氧化氢的分子结构也可能是(Ⅰ),选择合理实验方法证明过氧化氢的分子结构为(Ⅱ)__ (选填编号).
a.测定过氧化氢的沸点
b.测定过氧化氢分解时的吸收的能量
c.测定过氧化氢中H﹣O和O﹣O的键长
d.观察过氧化氢细流是否在电场中偏转
Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢.实验室可用稀硫酸和过氧化物在用冰冷却的条件下反应制取过氧化氢.
(2)上述过氧化物中最适合的是__ ,反应完毕后__ (填操作名称)即可得到双氧水.
(3)若反应时没有用冰冷却,会有气体产生,写出反应的化学方程式__ .用酸性高锰酸钾溶液滴定双氧水的方法可以测定双氧水的浓度.
(4)取5.00mL 双氧水样品,配制成250mL溶液.此实验过程必须用到的两种主要仪器为__ (填仪器名称).
(5)取25.00mL上述溶液,用0.020mol/L的酸性高锰酸钾溶液滴定,看到__ ,到达滴定终点,消耗高锰酸钾溶液15.50mL.则原双氧水样品中含过氧化氢__ g/L.

(1)过氧化氢的分子结构如图(Ⅱ),则过氧化氢属于
a.测定过氧化氢的沸点
b.测定过氧化氢分解时的吸收的能量
c.测定过氧化氢中H﹣O和O﹣O的键长
d.观察过氧化氢细流是否在电场中偏转
Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢.实验室可用稀硫酸和过氧化物在用冰冷却的条件下反应制取过氧化氢.
(2)上述过氧化物中最适合的是
(3)若反应时没有用冰冷却,会有气体产生,写出反应的化学方程式
(4)取5.00mL 双氧水样品,配制成250mL溶液.此实验过程必须用到的两种主要仪器为
(5)取25.00mL上述溶液,用0.020mol/L的酸性高锰酸钾溶液滴定,看到

您最近一年使用:0次
2020-03-21更新
|
99次组卷
|
4卷引用:上海市青浦二中2016届高三10月月考化学试题
名校
解题方法
4 . X、Y、Z是同周期的短周期元素,原子序数依次增大。Y为地壳中含量最高的金属元素,Z是所在周期中非金属最强的元素,X、Y的最高价氧化物对应的水化物可以相互反应。
(1)Y元素的原子结构示意图是_________________ 。
(2)X、Z最高价氧化物对应的水化物之间发生反应的离子方程式为______________ 。
(3)Z、碳和氟三种元素可组成氟利昂(CZ3F),它在紫外线作用下破坏臭氧层的反应过程部如下:
①CZ3F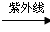 CZ2F·+Z·
CZ2F·+Z·
②Z·+O3 O2+ZO·
O2+ZO·
③ ZO·+O· Z·+O2
Z·+O2
反应①中破坏的化学键属于________ (填“极性”或“非极性”)共价键。
(4)下列说法正确的是___________ (填字母)。
a.X与氧元素可形成碱性氧化物
b.常温下与水反应的难易程度可证明金属性:X>Y
c.X、Y、Z形成的简单离子的核外电子排布均相同
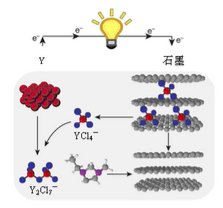
(5)Y、石墨与含YCl4-的离子液体可构成原电池,其工作原理如图所示。若电路中转移电子的物质的量为4. 5 mol,则消耗Y单质的质量是________ 。
(1)Y元素的原子结构示意图是
(2)X、Z最高价氧化物对应的水化物之间发生反应的离子方程式为
(3)Z、碳和氟三种元素可组成氟利昂(CZ3F),它在紫外线作用下破坏臭氧层的反应过程部如下:
①CZ3F
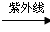 CZ2F·+Z·
CZ2F·+Z·②Z·+O3
 O2+ZO·
O2+ZO·③ ZO·+O·
 Z·+O2
Z·+O2反应①中破坏的化学键属于
(4)下列说法正确的是
a.X与氧元素可形成碱性氧化物
b.常温下与水反应的难易程度可证明金属性:X>Y
c.X、Y、Z形成的简单离子的核外电子排布均相同
(5)Y、石墨与含YCl4-的离子液体可构成原电池,其工作原理如图所示。若电路中转移电子的物质的量为4. 5 mol,则消耗Y单质的质量是
您最近一年使用:0次
名校
解题方法
5 . 下列说法不正确的是
A.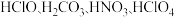 的酸性依次增强 的酸性依次增强 |
B.苹果酸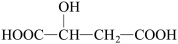 含有1个手性碳原子 含有1个手性碳原子 |
C.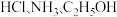 均易溶于水的原因之一是与 均易溶于水的原因之一是与 均能形成氢键 均能形成氢键 |
| D.以极性键结合的分子不一定是极性分子 |
您最近一年使用:0次
2022-10-18更新
|
396次组卷
|
11卷引用:吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题
吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题第2章 化学键与分子间作用力——B拓展区综合拓展(鲁科版选修3)江苏省南通中学2019-2020学年高二下学期期中考试化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题四川省广安市第二中学校2022-2023学年高二下学期期中考试化学试题四川省泸县第五中学2022-2023学年高二下学期5月期中考试化学试题(已下线)第05讲 分子结构与物质的性质-【寒假自学课】2024年高二化学寒假提升学与练(人教版2019)(已下线)2.3.2 分子间作用力 分子的手性(提高)福建省永春第一中学2023-2024学年高二下学期3月月考化学试题四川省富顺一中2023-2024学年高二下学期第一次月考化学试题
名校
6 . 关于CS2,SO2,NH3三种物质的说法中正确的是
| A.CS2在水中的溶解度很小,是由于其属于极性分子 |
| B.NH3在水中溶解度很大只是由于NH3分子有极性 |
| C.CS2为非极性分子,所以在三种物质中熔沸点最低 |
| D.SO2和NH3均易溶于水,原因之一是它们都是极性分子 |
您最近一年使用:0次
名校
解题方法
7 . 肼(H2N-NH2)和偏二甲肼[H2N-N(CH3)2]均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的N—N键方向观察,看到的平面图如下图所示。下列说法不正确的是


| A.肼分子中的氮原子采用sp3杂化 | B.肼分子中既有极性键又有非极性键 |
| C.肼分子是非极性分子 | D.肼与偏二甲肼互称同系物 |
您最近一年使用:0次
2022-05-04更新
|
227次组卷
|
5卷引用:河北省宣化市第一中学2019-2020学年高三12月月考化学试题
河北省宣化市第一中学2019-2020学年高三12月月考化学试题(已下线)第14讲 氮及其化合物(精练)-2022年高考化学一轮复习讲练测河南省开封市五县部分校2021-2022学年高二下学期期中考试化学试题第三节综合拔高练(已下线)第二章章节专项提升
8 . 观察下列模型并结合有关信息,判断有关说法不正确的是
| B12结构单元 | SF6分子 | S8分子 | HCN | |
| 结构示意图 |  |  |  | 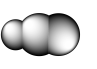 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
| A.单质B结构单元中含有30个B﹣B键,含20个正三角形 |
| B.HCN为直线形 |
| C.SF6是由极性键构成的非极性分子 |
| D.固态硫S8中S原子为sp2杂化 |
您最近一年使用:0次
2021-03-18更新
|
354次组卷
|
5卷引用:青海省湟川中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
9 . 下列说法不正确的是
| A.C3H8中碳原子都采用的是sp3杂化 |
| B.BeCl2、CO2、N2都是非极性分子 |
| C.酸性:H2CO3<H3PO4<H2SO4<HClO |
| D.CO的一种等电子体为NO+,它的电子式为[∶N⋮⋮O∶]+ |
您最近一年使用:0次
名校
解题方法
10 . 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构与H2O2相似。常温下,S2Cl2遇水易水解,并产生使品红溶液褪色的无色气体。下列说法不正确的是
| A.1 mol S2Cl2分子中含有1 mol非极性共价键和2 mol极性共价键,是非极性分子 |
| B.S2Cl2分子中所有原子最外层都达到了8电子稳定结构 |
| C.S2Br2与S2Cl2结构相似,沸点:S2Br2>S2Cl2 |
D.S2Cl2与H2O反应的化学方程式可能为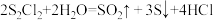 |
您最近一年使用:0次
2021-09-26更新
|
240次组卷
|
5卷引用:四川省内江市第六中学2020-2021学年高二上学期期中考试化学试题
四川省内江市第六中学2020-2021学年高二上学期期中考试化学试题四川省雅安中学2021-2022学年高二上学期10月月考化学试题四川省遂宁中学校2021-2022学年高二上学期期中考试化学试题(已下线)2.3.1 共价键的极性-2021-2022学年高二化学课后培优练(人教版2019选择性必修2)(已下线)第2.3.1讲 共价键的极性-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)



