解题方法
1 . 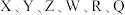 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q的价电子排布式为_______ 。
(2) 形成的有机物
形成的有机物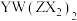 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为_____ , 离子的立体构型是
离子的立体构型是_________ 。
(3)Y、R的最高价氧化物的沸点较高的是_________ (填化学式),原因是_______ 。
(4)将Q单质的粉末加入 的浓溶液中,并通入
的浓溶液中,并通入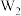 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为_________ 。
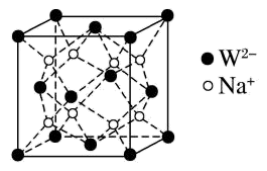
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为________ (填化学式)。 的配位数为
的配位数为_______ ,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为________ 。已知该晶胞的密度为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为______ nm(用含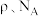 的计算式表示)。
的计算式表示)。
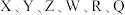 为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:(1)Q的价电子排布式为
(2)
 形成的有机物
形成的有机物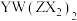 中Y、Z的杂化轨道类型分别为
中Y、Z的杂化轨道类型分别为 离子的立体构型是
离子的立体构型是(3)Y、R的最高价氧化物的沸点较高的是
(4)将Q单质的粉末加入
 的浓溶液中,并通入
的浓溶液中,并通入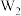 ,充分反应后溶液呈深蓝色,该反应的离子方程式为
,充分反应后溶液呈深蓝色,该反应的离子方程式为(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为
 的配位数为
的配位数为 ,阿伏加德罗常数为
,阿伏加德罗常数为 则两个最近的W离子间距离为
则两个最近的W离子间距离为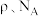 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
2 . 软包电池(水系 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
回答下列问题:
(1)基态 原子核外电子排布式为
原子核外电子排布式为_______ ;原子中运动的电子有两种相反的自旋状态,若一种自旋状态用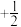 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)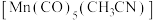 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是_______ (填元素符号),其能量最高的电子所在的能级符号为_______ ,配合物中心原子的配位数是_______ 。
(3) 软包电池的关键组件
软包电池的关键组件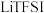 结构如图所示。
结构如图所示。

①其中S原子的杂化轨道类型为_______ 。
②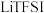 中存在的作用力为
中存在的作用力为_______ (填标号)。
A.金属键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
③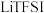 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为_______ ,原因是_______ 。
(4) 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有_______ 个,已知阿伏加德罗常数的值为 ,若晶体的密度为
,若晶体的密度为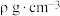 ,该晶胞的边长为
,该晶胞的边长为_______ cm(列出算式)。

 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。回答下列问题:
(1)基态
 原子核外电子排布式为
原子核外电子排布式为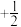 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为(2)
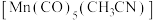 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是(3)
 软包电池的关键组件
软包电池的关键组件 结构如图所示。
结构如图所示。
①其中S原子的杂化轨道类型为
②
 中存在的作用力为
中存在的作用力为A.金属键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键③
 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为(4)
 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有 ,若晶体的密度为
,若晶体的密度为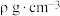 ,该晶胞的边长为
,该晶胞的边长为
您最近一年使用:0次
2022-10-21更新
|
774次组卷
|
3卷引用:广西南宁市2022-2023学年高三上学期摸底测试化学试题
解题方法
3 . 推广磷酸亚铁锂(LiFePO4)电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、、LiCl及苯胺(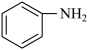 )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。
回答下列问题:
(1)基态铁原子的价层电子排布式为_______ ,基态Fe3+较基态Fe2+稳定的原因是_______ (从价层电子排布角度分析)。
(2)在NH4H2PO4中,N、P、O三种元素的第一电离能由大到小的顺序是_______ ;NH 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为_______ 。
(3)LiFePO4中,PO 的空间结构为
的空间结构为_______ 。
(4)1 mol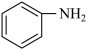 中含有
中含有_______ mol σ键。苯胺水溶性大于苯的主要原因是_______ 。
(5)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶胞结构(底边为平行四边形)如图所示。
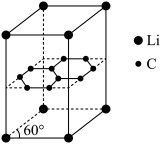
①石墨的硬度小,其原因是_______ ,石墨的熔、沸点高,其原因是_______ 。
②该晶体的化学式为_______ ,该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为_______ g•cm-3(用NA表示阿伏加德罗常数,列出计算表达式)。
 )为原料制磷酸亚铁锂材料。
)为原料制磷酸亚铁锂材料。回答下列问题:
(1)基态铁原子的价层电子排布式为
(2)在NH4H2PO4中,N、P、O三种元素的第一电离能由大到小的顺序是
 中N原子的杂化轨道类型为
中N原子的杂化轨道类型为(3)LiFePO4中,PO
 的空间结构为
的空间结构为(4)1 mol
 中含有
中含有(5)某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶胞结构(底边为平行四边形)如图所示。

①石墨的硬度小,其原因是
②该晶体的化学式为
您最近一年使用:0次
4 . 氮及其化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)第一电离能大于N的第二周期元素有_____ 种。
(2)石墨型(BN) x转变为金刚石型(BN) x时,B原子的杂化轨道类型由_____ 变为____ 。
(3)叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中SO 的立体构型为
的立体构型为___________ 。
(4)氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H-N=N N,则HN3中含有
N,则HN3中含有___________ 个 键,与N
键,与N 互为等电子体的分子的化学式是
互为等电子体的分子的化学式是___________ (写出其中一种即可)。
(5)已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是______ 。
(6)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
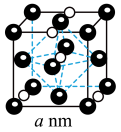
氮化钼的化学式为___________ ,氮化钼晶胞边长为anm,晶体的密度 =
=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)第一电离能大于N的第二周期元素有
(2)石墨型(BN) x转变为金刚石型(BN) x时,B原子的杂化轨道类型由
(3)叠氮化物易与过渡金属元素形成配合物,如:[Fe(N3)(NH3)5]SO4,在该配合物中SO
 的立体构型为
的立体构型为(4)氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H-N=N
 N,则HN3中含有
N,则HN3中含有 键,与N
键,与N 互为等电子体的分子的化学式是
互为等电子体的分子的化学式是(5)已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子的原因是
(6)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
 =
=
您最近一年使用:0次
5 . 我国“嫦娥”五号首次实现地外天体采样返回,这是我国航天事业的又一突破。带回的月壤中含有H、N、O、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。请完成下列问题:
(1)N、O、Al、S四种元素第一电离能从大到小的顺序为_______ 。
(2)Cu、Au是同一副族的元素,Au的原子序数更大,它们属于_______ 区元素,基态Au原子的价电子排布式为_______ 。
(3)SO2分子的空间构型为_______ ,请写出一种与SO2互为等电子体的单质_______ (填化学式)。
(4)某晶体的晶胞结构如图所示,该晶体的化学式为_______ 。如果将Se原子看做密堆积,则其堆积模型为_______ 。
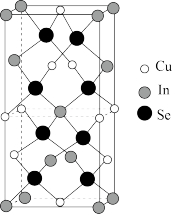
(1)N、O、Al、S四种元素第一电离能从大到小的顺序为
(2)Cu、Au是同一副族的元素,Au的原子序数更大,它们属于
(3)SO2分子的空间构型为
(4)某晶体的晶胞结构如图所示,该晶体的化学式为

您最近一年使用:0次
解题方法
6 . 铜及其化合物的用途非常广泛。回答下列问题:
(1)实验室常用新制的 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。
①基态铜原子的价电子排布式为___________ ,Cu成为阳离子时首先失去___________ 轨道上的电子。
② 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为___________ ,HCHO分子中 键与
键与 键的个数之比为
键的个数之比为___________ 。
③上述反应中涉及的非金属元素的电负性由大到小的顺序为___________ (填元素符号)。
(2)黄铜矿(主要成分为 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为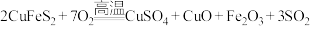 。
。
① 的空间结构为
的空间结构为___________ 。
② 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为___________ 。
(3)磷化铜(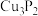 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。

①该晶体中距离Cu原子最近的Cu原子有___________ 个。
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为___________ (用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
(1)实验室常用新制的
 来检验醛基,反应原理为
来检验醛基,反应原理为 。
。①基态铜原子的价电子排布式为
②
 中的中心原子的杂化轨道类型为
中的中心原子的杂化轨道类型为 键与
键与 键的个数之比为
键的个数之比为③上述反应中涉及的非金属元素的电负性由大到小的顺序为
(2)黄铜矿(主要成分为
 )是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为
)是工业炼铜的主要原料,高温下灼烧黄铜矿,其发生的反应之一为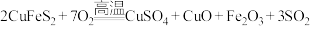 。
。①
 的空间结构为
的空间结构为②
 中的中心原子S上的孤电子对数为
中的中心原子S上的孤电子对数为(3)磷化铜(
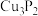 )用于制造磷青铜,某磷青铜的晶胞结构如图所示。
)用于制造磷青铜,某磷青铜的晶胞结构如图所示。
①该晶体中距离Cu原子最近的Cu原子有
②该晶胞中距离最近的Cu原子的核间距为apm,则该晶胞的密度为
 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值) 。
。
您最近一年使用:0次
解题方法
7 . 铜是应用广泛的金属单质。硫酸铜晶体(CuSO4•5H2O),俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的应用。
(1)Cu的价电子排布式为____ 。
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是____ 。
(3)已知CuSO4在碱性条件下加入双缩脲HN(CONH2)2中,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

①该-2价的配位阴离子中sp3杂化的原子与sp2杂化的原子个数之比为____ (不考虑羰基氧的杂化)。
②该-2价的配位阴离子中Cu的配位数为____ 。
(4)卤化亚铜的熔点如表所示,CuF熔点高于其他三种卤化物,自CuCl至CuI熔点依次升高,原因是____ ;CuI的晶体类型为____ 。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为____ 。
②若该晶体的密度为dg•cm-3,晶胞参数为anm,则阿伏加德罗常数值NA=____ (用含a、d的代数式表示)。
(1)Cu的价电子排布式为
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(3)已知CuSO4在碱性条件下加入双缩脲HN(CONH2)2中,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

①该-2价的配位阴离子中sp3杂化的原子与sp2杂化的原子个数之比为
②该-2价的配位阴离子中Cu的配位数为
(4)卤化亚铜的熔点如表所示,CuF熔点高于其他三种卤化物,自CuCl至CuI熔点依次升高,原因是
| 化合物 | CuF | CuCl | CuBr | CuI |
| 熔点/℃ | 908 | 426 | 498 | 605 |

①原子B的坐标参数为
②若该晶体的密度为dg•cm-3,晶胞参数为anm,则阿伏加德罗常数值NA=
您最近一年使用:0次
解题方法
8 . 微量元素指的是在人体中含量低于人体质量0.005%~0.01%的元素,包括Fe、I、Zn、Se、F、Cu、Co、Si等。
(1)F元素的基态原子核外有___ 个未成对电子,基态Fe原子的价电子排布式为____ 。
(2) 为四面体结构,其中Si原子采取的杂化类型为
为四面体结构,其中Si原子采取的杂化类型为_______ 。与 不同,
不同, 的立体构型为
的立体构型为_______ 。
(3)第一电离能Cu小于Zn,理由是_______ 。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是_______ 。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO熔点较高的原因:_______ 。
(5)ZnO晶体存在多种结构,其中某种常见的晶胞结构(如图)。其晶胞边长为anm,阿伏加德罗常数的值为NA,则晶胞密度为_______ (列出计算式)g·cm-3

(1)F元素的基态原子核外有
(2)
 为四面体结构,其中Si原子采取的杂化类型为
为四面体结构,其中Si原子采取的杂化类型为 不同,
不同, 的立体构型为
的立体构型为(3)第一电离能Cu小于Zn,理由是
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(5)ZnO晶体存在多种结构,其中某种常见的晶胞结构(如图)。其晶胞边长为anm,阿伏加德罗常数的值为NA,则晶胞密度为

您最近一年使用:0次
解题方法
9 . 完成下列问题。
(1)甲醇( )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为_______ ,HCHO的空间结构为_______ 。
② 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为_______ 和_______ 。
③甲醇氧化生成HCHO时,会产生CO、 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为_______ 。
(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为 。回答下列问题:
。回答下列问题:
①已知 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有____ 种。
②丁二酮肟( )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有_______ (填标号)。

A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存_______ mol氢气。储氢前,该合金的密度为_______  (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。

(1)甲醇(
 )空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为:
)空气氧化法是生产工业甲醛(HCHO)的常用方法。发生的反应为: 2
2

①HCHO分子内σ键与π键个数之比为
②
 和HCHO分子中碳原子的杂化轨道类型分别为
和HCHO分子中碳原子的杂化轨道类型分别为③甲醇氧化生成HCHO时,会产生CO、
 、
、 等副产物。相同条件下,
等副产物。相同条件下, 的沸点比
的沸点比 的高,主要原因为
的高,主要原因为(2)金属镍是电池制造过程中重要的原材料,未来十年新能源汽车领域镍需求增长将达8~16倍。一种制备金属镍的方法为
 。回答下列问题:
。回答下列问题:①已知
 熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有
熔融状态时能导电,上述制备反应化学方程式中的6种物质所属的晶体类型有②丁二酮肟(
 )是检验
)是检验 的灵敏试剂,可与
的灵敏试剂,可与 生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
生成丁二酮肟镍亮红色沉淀。丁二酮肟镍分子(结构如图1所示)内不存在的作用力有
A.金属键 B.氢键 C.π键 D.配位键 E.离子键
③镧镍合金是稀土系储氢合金的典型代表,其晶胞参数分别为apm、bpm、cpm,阿伏加德罗常数的值为
 ,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存
,该合金储氢后的晶胞如图2所示。1mol镧形成的该合金能储存 (列出含a、b、c和
(列出含a、b、c和 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
名校
10 . 硫、磷的化合物在农药、石油工业、矿物开采、萃取及有机合成等领域的应用广泛,如O,Oˊ二取代基二硫代磷酸在萃取金属中有如下应用:
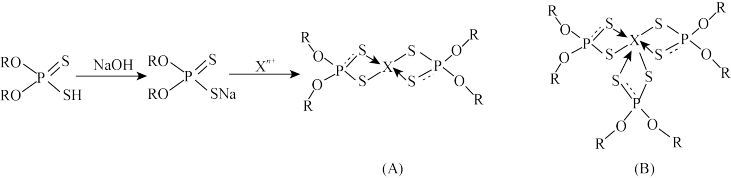
回答下列问题:
(1)P的第一电离能大于S的原因是_______ 。
(2)基态氧原子价电子排布式为_______ 。
(3)物质(A)中的S原子的杂化方式为_______ ,二硫代磷酸根的VSEPR模型为_______ 。
(4)H2O、H2S、H2Se沸点由低到高的顺序_______ ,Te与S同主族,与I同周期,Te属于元素周期表中_______ 区元素。
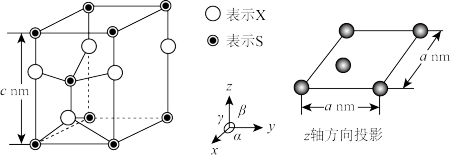
(5)将物质(A)在N2气氛中加热至730℃不再失重,得到金属硫化物的无定形粉末,其六方晶胞如图所示。已知该晶胞参数α=120°,β=γ=90°,X的相对原子质量用M表示,阿伏加德罗常数用NA表示,则该晶体的密度为_______ g·cm-3(列出计算式)。

回答下列问题:
(1)P的第一电离能大于S的原因是
(2)基态氧原子价电子排布式为
(3)物质(A)中的S原子的杂化方式为
(4)H2O、H2S、H2Se沸点由低到高的顺序
(5)将物质(A)在N2气氛中加热至730℃不再失重,得到金属硫化物的无定形粉末,其六方晶胞如图所示。已知该晶胞参数α=120°,β=γ=90°,X的相对原子质量用M表示,阿伏加德罗常数用NA表示,则该晶体的密度为

您最近一年使用:0次
2022-07-06更新
|
451次组卷
|
2卷引用:广西玉林市普通高中2022届高三上学期1月统考理科综合化学试题



