名校
解题方法
1 . 科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是
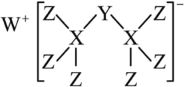
| A.WZ的水溶液呈碱性 |
B.元素非金属性的顺序为 |
| C.Y的最高价氧化物的水化物的晶体是分子晶体 |
| D.该新化合物中Y不满足8电子稳定结构 |
您最近半年使用:0次
2 . 中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
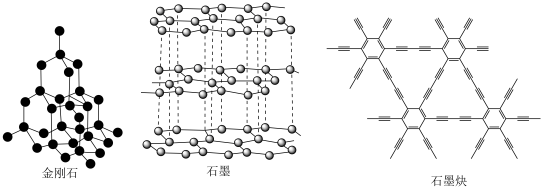
| A.三种物质均是碳单质 | B.三种物质的化学性质相同 |
| C.三种物质的晶体类型相同 | D.三种物质均能导电 |
您最近半年使用:0次
3 . 、臭氧 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。
(1)基态铁原子有___________ 种空间运动状态不同的电子; 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ; 的空间构型为
的空间构型为___________ (用文字描述); 为
为___________ 分子(填“极性”、“非极性”)。
(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因___________ 。
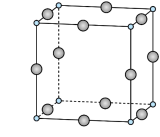
(3)硫单质的常见形式为 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有___________ 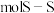 键。
键。 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为___________ 键。 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 在
在 催化下能将烟气中的
催化下能将烟气中的 、
、 分别氧化为
分别氧化为 和
和 ,
, 也可在其他条件下被还原为
也可在其他条件下被还原为 。
。(1)基态铁原子有
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为 为
为(2)碘的四氯化碳溶液为紫红色,加入浓碘化钾水溶液,振荡后溶液紫色变浅,请用离子方程式说明原因
(3)硫单质的常见形式为
 ,其环状结构如图所示,
,其环状结构如图所示, 中含有
中含有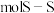 键。
键。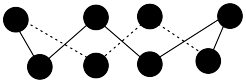
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的192℃,由此可以判断铝氟之间的化学键为
的192℃,由此可以判断铝氟之间的化学键为 结构属立方晶系,晶胞如图所示,
结构属立方晶系,晶胞如图所示, 的配位数为。若晶胞参数为
的配位数为。若晶胞参数为 ,晶体密度
,晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
名校
4 . 某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是
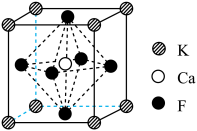
A.每个 周围最近且等距的 周围最近且等距的 数为12 数为12 | B.与 距离最近的是 距离最近的是 |
C.该物质的化学式为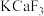 | D.若 换为 换为 ,则晶胞棱长将改变 ,则晶胞棱长将改变 |
您最近半年使用:0次
名校
5 . 二氯化二硫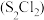 是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用
是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用 浸润)中通入
浸润)中通入 。下列说法错误的是
。下列说法错误的是
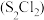 是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用
是广泛用于橡胶工业的硫化剂,广泛用于石油化工,其分子结构如下图所示。制备方法:在120℃向硫磺粉(用 浸润)中通入
浸润)中通入 。下列说法错误的是
。下列说法错误的是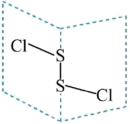
A. 分子中所有原子均满足8电子结构 分子中所有原子均满足8电子结构 |
B.用 浸润可加快反应速率,体现相似相溶原理 浸润可加快反应速率,体现相似相溶原理 |
C. 中S原子的杂化类型为 中S原子的杂化类型为 杂化 杂化 |
D. 晶体类似干冰晶体,则每个 晶体类似干冰晶体,则每个 周围等距且紧邻的 周围等距且紧邻的 有12个 有12个 |
您最近半年使用:0次
名校
6 . 下列说法正确的是
A.HCl属于共价化合物,溶于水能电离出 和 和 |
| B.NaOH是离子化合物,该物质中只含离子键 |
| C.HI气体受热分解的过程中,只需克服分子间作用力 |
| D.炭黑具有各向异性,碳原子在三维空间里呈周期性有序排列 |
您最近半年使用:0次
名校
解题方法
7 . 资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①CO2属于___________ 分子(填“极性”或“非极性”),其晶体(干冰)属于__________ 晶体。
②用饱和 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)=_______ ;(室温下, 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式_____ 。
③聚合离子液体是目前广泛研究的CO2吸附剂。结合下图 分析聚合离子液体吸附CO2的有利条件是____________ 。
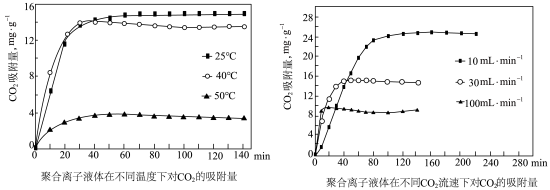
(2)生产尿素:工业上以CO2、 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步: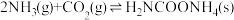
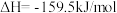
第二步:
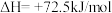
写出上述合成尿素的热化学方程式_______ 。
(3)合成乙酸:中国科学家首次以 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
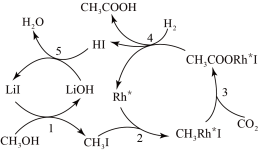
①原料中的 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:____________ 。
②根据图示 ,写出总反应的化学方程式:_______ 。
(1)CO2的捕集:
①CO2属于
②用饱和
 溶液做吸收剂可“捕集”CO2。若所得溶液
溶液做吸收剂可“捕集”CO2。若所得溶液 ,溶液中c(HCO
,溶液中c(HCO ):c(CO
):c(CO )=
)= 的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式
的K1=4×10-7;K2=5×10-11)若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式③聚合离子液体是目前广泛研究的CO2吸附剂。

(2)生产尿素:工业上以CO2、
 为原料生产尿素[CO(NH2)2],该反应分为二步进行:
为原料生产尿素[CO(NH2)2],该反应分为二步进行:第一步:
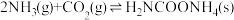
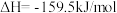
第二步:

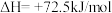
写出上述合成尿素的热化学方程式
(3)合成乙酸:中国科学家首次以
 、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
、CO2和H2为原料高效合成乙酸,其反应路径如图所示:
①原料中的
 可通过电解法由
可通过电解法由 制取,用稀硫酸作电解质溶液,写出生成
制取,用稀硫酸作电解质溶液,写出生成 的电极反应式:
的电极反应式:②
您最近半年使用:0次
2024-04-04更新
|
325次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
解题方法
8 . Ⅰ.MnS纳米粒子被广泛应用于除去重金属离子中的铬离子。
(1)锰的价层电子排布式为______ 。
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-______ S2-(填“>”“<”或“=”)。H3O+中H—O—H的键角比H2O中的______ (填“大”或“小”)
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为______ ,Mn与CO的C原子形成配位键,该配合物的配位数为______ ,配体NH3的空间结构为______ (用文字描述)。
Ⅱ.
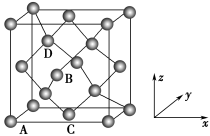
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为______ 。

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为______ 。已知金刚石的晶胞参数为apm,则其密度为______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除铬效率不如MnS纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
Ⅱ.
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(5)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近半年使用:0次
解题方法
9 . 最近我国科研人员成功攻克了5G通信芯片制造中关键材料氮化镓(GaN)的研制难题。已知元素镓(Ga)与Al、N与As分别是同主族的元素,请回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]______ 。
(2)根据元素周期律,元素的电负性Ga______ (填“大于”或“小于”,下同)As;
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与______ 个氮原子相连,氮化铝晶体属于______ 晶体。
(4)NH3是氮的氢化物,中心原子的杂化方式是______ ,NH3的沸点比AsH3高的原因是______ 。
(5)共价晶体GaAs的晶胞参数y=xpm,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为______ ;紧邻的As原子之间的距离为a,紧邻的As、Ga原子之间的距离为b,则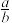 =
=______ 。该晶胞的密度为______ g·cm-3(阿伏伽德罗常数用NA表示)。
(1)基态Ga原子的核外电子排布式为[Ar]
(2)根据元素周期律,元素的电负性Ga
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(4)NH3是氮的氢化物,中心原子的杂化方式是
(5)共价晶体GaAs的晶胞参数y=xpm,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
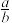 =
=
您最近半年使用:0次
解题方法
10 . 钛及其化合物具有优异的物理、化学性能,相关的研究备受关注。
回答下列问题:
(1)基态钛原子的价电子排布式为______ 。
(2)钛元素的检验方法如图:
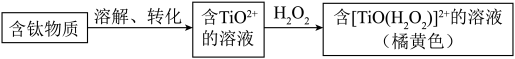
TiO2+可与H2O2形成稳定的配离子[TiO(H2O2)]2+,其原因是______ 。
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的 转化为
转化为 ;将甲基橙、亚甲基蓝、HCHO转化为CO2等。
;将甲基橙、亚甲基蓝、HCHO转化为CO2等。
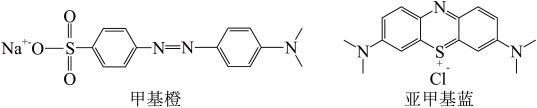
① 的空间构型为
的空间构型为______ 。
②甲基橙、亚甲基蓝中S原子的杂化类型分别为______ 、______ 。
③常温下,1 L水中大约可溶解CO2、HCHO的体积分别为1 L、480 L,其主要原因是______ 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:
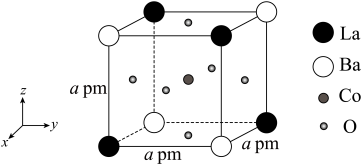
①晶体中与La距离最近的Ba的数目为______ 。
②该晶体的一个完整晶胞中含有______ 个Co原子。
③该晶胞的化学式为______
回答下列问题:
(1)基态钛原子的价电子排布式为
(2)钛元素的检验方法如图:

TiO2+可与H2O2形成稳定的配离子[TiO(H2O2)]2+,其原因是
(3)二氧化钛是良好的光催化剂,可催化转化多种有毒物质,如:可将水中的
 转化为
转化为 ;将甲基橙、亚甲基蓝、HCHO转化为CO2等。
;将甲基橙、亚甲基蓝、HCHO转化为CO2等。
①
 的空间构型为
的空间构型为②甲基橙、亚甲基蓝中S原子的杂化类型分别为
③常温下,1 L水中大约可溶解CO2、HCHO的体积分别为1 L、480 L,其主要原因是
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①晶体中与La距离最近的Ba的数目为
②该晶体的一个完整晶胞中含有
③该晶胞的化学式为
您最近半年使用:0次



