名校
解题方法
1 . 回答下列问题:
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为___________ 。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是___________ 、___________ 。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。已知该晶胞的密度为 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___________ cm。(用含p、NA的计算式表示)___________ 。
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
您最近一年使用:0次
名校
解题方法
2 . 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)基态钛原子的电子排布式为___________
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为___________ (用元素符号表示);SO 的空间构型为
的空间构型为___________ ,其中S原子的杂化方式为___________ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是___________ (选填字母序号)。
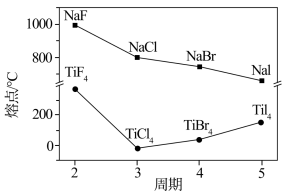
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
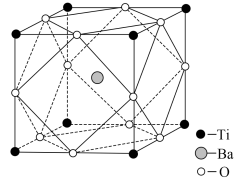
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为___________ ;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是___________ ;其晶胞参数约为a pm,钛酸钡晶体的密度ρ=___________ g·cm-3(阿伏加德罗常数的值为NA,1pm=1×10-12m)
(1)基态钛原子的电子排布式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为
 的空间构型为
的空间构型为(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是

a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为

您最近一年使用:0次
2023-12-28更新
|
217次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
3 . 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图所示。下列说法不正确 的是
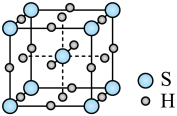

| A.该晶体属于分子晶体 |
| B.S位于元素周期表p区 |
C.该物质的化学式为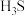 |
| D.与S等距且最近的H的个数为6 |
您最近一年使用:0次
2023-12-14更新
|
212次组卷
|
4卷引用:北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题
北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题(已下线)T9-物质结构与性质(已下线)选择题11-15
名校
解题方法
4 . 完成下列问题
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式___________ ;H、B、N中,原子半径最大的是___________ 。
② 分子中
分子中___________ (填“存在”或“不存在”)配位键。
③氨硼烷在一定条件下和水发生如下反应: ,
,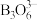 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由___________ 变为___________ ;反应涉及的N、B、O三种元素的第一电离能从大到小的顺序为___________ 。
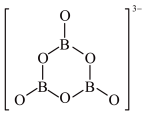
(2) 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
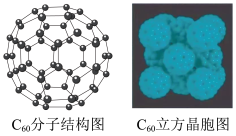
① 晶体属于
晶体属于___________ 晶体,每个 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为___________ 个;
②凸多面体中有欧拉定理:顶点+面-棱边=2,则 分子中的五边形数目为
分子中的五边形数目为___________ ,六边形的数目为___________ ;
(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为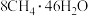 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,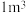 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下___________ 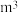 甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式
②
 分子中
分子中③氨硼烷在一定条件下和水发生如下反应:
 ,
,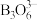 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由
(2)
 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
①
 晶体属于
晶体属于 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为②凸多面体中有欧拉定理:顶点+面-棱边=2,则
 分子中的五边形数目为
分子中的五边形数目为(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为
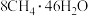 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,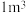 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下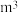 甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
您最近一年使用:0次
名校
解题方法
5 . Ti和P的化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)Ti的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是___________ 。(已知:电负性:Ti 1.5;F 4.0;Cl 3.0;Br 2.8;I 2.5)
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
② 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为___________ 。 的配位数是
的配位数是___________ 。 、
、 和有机碱离子
和有机碱离子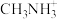 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中___________ 的空间位置相同。 的立体结构为
的立体结构为___________ 。
②磷酸通过分子间脱水缩合形成多磷酸,如:___________ 。
(1)Ti的四卤化物熔点如下表所示,
 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是| 化合物 |  |  | 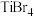 |  |
| 熔点/℃ | 377 | 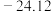 | 38.3 | 155 |
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为 的配位数是
的配位数是
 、
、 和有机碱离子
和有机碱离子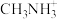 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中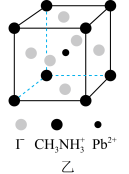
 的立体结构为
的立体结构为②磷酸通过分子间脱水缩合形成多磷酸,如:
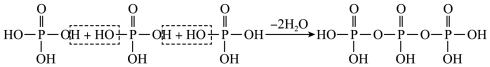
您最近一年使用:0次
名校
解题方法
6 . 硅是地壳中含量第二大的元素。其单质除了用作重要的半导体材料外,还用于测定阿伏加德罗常数的精确值。
(1)基态Si原子的价层电子排布式是____ 。
(2)自然界中的硅元素绝大多数是以SiO2或硅酸盐的形式存在的,其中都含有“硅氧四面体”结构单元(如图)。
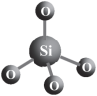
①SiO2晶体中,每个O链接____ 个Si。
②SiO2晶体中,Si原子的杂化类型是____ 。
③硅的提纯过程中需用到硅的气态化合物。推测下列化合物中沸点不超过200℃的是____ (填序号)。
a.SiH4 b.SiC c.SiCl4
(3)单晶硅的晶胞为正方体,与金刚石的晶胞相似,如图所示。
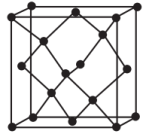
①单晶硅的晶体类型是_____ 。
②已知:金刚石中C-C键能:607kJ·mol-1,单晶硅中Si-Si键能:327kJ·mol-1。能否据此比较金刚石和单晶硅的熔点?若能,比较熔点高低。若不能,说明理由。___ 。
③精确的阿伏加德罗常数是以高纯的单晶28Si为样品通过X射线衍射法测定的。测得相同条件下样品的密度为ρg•cm-3,晶胞边长为apm(1pm=10-10cm),则阿伏加德罗常数的表达式NA=____ mol-1。
(1)基态Si原子的价层电子排布式是
(2)自然界中的硅元素绝大多数是以SiO2或硅酸盐的形式存在的,其中都含有“硅氧四面体”结构单元(如图)。

①SiO2晶体中,每个O链接
②SiO2晶体中,Si原子的杂化类型是
③硅的提纯过程中需用到硅的气态化合物。推测下列化合物中沸点不超过200℃的是
a.SiH4 b.SiC c.SiCl4
(3)单晶硅的晶胞为正方体,与金刚石的晶胞相似,如图所示。

①单晶硅的晶体类型是
②已知:金刚石中C-C键能:607kJ·mol-1,单晶硅中Si-Si键能:327kJ·mol-1。能否据此比较金刚石和单晶硅的熔点?若能,比较熔点高低。若不能,说明理由。
③精确的阿伏加德罗常数是以高纯的单晶28Si为样品通过X射线衍射法测定的。测得相同条件下样品的密度为ρg•cm-3,晶胞边长为apm(1pm=10-10cm),则阿伏加德罗常数的表达式NA=
您最近一年使用:0次
2022-09-09更新
|
307次组卷
|
3卷引用:北京市2022-2023学年高三上学期入学定位考试化学试题
7 . 钠的一种氧化物的正方体晶胞如图所示(“●”或“○”均表示一个简单离子)。下列说法正确的是
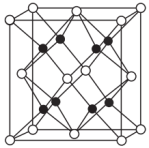

| A.该氧化物的化学式为Na2O2 |
| B.晶胞中连接“○”与“●”的线段表示共价键 |
| C.晶胞中与“○”最近且等距的“●”的数目为4 |
| D.该晶体中“○”与“●”的核外电子排布相同 |
您最近一年使用:0次
8 . W、X、Y、Z为短周期主族元素,原子序数依次增大。W、X、Y、Z的价电子数之和为10,Z的最外层电子数为其K层的一半,W与Y可形成个数比为2:1的18e-分子。
(1)下列有关叙述正确的是_______ 。
a.ZXW4中含有离子键、配位键和共价键
b.Y的最高化合价氧化物的水化物为弱酸
c.X的氟化物XF3中原子均为8电子稳定结构
(2)①基态Z原子的电子排布式为_______ 。
②基态Z原子电子占据最高能级的电子云为_______ 形。
(3)①W、X、Y中,原子半径最大的是_______ 。(填元素符号,下同)。
②根据对角线规则,X的一些化学性质与元素_______ 的相似。
③在XF3分子中F-X-F的键角是_______ 。
④XF3和过量NaF作用可生成NaXF4, 的立体构型为
的立体构型为_______ 。
⑤路易斯酸碱理论认为,任何可接受电子对的分子或离子叫做路易斯酸,任何可给出电子对的分子或离子叫做路易斯碱。从结构角度分析XF3是路易斯酸的原因:_______ 。
(4)YH3XH3分子中,①Y-X化学键称为_______ 键。
②YH3XH3中X原子的杂化轨道类型为_______ 。
③从原子结构角度解释Y的非金属性强于X的原因:_______ 。
(5)YH3XH3分子中,与Y原子相连的H呈正电性( ),与X原子相连的H呈负电性(
),与X原子相连的H呈负电性(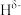 )。
)。
①与YH3XH3原子总数相等的等电子体是_______ (写分子式)。
②该等电子的熔点比YH3XH3的低,其原因是_______ ,也称为二氢键。
(6)研究发现,YH3XH3在低温高条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,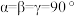 ,YH3XH3的2×2×2超晶胞结构如图所示。
,YH3XH3的2×2×2超晶胞结构如图所示。

YH3XH3晶体的密度ρ=_______ g/cm3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)下列有关叙述正确的是
a.ZXW4中含有离子键、配位键和共价键
b.Y的最高化合价氧化物的水化物为弱酸
c.X的氟化物XF3中原子均为8电子稳定结构
(2)①基态Z原子的电子排布式为
②基态Z原子电子占据最高能级的电子云为
(3)①W、X、Y中,原子半径最大的是
②根据对角线规则,X的一些化学性质与元素
③在XF3分子中F-X-F的键角是
④XF3和过量NaF作用可生成NaXF4,
 的立体构型为
的立体构型为⑤路易斯酸碱理论认为,任何可接受电子对的分子或离子叫做路易斯酸,任何可给出电子对的分子或离子叫做路易斯碱。从结构角度分析XF3是路易斯酸的原因:
(4)YH3XH3分子中,①Y-X化学键称为
②YH3XH3中X原子的杂化轨道类型为
③从原子结构角度解释Y的非金属性强于X的原因:
(5)YH3XH3分子中,与Y原子相连的H呈正电性(
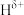 ),与X原子相连的H呈负电性(
),与X原子相连的H呈负电性(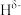 )。
)。①与YH3XH3原子总数相等的等电子体是
②该等电子的熔点比YH3XH3的低,其原因是
(6)研究发现,YH3XH3在低温高条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,
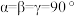 ,YH3XH3的2×2×2超晶胞结构如图所示。
,YH3XH3的2×2×2超晶胞结构如图所示。
YH3XH3晶体的密度ρ=
您最近一年使用:0次
名校
解题方法
9 . 铁的多种化合物均为磁性材料,氮化铁(FexNy)是其中一种,某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe在元素周期表中的位置______ 。
(2)丙酮(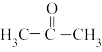 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是______ ,1mol丙酮分子中含有σ键的数目为______ mol。
(3)乙醇的晶体类型为______ ,乙醇分子中C、O、H三种元素中电负性最大的元素是______ 。
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是______ 。
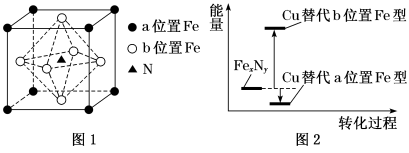
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x−n)CunNy。由FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为______ 。基态Cu原子的价电子轨道表示式为______ 。
(1)Fe在元素周期表中的位置
(2)丙酮(
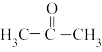 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)乙醇的晶体类型为
(4)乙醇的沸点(78.3℃)高于丙酮的沸点(56.5℃),原因是
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x−n)CunNy。由FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为

您最近一年使用:0次
2022-01-18更新
|
496次组卷
|
3卷引用:北京市第一七一中学2021-2022学年高三下学期开学考试化学试卷
名校
10 . 金属K和C60能够发生反应产生一系列金属球碳盐KxC60,部分金属球碳盐具有超导性,是球碳族化合物的研究热点之一、
(1)K中含有的化学键是___________ 键。
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于___________ 晶体,每个C60分子周围等距离且紧邻的C60有___________ 个。

(3)某种KxC60的晶胞结构如图所示。 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。

① KxC60中x=___________ 。
② 该晶胞立方体的边长为a cm,NA为阿伏加德罗常数的值,KxC60的摩尔质量为M g/mol,则晶体的密度为___________ g/cm3。
③ KxC60的熔点高于C60,原因是___________ 。
(1)K中含有的化学键是
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于

(3)某种KxC60的晶胞结构如图所示。
 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
① KxC60中x=
② 该晶胞立方体的边长为a cm,NA为阿伏加德罗常数的值,KxC60的摩尔质量为M g/mol,则晶体的密度为
③ KxC60的熔点高于C60,原因是
您最近一年使用:0次
2021-07-11更新
|
584次组卷
|
7卷引用:北京市通州区潞河中学2021-2022学年高三下学期开学考试化学试卷



