1 . I.硅、锗(32Ge,熔点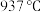 )和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
(1)硅在元素周期表中的位置是_______ 。
(2)硅和锗与氯元素都能形成氯化物RCl4(R代表Si和Ge)从原子结构角度解释原因
(3)镓(31Ga)是化学史上第一种先经过理论预言,后在自然界中被发现并验证的元素。基态Ga原子中,核外电子占据的最高能层的符号是______ 。
Ⅱ.氮化硼(BN)是-种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法如下:

已知:1.电负性:H 2.1 B 2.0 N 3.0 O 3.5
2.SiC与BN晶体的熔点和硬度数据如下:
(4)NaBH4被认为是有机化学上的“万能还原剂”。从化合价角度分析NaBH4具有强还原性的原因:______ 。
(5)硼酸的化学式为B(OH)3是一元弱酸。
硼酸产生H+过程为: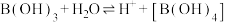
①硼酸分子的空间构型为______ 。
②硼酸具有弱酸性是由于B与水中的OH-形成配位键,描述配位键的形成过程______ 。
(6)某一种氮化硼晶体的晶胞结构如下图:
①B原子的轨道杂化类型为______ 。
②该种氮化硼的熔点和硬度均高于SiC的原因是:______ 。
③已知该晶体的密度为 ,阿伏伽德罗常数为NA,则晶胞的边长为
,阿伏伽德罗常数为NA,则晶胞的边长为______ cm(列计算式)。
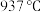 )和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。
)和镓(32Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。锗与硅是同主族元素。(1)硅在元素周期表中的位置是
(2)硅和锗与氯元素都能形成氯化物RCl4(R代表Si和Ge)从原子结构角度解释原因
(3)镓(31Ga)是化学史上第一种先经过理论预言,后在自然界中被发现并验证的元素。基态Ga原子中,核外电子占据的最高能层的符号是
Ⅱ.氮化硼(BN)是-种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法如下:

已知:1.电负性:H 2.1 B 2.0 N 3.0 O 3.5
2.SiC与BN晶体的熔点和硬度数据如下:
物质 | 熔点/ | 硬度 |
碳化硅(SiC) | 2830 | 9-9.5 |
氮化棚(BN) | 3000 | 9.5 |
(5)硼酸的化学式为B(OH)3是一元弱酸。
硼酸产生H+过程为:
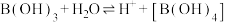
①硼酸分子的空间构型为
②硼酸具有弱酸性是由于B与水中的OH-形成配位键,描述配位键的形成过程
(6)某一种氮化硼晶体的晶胞结构如下图:
①B原子的轨道杂化类型为
②该种氮化硼的熔点和硬度均高于SiC的原因是:
③已知该晶体的密度为
 ,阿伏伽德罗常数为NA,则晶胞的边长为
,阿伏伽德罗常数为NA,则晶胞的边长为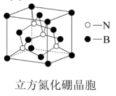
您最近一年使用:0次
名校
2 . 随着科学的发展,氟及其化合物的用途日益广泛。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。 是制备此离子液体的原料。
是制备此离子液体的原料。
(1)微粒中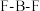 键角:
键角:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2) 可以与
可以与 反应生成
反应生成 的原因是
的原因是___________ 。
Ⅱ.氟化镁钾( )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。 晶体中,每个
晶体中,每个 周围有
周围有___________ 个距离最近的F。
(4) 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
①基态 价电子的轨道表示式为
价电子的轨道表示式为___________ 。
②某实验室合成新型催化剂材料 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为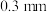 、面积为
、面积为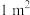 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为___________  (
(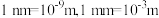 ,阿伏加德罗常数约为
,阿伏加德罗常数约为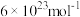 )。
)。
(5)我国科研工作者以 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
的结构简式如下: 中N原子的杂化方式为
中N原子的杂化方式为___________ , 中心N原子的杂化方式为
中心N原子的杂化方式为___________ 。
② 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着___________ ,上述相互作用不会随 的转动改变。
的转动改变。
I.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如图。
 是制备此离子液体的原料。
是制备此离子液体的原料。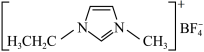
(1)微粒中
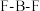 键角:
键角:
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)
 可以与
可以与 反应生成
反应生成 的原因是
的原因是Ⅱ.氟化镁钾(
 )是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。
)是一种具有优良光学性能的材料,其晶胞结构如下。以该晶胞结构为基础,将相似离子取代或部分取代,可合成多种新型材料。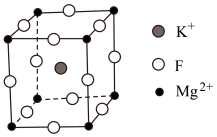
 晶体中,每个
晶体中,每个 周围有
周围有(4)
 半径与
半径与 接近,将
接近,将 部分由
部分由 取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。
取代,可以带来电荷不平衡性和反应活性。从而合成新型催化剂材料。①基态
 价电子的轨道表示式为
价电子的轨道表示式为②某实验室合成新型催化剂材料
 (
( 是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为
是平衡电荷引入的填隙阴离子,不破坏原有晶胞结构)。已知晶胞棱长为 。若要合成厚度为
。若要合成厚度为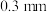 、面积为
、面积为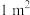 的催化剂材料,理论上需要掺杂的
的催化剂材料,理论上需要掺杂的 约为
约为 (
(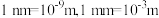 ,阿伏加德罗常数约为
,阿伏加德罗常数约为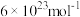 )。
)。(5)我国科研工作者以
 晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的
晶体结构为框架,依据“体积匹配原则”合成了具有独特电学性能的 晶体。其框架中的
晶体。其框架中的 由
由 取代,
取代, 位置嵌入有机阳离子
位置嵌入有机阳离子 ,
, 位置沿棱方向嵌入直线型
位置沿棱方向嵌入直线型 。已知
。已知 与
与 的结构简式如下:
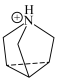
的结构简式如下: :
:
 :
: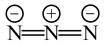
 中N原子的杂化方式为
中N原子的杂化方式为 中心N原子的杂化方式为
中心N原子的杂化方式为②
 的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的
的转动不会影响晶体骨架,这是因为除离子键外,该晶体中微粒间还存在着其他相互作用。如邻近的 与
与 还存在着
还存在着 的转动改变。
的转动改变。
您最近一年使用:0次
名校
解题方法
3 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料领域具有重要应用。一种具有聚集诱导发光效应的含Se分子(Ⅳ)合成路线如下:
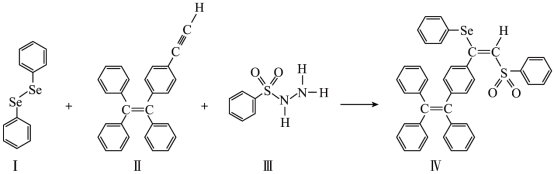
(1)Se与S同族,基态硒原子价电子排布式为__________ 。
(2) 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:__________ 。
(3)关于Ⅰ~Ⅳ四种物质中,下列说法正确的有__________ 。
a.Ⅰ中仅有 键,其中的Se—Se键为非极性键
键,其中的Se—Se键为非极性键
b.Ⅱ易溶于水,其分子式为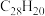
c.Ⅲ、Ⅳ中C均为 杂化,S均为
杂化,S均为 杂化
杂化
d.Ⅰ~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有__________ 。
(5)推测硒的两种含氧酸的酸性强弱为
______  (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠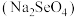 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为__________ 。
(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
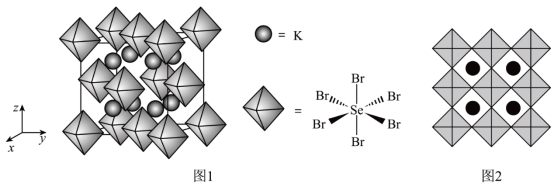
①X的化学式为__________ 。
②设X的最简式的式量为Mr,晶体密度为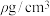 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为__________ nm(列出计算式, 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,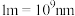 )。
)。

(1)Se与S同族,基态硒原子价电子排布式为
(2)
 的沸点低于
的沸点低于 ,根据结构解释其原因:
,根据结构解释其原因:(3)关于Ⅰ~Ⅳ四种物质中,下列说法正确的有
a.Ⅰ中仅有
 键,其中的Se—Se键为非极性键
键,其中的Se—Se键为非极性键b.Ⅱ易溶于水,其分子式为
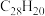
c.Ⅲ、Ⅳ中C均为
 杂化,S均为
杂化,S均为 杂化
杂化d.Ⅰ~Ⅳ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)推测硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂适量硒酸钠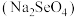 可减轻重金属铊引起的中毒。
可减轻重金属铊引起的中毒。 的空间结构为
的空间结构为(6)我国科学家发展了一种理论计算方法,可利用晶体衍射实验获得的结构数据预测其热电性能。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为Mr,晶体密度为
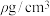 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,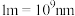 )。
)。
您最近一年使用:0次
名校
解题方法
4 . 青蒿素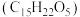 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
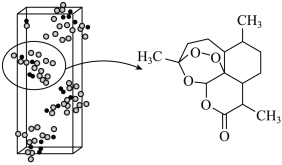
(1)提取青蒿素:在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚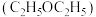 提取,效果更好。
提取,效果更好。
①乙醚沸点低于乙醇,原因是___________ 。
②用乙醚提取效果更好,原因是___________ 。
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中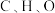 的原子核附近电子云密度大小:
的原子核附近电子云密度大小:___________ 。
②图中晶胞的棱长分别为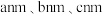 ,晶体的密度为
,晶体的密度为___________  。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数; ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是___________ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
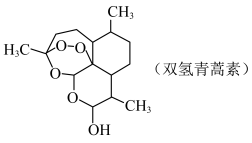
①双氢青蒿素分子中碳原子的杂化方式为___________ 。
② 的空间结构为
的空间结构为___________ ,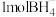 中有
中有___________  配位键。
配位键。
③比较水溶性:双氢青蒿素___________ (填“ ”)青蒿素。
”)青蒿素。
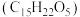 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素:在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚
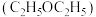 提取,效果更好。
提取,效果更好。①乙醚沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中
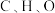 的原子核附近电子云密度大小:
的原子核附近电子云密度大小:②图中晶胞的棱长分别为
 ,晶体的密度为
,晶体的密度为 。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数; ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
①双氢青蒿素分子中碳原子的杂化方式为
②
 的空间结构为
的空间结构为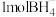 中有
中有 配位键。
配位键。③比较水溶性:双氢青蒿素
 ”)青蒿素。
”)青蒿素。
您最近一年使用:0次
名校
解题方法
5 . 三磷酸腺苷 和活性氧类(如
和活性氧类(如 和
和 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1) 分子式为
分子式为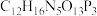 ,其中电负性最大的元素是
,其中电负性最大的元素是___________ ,基态 原子的电子排布式为
原子的电子排布式为___________ 。
(2) 分子的氧原子的杂化轨道类型为:
分子的氧原子的杂化轨道类型为:___________ ; 和
和 能以任意比例互溶的原因是
能以任意比例互溶的原因是___________ 。
(3)根据表中数据判断氧原子之间的共价键最稳定的微粒是___________ 。
(4)研究发现纳米 可催化
可催化 分解,
分解, 晶胞结构如图所示。
晶胞结构如图所示。

①阿伏加德罗常数的值为 摩尔质量为
摩尔质量为 ,晶体密度为
,晶体密度为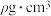 ,其晶胞边长a=
,其晶胞边长a=___________ nm。
②纳米 中位于晶粒表面的
中位于晶粒表面的 能发挥催化作用,在边长为
能发挥催化作用,在边长为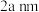 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有___________ 个。
 和活性氧类(如
和活性氧类(如 和
和 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)
 分子式为
分子式为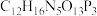 ,其中电负性最大的元素是
,其中电负性最大的元素是 原子的电子排布式为
原子的电子排布式为(2)
 分子的氧原子的杂化轨道类型为:
分子的氧原子的杂化轨道类型为: 和
和 能以任意比例互溶的原因是
能以任意比例互溶的原因是(3)根据表中数据判断氧原子之间的共价键最稳定的微粒是
| 粒子 |  |  |  |
键长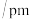 | 121 | 126 | 128 |
(4)研究发现纳米
 可催化
可催化 分解,
分解, 晶胞结构如图所示。
晶胞结构如图所示。
①阿伏加德罗常数的值为
 摩尔质量为
摩尔质量为 ,晶体密度为
,晶体密度为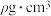 ,其晶胞边长a=
,其晶胞边长a=②纳米
 中位于晶粒表面的
中位于晶粒表面的 能发挥催化作用,在边长为
能发挥催化作用,在边长为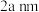 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有
您最近一年使用:0次
名校
解题方法
6 . 已知 的晶胞结构示意图如图所示,下列说法不正确的是
的晶胞结构示意图如图所示,下列说法不正确的是
 的晶胞结构示意图如图所示,下列说法不正确的是
的晶胞结构示意图如图所示,下列说法不正确的是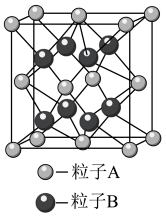
A.图中粒子A代表 |
B.每个晶胞中有4个 |
C.每个晶胞中所含的 和 和 数目比为1:2 数目比为1:2 |
D.晶胞中 的配位数(与 的配位数(与 等距且最近的 等距且最近的 数)是4 数)是4 |
您最近一年使用:0次
2024-03-04更新
|
762次组卷
|
3卷引用:北京市十一学校2023-2024学年高一下学期开学考化学试题
名校
解题方法
7 . 硅烷 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下:
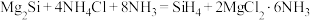
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)O、N、H的电负性由大到小的顺序是___________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是___________ (填序号)。
a. b.
b.  c.
c.
(4)① 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
② 中H—Si—H的键角
中H—Si—H的键角___________  中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(5) 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是___________ 。

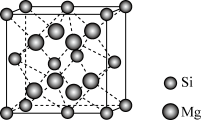
(6) 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________ 个紧邻的Mg原子。已知 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下: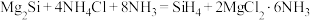
(1)硅在元素周期表中的位置是
(2)O、N、H的电负性由大到小的顺序是
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是
a.
 b.
b.  c.
c.
(4)①
 的沸点比
的沸点比 的
的②
 中H—Si—H的键角
中H—Si—H的键角 中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是(5)
 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
(6)
 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
8 . 钙钛矿(通式为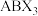 )是一类与钛酸钙
)是一类与钛酸钙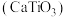 具有相似晶体结构的新型材料。
具有相似晶体结构的新型材料。
(1) 的晶胞形状为立方体,如右图所示。
的晶胞形状为立方体,如右图所示。______ 。
②该晶胞中,每个Ca周围与它最近且相等距离的O有______ 个。
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于______ 位置。
(2)有机-无机杂化钙钛矿材料具有良好的光致发光、半导体性能,其中 的合成过程如下:
的合成过程如下:______ 。
②阿伏加德罗常数为 ,该晶体的密度为
,该晶体的密度为______  。(
。(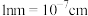 )
)
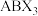 )是一类与钛酸钙
)是一类与钛酸钙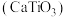 具有相似晶体结构的新型材料。
具有相似晶体结构的新型材料。(1)
 的晶胞形状为立方体,如右图所示。
的晶胞形状为立方体,如右图所示。
②该晶胞中,每个Ca周围与它最近且相等距离的O有
③该晶胞结构的另一种表示中,Ti处于各顶角位置,则O处于
(2)有机-无机杂化钙钛矿材料具有良好的光致发光、半导体性能,其中
 的合成过程如下:
的合成过程如下:HCl+ +CdCl2
+CdCl2

① 中存在配位键,接受孤电子对的中心离子或原子是
中存在配位键,接受孤电子对的中心离子或原子是
②比较 和
和 中C-N-C键角的大小并解释原因
中C-N-C键角的大小并解释原因
③ 具有较低的熔点。从结构角度解释原因
具有较低的熔点。从结构角度解释原因

②阿伏加德罗常数为
 ,该晶体的密度为
,该晶体的密度为 。(
。(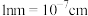 )
)
您最近一年使用:0次
2024-02-29更新
|
196次组卷
|
4卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
9 . 随着科学的发展,氟及其化合物的用途日益广泛。
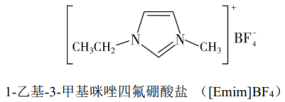
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
(1)基态N原子的价层电子轨道表示式为_______ 。
(2)①N、F、P三种元素的电负性由大到小的顺序为_______ 。
②根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为_______ 形。
(3) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中F—B—F键角:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是_______ 。
(4)以 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为_______ ,电解质溶液中 向
向_______ (填“阴”或“阳”)极移动。
Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm 。
。

(5)与 距离最近且相等的
距离最近且相等的 有
有_______ 个。
(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

(1)基态N原子的价层电子轨道表示式为
(2)①N、F、P三种元素的电负性由大到小的顺序为
②根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中F—B—F键角:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是(4)以
 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm
 。
。
(5)与
 距离最近且相等的
距离最近且相等的 有
有(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为
 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
10 . 过氧化钙晶体的晶胞结构如下图所示,已知该晶胞的密度是ρg·cm−3(NA表示阿伏伽德罗常数)。下列表述不正确 的是


| A.基态Ca2+的电子排布式:1s22s22p63s23p6 |
B.过氧化钙电子式: |
C.晶体中Ca2+紧邻6个O |
D.晶胞结构中最近的两个Ca2+间的距离为: nm nm |
您最近一年使用:0次




