解题方法
1 . [FeF6]3-与许多金属离子或NH 形成的化合物有广泛的用途。
形成的化合物有广泛的用途。
(1)基态Fe原子的价层电子轨道表示式为___________ 。
(2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密的K3[FeF6]膜以进行防腐,该转化液是含KF、HNO3、(NH4)2S2O8(或H2O2)等物质的溶液(pH≈2)。S2O 的结构如下:
的结构如下:
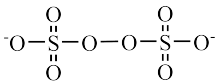
①比较O原子和S原子的第一电离能大小,从原子结构的角度说明理由:__________ 。
②下列说法正确的是___________ (填字母)。
a.(NH4)2S2O8能将Fe2+氧化为Fe3+的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7价
c.S2O 中“S-O-O”在一条直线上
中“S-O-O”在一条直线上
③转化液pH过小时,不易得到K3[FeF6],原因是___________ 。
(3)[FeF6]3-与NH 形成的化合物可以作为锂离子电池的电极材料。
形成的化合物可以作为锂离子电池的电极材料。
①化合物(NH4)3[FeF6]中的化学键类型有___________ (填字母)。
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
②(NH4)3[FeF6]的晶胞形状为立方体,边长为anm,结构如下图所示:
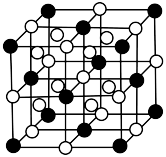
图中“ ”代表的是
”代表的是___________ (填“NH ”或“[FeF6]3-”)。已知(NH4)3[FeF6]的摩尔质量是Mg·mol-1,阿伏加德罗常数为NA,该晶体的密度为
”或“[FeF6]3-”)。已知(NH4)3[FeF6]的摩尔质量是Mg·mol-1,阿伏加德罗常数为NA,该晶体的密度为___________ g·cm-3(1nm=10-7cm)。
 形成的化合物有广泛的用途。
形成的化合物有广泛的用途。(1)基态Fe原子的价层电子轨道表示式为
(2)钢铁表面成膜技术是钢铁防腐的重要方法。工业上利用某种转化液使钢铁表面形成致密的K3[FeF6]膜以进行防腐,该转化液是含KF、HNO3、(NH4)2S2O8(或H2O2)等物质的溶液(pH≈2)。S2O
 的结构如下:
的结构如下:
①比较O原子和S原子的第一电离能大小,从原子结构的角度说明理由:
②下列说法正确的是
a.(NH4)2S2O8能将Fe2+氧化为Fe3+的可能原因是含有“-O-O-”结构
b.依据结构分析,(NH4)2S2O8中硫元素的化合价为+7价
c.S2O
 中“S-O-O”在一条直线上
中“S-O-O”在一条直线上③转化液pH过小时,不易得到K3[FeF6],原因是
(3)[FeF6]3-与NH
 形成的化合物可以作为锂离子电池的电极材料。
形成的化合物可以作为锂离子电池的电极材料。①化合物(NH4)3[FeF6]中的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键 d.金属键 e.配位键
②(NH4)3[FeF6]的晶胞形状为立方体,边长为anm,结构如下图所示:

图中“
 ”代表的是
”代表的是 ”或“[FeF6]3-”)。已知(NH4)3[FeF6]的摩尔质量是Mg·mol-1,阿伏加德罗常数为NA,该晶体的密度为
”或“[FeF6]3-”)。已知(NH4)3[FeF6]的摩尔质量是Mg·mol-1,阿伏加德罗常数为NA,该晶体的密度为
您最近一年使用:0次
名校
解题方法
2 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为___________ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下: ,加入
,加入 的目的是
的目的是___________ 。
(3) 的电子式为
的电子式为___________ 。在25℃和101kPa时,Na与 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式:___________ 。 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式___________ 。若有1mol 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为___________ mol。
(4)采用空气和Na为原料可直接制备 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d. 溶液
溶液
(5)向酸性KMnO4溶液中加入 粉末,观察到溶液褪色,发生如下反应: ______MnO
粉末,观察到溶液褪色,发生如下反应: ______MnO +_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:
+_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:___________ ,该反应说明 具有
具有___________ 性(选填“氧化”,“还原”或“漂白”)。
(6)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为___________ 。

(7)天然碱的主要成分为 ,1mol
,1mol 经充分加热得到
经充分加热得到 的质量为
的质量为___________ g。
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:
 ,加入
,加入 的目的是
的目的是(3)
 的电子式为
的电子式为 反应生成1mol
反应生成1mol 放热510.9kJ,写出该反应的热化学方程式:
放热510.9kJ,写出该反应的热化学方程式: 可作供氧剂,写出
可作供氧剂,写出 与CO2反应的化学方程式
与CO2反应的化学方程式 参加反应则转移电子的物质的量为
参加反应则转移电子的物质的量为(4)采用空气和Na为原料可直接制备
 。空气与熔融金属Na反应前需依次通过
。空气与熔融金属Na反应前需依次通过a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.
 溶液
溶液(5)向酸性KMnO4溶液中加入
 粉末,观察到溶液褪色,发生如下反应: ______MnO
粉末,观察到溶液褪色,发生如下反应: ______MnO +_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式:
+_____H++_____Na2O2=_____Mn2+_____O2↑+_____H2O+_____Na+,配平该离子方程式: 具有
具有(6)钠的某氧化物晶胞如下图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

(7)天然碱的主要成分为
 ,1mol
,1mol 经充分加热得到
经充分加热得到 的质量为
的质量为
您最近一年使用:0次
3 . 硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根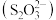 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。
(1)基态 原子价层电子排布式是
原子价层电子排布式是__________ 。
(2)比较 原子和
原子和 原子的第一电离能大小,从原子结构的角度说明理由:
原子的第一电离能大小,从原子结构的角度说明理由:____________________ 。
(3) 的空间结构是
的空间结构是__________ 。
(4)同位素示踪实验可证实 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为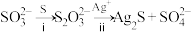 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是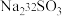 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是__________ 。
(5)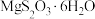 的晶胞形状为长方体,边长分别为
的晶胞形状为长方体,边长分别为 、
、 ,结构如图所示。
,结构如图所示。
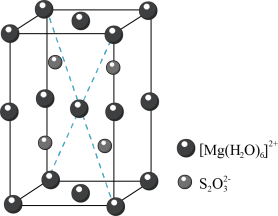
晶胞中的 个数为
个数为__________ 。已知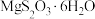 的摩尔质量是
的摩尔质量是 ,阿伏加德罗常数为
,阿伏加德罗常数为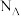 ,该晶体的密度为
,该晶体的密度为__________  。
。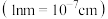
(6)浸金时, 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成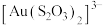 。分别判断
。分别判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:____________________ 。
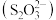 可看作是
可看作是 中的一个
中的一个 原子被
原子被 原子取代的产物。
原子取代的产物。(1)基态
 原子价层电子排布式是
原子价层电子排布式是(2)比较
 原子和
原子和 原子的第一电离能大小,从原子结构的角度说明理由:
原子的第一电离能大小,从原子结构的角度说明理由:(3)
 的空间结构是
的空间结构是(4)同位素示踪实验可证实
 中两个
中两个 原子的化学环境不同,实验过程为
原子的化学环境不同,实验过程为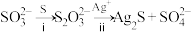 。过程ⅱ中,
。过程ⅱ中, 断裂的只有硫硫键,若过程ⅰ所用试剂是
断裂的只有硫硫键,若过程ⅰ所用试剂是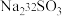 和
和 ,过程ⅱ含硫产物是
,过程ⅱ含硫产物是(5)
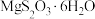 的晶胞形状为长方体,边长分别为
的晶胞形状为长方体,边长分别为 、
、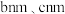 ,结构如图所示。
,结构如图所示。
晶胞中的
 个数为
个数为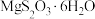 的摩尔质量是
的摩尔质量是 ,阿伏加德罗常数为
,阿伏加德罗常数为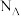 ,该晶体的密度为
,该晶体的密度为 。
。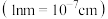
(6)浸金时,
 作为配体可提供孤电子对与
作为配体可提供孤电子对与 形成
形成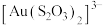 。分别判断
。分别判断 中的中心
中的中心 原子和端基
原子和端基 原子能否做配位原子并说明理由:
原子能否做配位原子并说明理由:
您最近一年使用:0次
2023-06-28更新
|
9308次组卷
|
14卷引用:2023年北京卷高考真题变式题(结构与性质)
(已下线)2023年北京卷高考真题变式题(结构与性质)(已下线)结构与性质2023年高考北京卷化学真题(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)物质结构与性质(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)北京师范大学附属中学2023-2024学年高三上学期期中考试化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题福建省龙岩市连城县第一中学2023-2024学年高三上学期8月月考化学试题河南省信阳高级中学2023-2024学年高三上学期11月一模考试化学试题四川省绵阳南山中学实验学校2023-2024学年高三(补习班)上学期11月月理科综合试题山东省潍坊市昌乐二中2023-2024学年高三上学期12月月考化学试题
名校
解题方法
4 . 重金属元素具有毒性,常用含巯基(-SH)的有机化合物作为解毒剂。例如,解毒剂化合物I与氧化汞生成化合物II。
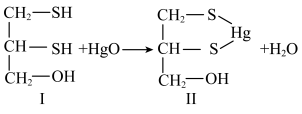
(1)汞的原子序数为80,位于元素周期表第___________ 周期第IIB族。
(2)基态硫原子价电子排布式为___________ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为___________ 。
(4)化合物III也是一种汞解毒剂。下列说法正确的是___________。

(5)理论预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
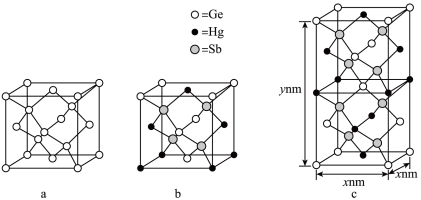
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是___________ 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为_______ ;该晶胞中粒子个数比Hg:Ge:Sb = _______ 。
③设X的最简式的式量为M,阿伏加德罗常数为NA.则X晶体的密度为______ g/cm3(列出算式)。

(1)汞的原子序数为80,位于元素周期表第
(2)基态硫原子价电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)化合物III也是一种汞解毒剂。下列说法正确的是___________。

| A.在I中,O和S原子都采取sp3杂化 |
| B.在II中S元素的电负性最大,更易与Hg结合成键 |
| C.在III中,C-C-C键角是180° |
| D.与化合物I相比,III的水溶性更好 |

①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为
③设X的最简式的式量为M,阿伏加德罗常数为NA.则X晶体的密度为
您最近一年使用:0次
名校
5 .  均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。
均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。
(1)基态 的价层电子排布式为
的价层电子排布式为_________ 。在元素周期表中,该元素属于_________ (填“s”,“p”,“d”或“ ”)区。
”)区。
(2) 在周期表中的位置为
在周期表中的位置为_________ 。
(3)S与P在周期表中是相邻元素,两者的第一电离能:S___ P(填“>”、“<”或“=”),请从电子排布的角度解释其原因_____ 。
(4)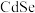 的一种晶体为闪锌矿型结构,晶胞结构如图所示。
的一种晶体为闪锌矿型结构,晶胞结构如图所示。

①晶胞中,与 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有_________ 个。
②已知,晶胞边长 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,
,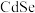 的摩尔质量为
的摩尔质量为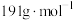 。则
。则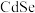 晶体的密度
晶体的密度
_________  。(列出计算式)
。(列出计算式)
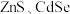 均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。
均为重要的半导体材料,可应用于生物标记和荧光显示领域,并在光电器件、生物传感和激光材料等方面也得到了广泛的应用。(1)基态
 的价层电子排布式为
的价层电子排布式为 ”)区。
”)区。(2)
 在周期表中的位置为
在周期表中的位置为(3)S与P在周期表中是相邻元素,两者的第一电离能:S
(4)
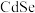 的一种晶体为闪锌矿型结构,晶胞结构如图所示。
的一种晶体为闪锌矿型结构,晶胞结构如图所示。
①晶胞中,与
 原子距离最近且相等的
原子距离最近且相等的 原子有
原子有②已知,晶胞边长
 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 ,
,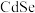 的摩尔质量为
的摩尔质量为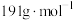 。则
。则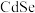 晶体的密度
晶体的密度
 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
名校
6 . 以NaOH、 和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下:
和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下: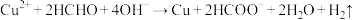
(1)基态Cu原子的价层电子排布式为___________ 。
(2)根据反应原理分析
①镀铜反应中,利用了HCHO的___________ 性。
②选择HCHO进行化学镀铜的原因之一是它易溶于水。下列分析正确的是___________ 。
a.HCHO、 均属于极性分子
均属于极性分子
b.HCHO与 之间能形成氢键
之间能形成氢键
c.在醛基的碳氧双键中,电子偏向碳原子
(3)镀液中的 、HCHO、
、HCHO、 三种微粒,空间结构为三角形的是
三种微粒,空间结构为三角形的是___________ 。
(4)为防止 与
与 形成沉淀,可加入EDTA使
形成沉淀,可加入EDTA使 形成配合物。EDTA能电离出
形成配合物。EDTA能电离出 和
和 。
。
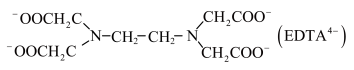
 中除部分O外,还能与
中除部分O外,还能与 配位的原子是
配位的原子是___________ 。
(5)锏—镍镀层能增强材料的耐蚀性。按照核外电子排布,把元素周期表划分为5个区,Ni位于___________ 区。
(6)聚酰亚胺具有高强度、耐紫外线、优良的热氧化稳定性等性质。某聚酰亚胺具有如下结构特征:
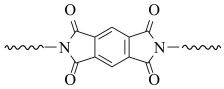
上述方法不适合在该聚酰亚胺基材上直接镀铜。原因是:
①聚酰亚胺在碱性条件下会发生水解
②___________
(7)有机化合物的合成通常使用催化剂,一种催化剂 晶体的晶胞示意图如下:
晶体的晶胞示意图如下:
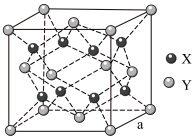
①Y原子为___________ (填元素符号)。与每个Y原子距离最近且等距的X原子有___________ 个
②晶胞边长为a nm,阿伏伽德罗常数为 ,则该晶体的密度
,则该晶体的密度
___________  (列出计算式,
(列出计算式,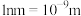 ,
, 的摩尔质量为123
的摩尔质量为123  )。
)。
 和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下:
和HCHO为主要成分的镀液可在某些材料上镀铜,原理如下: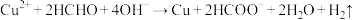
(1)基态Cu原子的价层电子排布式为
(2)根据反应原理分析
①镀铜反应中,利用了HCHO的
②选择HCHO进行化学镀铜的原因之一是它易溶于水。下列分析正确的是
a.HCHO、
 均属于极性分子
均属于极性分子b.HCHO与
 之间能形成氢键
之间能形成氢键c.在醛基的碳氧双键中,电子偏向碳原子
(3)镀液中的
 、HCHO、
、HCHO、 三种微粒,空间结构为三角形的是
三种微粒,空间结构为三角形的是(4)为防止
 与
与 形成沉淀,可加入EDTA使
形成沉淀,可加入EDTA使 形成配合物。EDTA能电离出
形成配合物。EDTA能电离出 和
和 。
。
 中除部分O外,还能与
中除部分O外,还能与 配位的原子是
配位的原子是(5)锏—镍镀层能增强材料的耐蚀性。按照核外电子排布,把元素周期表划分为5个区,Ni位于
(6)聚酰亚胺具有高强度、耐紫外线、优良的热氧化稳定性等性质。某聚酰亚胺具有如下结构特征:

上述方法不适合在该聚酰亚胺基材上直接镀铜。原因是:
①聚酰亚胺在碱性条件下会发生水解
②
(7)有机化合物的合成通常使用催化剂,一种催化剂
 晶体的晶胞示意图如下:
晶体的晶胞示意图如下:
①Y原子为
②晶胞边长为a nm,阿伏伽德罗常数为
 ,则该晶体的密度
,则该晶体的密度
 (列出计算式,
(列出计算式,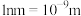 ,
, 的摩尔质量为123
的摩尔质量为123  )。
)。
您最近一年使用:0次
解题方法
7 . 短周期元素B、C、N等元素可以形成多种物质,呈现出不同的性质,请回答以下问题:
(1)B、C、N三种元素中第一电离能最大的是___________ 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是___________ 。
(3) 的结构与
的结构与 类似、但是性质差异较大。
类似、但是性质差异较大。
① 的空间结构为
的空间结构为___________ 形。N原子的轨道杂化类型为___________ 。
② 具有碱性(可与
具有碱性(可与 结合)而
结合)而 不显碱性,原因是
不显碱性,原因是___________ 。
(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。

①距离硼原子最近的氮原子有___________ 个,氮化硼晶体中含有的微粒间作用力为___________ 。
②已知:立方氮化硼晶体的摩尔质量为ag⋅mol ,密度为ρg⋅cm
,密度为ρg⋅cm ,设
,设 为阿佛加德罗常数的值,则该晶体的晶胞边长为
为阿佛加德罗常数的值,则该晶体的晶胞边长为___________ cm。
(1)B、C、N三种元素中第一电离能最大的是
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是
(3)
 的结构与
的结构与 类似、但是性质差异较大。
类似、但是性质差异较大。①
 的空间结构为
的空间结构为②
 具有碱性(可与
具有碱性(可与 结合)而
结合)而 不显碱性,原因是
不显碱性,原因是(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。

①距离硼原子最近的氮原子有
②已知:立方氮化硼晶体的摩尔质量为ag⋅mol
 ,密度为ρg⋅cm
,密度为ρg⋅cm ,设
,设 为阿佛加德罗常数的值,则该晶体的晶胞边长为
为阿佛加德罗常数的值,则该晶体的晶胞边长为
您最近一年使用:0次
名校
解题方法
8 . 砷化铟 是一种优良的半导体化合物,有广泛用途。
是一种优良的半导体化合物,有广泛用途。
(1)基态In的价层电子排布式为 ,In在周期表中的位置是
,In在周期表中的位置是______ 。
(2)在Ar保护下分别将 和
和 在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的
在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的 晶体。
晶体。
已知: 和
和 均为分子晶体
均为分子晶体
 气化室的温度为130℃,
气化室的温度为130℃, 气化室的温度为500℃
气化室的温度为500℃
①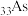 简化的电子排布式为
简化的电子排布式为______ 。
② 分子的空间结构为
分子的空间结构为______ ,中心原子As的杂化轨道类型为______ 。
③ 气化室温度低于
气化室温度低于 气化室温度的原因是
气化室温度的原因是______ 。
④ 晶体中分子间存在配位键,配位原子是
晶体中分子间存在配位键,配位原子是______ 。
(3) 为原子之间以共价键的成键方式结合而成的晶体。
为原子之间以共价键的成键方式结合而成的晶体。
其晶胞结构如图所示。

①一个晶胞中所含As的个数为______ 。
②已知该晶胞棱长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,
, 的摩尔质量为
的摩尔质量为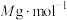 ,则该晶体的密度
,则该晶体的密度
______  。
。
 是一种优良的半导体化合物,有广泛用途。
是一种优良的半导体化合物,有广泛用途。(1)基态In的价层电子排布式为
 ,In在周期表中的位置是
,In在周期表中的位置是(2)在Ar保护下分别将
 和
和 在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的
在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的 晶体。
晶体。已知:
 和
和 均为分子晶体
均为分子晶体 气化室的温度为130℃,
气化室的温度为130℃, 气化室的温度为500℃
气化室的温度为500℃①
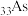 简化的电子排布式为
简化的电子排布式为②
 分子的空间结构为
分子的空间结构为③
 气化室温度低于
气化室温度低于 气化室温度的原因是
气化室温度的原因是④
 晶体中分子间存在配位键,配位原子是
晶体中分子间存在配位键,配位原子是(3)
 为原子之间以共价键的成键方式结合而成的晶体。
为原子之间以共价键的成键方式结合而成的晶体。其晶胞结构如图所示。

①一个晶胞中所含As的个数为
②已知该晶胞棱长为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,
, 的摩尔质量为
的摩尔质量为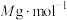 ,则该晶体的密度
,则该晶体的密度
 。
。
您最近一年使用:0次
名校
解题方法
9 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的价层电子轨道表示式为_______ 。
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:2NaCl(l)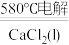 2Na(l)+Cl2(g)。加入CaCl2的目的是
2Na(l)+Cl2(g)。加入CaCl2的目的是_______ 。
(3)Na2O2的电子式为______ 。在25℃和101kPa时,Na与O2反应生成1molNa2O2放热510.9kJ,写出该反应的热化学方程式:_______ 。
(4)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过______ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
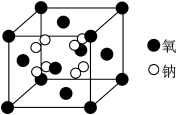
(5)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为_______ 。晶胞参数为apm,则该晶体的密度为______ g/cm3。(列计算式)
(1)基态Na原子的价层电子轨道表示式为
(2)NaCl熔点为800.8℃,工业上采用电解熔融NaCl制备金属Na。电解反应方程式如下:2NaCl(l)
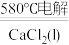 2Na(l)+Cl2(g)。加入CaCl2的目的是
2Na(l)+Cl2(g)。加入CaCl2的目的是(3)Na2O2的电子式为
(4)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(5)钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为

您最近一年使用:0次
名校
解题方法
10 .  是一种锂离子电池的正极材料,放电时生成
是一种锂离子电池的正极材料,放电时生成 。
。
(1)下列电子排布图表示的Li原子的状态中,能量最高的为___________ (填序号)。___________ 。
(3) 的制备:
的制备:
 的结构如图1所示。
的结构如图1所示。 和
和 之间的作用力类型为
之间的作用力类型为___________ 。
② 的
的 大于
大于 的
的 ,从结构角度解释原因:
,从结构角度解释原因:___________ 。
(4)锂离子电池充放电过程中,正极材料晶胞的组成变化如图2所示。 的空间构型为
的空间构型为___________ ,且磷氧键键能较大,锂离子嵌入和脱出时,磷酸铁锂的空间骨架不易发生形变,具有良好的循环稳定性。
②正极材料在 和
和 之间转化时,经过中间产物
之间转化时,经过中间产物 。
。 转化为
转化为 的过程中,每摩晶胞转移电子的物质的量为
的过程中,每摩晶胞转移电子的物质的量为___________ 摩。
 是一种锂离子电池的正极材料,放电时生成
是一种锂离子电池的正极材料,放电时生成 。
。(1)下列电子排布图表示的Li原子的状态中,能量最高的为
a. b.
b. c.
c.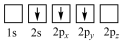
(3)
 的制备:
的制备:
 的结构如图1所示。
的结构如图1所示。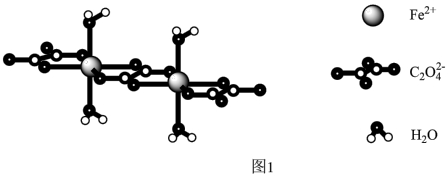
 和
和 之间的作用力类型为
之间的作用力类型为②
 的
的 大于
大于 的
的 ,从结构角度解释原因:
,从结构角度解释原因:(4)锂离子电池充放电过程中,正极材料晶胞的组成变化如图2所示。

 的空间构型为
的空间构型为②正极材料在
 和
和 之间转化时,经过中间产物
之间转化时,经过中间产物 。
。 转化为
转化为 的过程中,每摩晶胞转移电子的物质的量为
的过程中,每摩晶胞转移电子的物质的量为
您最近一年使用:0次
2023-03-30更新
|
586次组卷
|
5卷引用:专题17 结构与性质



