名校
解题方法
1 . 硒(Se)是一种非金属元素。可用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1)基态Se原子的价层电子轨道表示式为_______ 。
(2)比较键角大小:气态SeO3分子_______ SeO 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是_______ 。
(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因是_______ 。
(4)Cu2−xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。

①下列说法正确的是_______ 。
a.每个Cu2−xSe晶胞中Cu2+个数为x
b.每个Na2Se晶胞完全转化为Cu2−xSe晶胞,转移电子数为8
c.每个NaCuSe晶胞中0价Cu原子个数为1−x
d.当NayCu2−xSe转化为NaCuSe时,每转移(1−y)mol电子,产生(1−x)molCu原子
②设阿伏伽德罗常数的值为NA,Na2Se晶胞参数为anm,Na2Se晶体的密度为_______ g/cm3(用含a、NA的代数式表示,不考虑晶胞中的0价Cu原子)。
(5)电解铜的阳极泥中含有硒元素(以Se单质和Na2Se的形式存在)。称取5.000g电解铜阳极泥样品,以合适方法溶解,将硒元素转化为H2SeO3,配成250.0mL混酸溶液。移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol/LKMnO4标准溶液,将H2SeO3氧化为H2SeO4。反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液15.00mL。则电解铜阳极泥样品中Se的质量分数为_______ 。
(1)基态Se原子的价层电子轨道表示式为
(2)比较键角大小:气态SeO3分子
 离子(填“>”“<”或“=”),原因是
离子(填“>”“<”或“=”),原因是(3)人体代谢甲硒醇(CH3SeH)后可增加抗癌活性,下表中有机物沸点不同的原因是
| 有机物 | 甲醇 | 甲硫醇(CH3SH) | 甲硒醇 |
| 沸点/℃ | 64.7 | 5.95 | 25.05 |
(4)Cu2−xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。

①下列说法正确的是
a.每个Cu2−xSe晶胞中Cu2+个数为x
b.每个Na2Se晶胞完全转化为Cu2−xSe晶胞,转移电子数为8
c.每个NaCuSe晶胞中0价Cu原子个数为1−x
d.当NayCu2−xSe转化为NaCuSe时,每转移(1−y)mol电子,产生(1−x)molCu原子
②设阿伏伽德罗常数的值为NA,Na2Se晶胞参数为anm,Na2Se晶体的密度为
(5)电解铜的阳极泥中含有硒元素(以Se单质和Na2Se的形式存在)。称取5.000g电解铜阳极泥样品,以合适方法溶解,将硒元素转化为H2SeO3,配成250.0mL混酸溶液。移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol/LKMnO4标准溶液,将H2SeO3氧化为H2SeO4。反应完全后,用0.05000mol/L(NH4)2Fe(SO4)2标准溶液滴至终点,消耗(NH4)2Fe(SO4)2标准溶液15.00mL。则电解铜阳极泥样品中Se的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 卤族元素相关物质在生产、生活中应用广泛。回答下列问题:
(1)碘元素在周期表中的位置是___________ 。
(2)漂白液的有效成分是 ,工业制备漂白液的离子方程式是
,工业制备漂白液的离子方程式是___________ 。
(3)卤族元素化合物的性质有相似性和递变性,下列说法不正确 的是___________。
(4)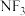 的结构与
的结构与 类似,但是性质差异较大。
类似,但是性质差异较大。
①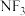 的
的 模型名称为
模型名称为___________ 。
②沸点NF3___________ NH3(填“ ”“
”“ "或“
"或“ ”),原因是
”),原因是___________ 。
③ 具有碱性(可与
具有碱性(可与 结合)而
结合)而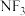 没有碱性,原因是
没有碱性,原因是___________ 。
(5)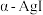 晶体,可以通过加热
晶体,可以通过加热 晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了
晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了 在晶胞中的位置,
在晶胞中的位置, 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。
构成的四面体、八面体等空隙中。


①在电场作用下, 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,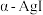 晶体在电池中可作为
晶体在电池中可作为___________ 。
② 晶胞中,距离每个
晶胞中,距离每个 最近的
最近的 的个数是
的个数是___________ 。
③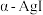 晶胞和
晶胞和 晶胞的体积比是
晶胞的体积比是___________ 。
| 元素 |  |  |  |  |  |  |
| 电负性 | 2.1 | 3.0 | 4.0 | 3.0 | 2.8 | 2.5 |
(1)碘元素在周期表中的位置是
(2)漂白液的有效成分是
 ,工业制备漂白液的离子方程式是
,工业制备漂白液的离子方程式是(3)卤族元素化合物的性质有相似性和递变性,下列说法
A. 沸点依次升高 沸点依次升高 |
B. 的稳定性依次升高 的稳定性依次升高 |
C. 熔点依次升高 熔点依次升高 |
D.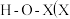 代表 代表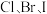 )的酸性随着 )的酸性随着 的原子序数递增逐渐增强 的原子序数递增逐渐增强 |
(4)
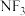 的结构与
的结构与 类似,但是性质差异较大。
类似,但是性质差异较大。①
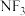 的
的 模型名称为
模型名称为②沸点NF3
 ”“
”“ "或“
"或“ ”),原因是
”),原因是③
 具有碱性(可与
具有碱性(可与 结合)而
结合)而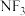 没有碱性,原因是
没有碱性,原因是(5)
 晶体,可以通过加热
晶体,可以通过加热 晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了
晶体制得。两种晶体的晶胞示意图如图所示,图中只画出了 在晶胞中的位置,
在晶胞中的位置, 主要分布在由
主要分布在由 构成的四面体、八面体等空隙中。
构成的四面体、八面体等空隙中。

①在电场作用下,
 不需要克服太大的阻力即可发生迁移。因此,
不需要克服太大的阻力即可发生迁移。因此,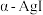 晶体在电池中可作为
晶体在电池中可作为②
 晶胞中,距离每个
晶胞中,距离每个 最近的
最近的 的个数是
的个数是③
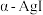 晶胞和
晶胞和 晶胞的体积比是
晶胞的体积比是
您最近一年使用:0次
名校
解题方法
3 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
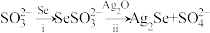
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
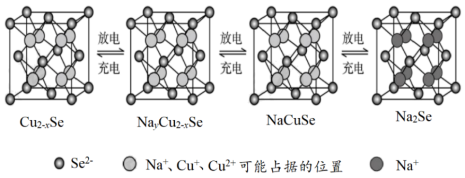
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: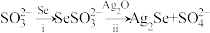
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
452次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
4 . 钛(T)被称为“未来金属”,钛合金广泛应用于多个领域。
(1)工业上由钛铁矿(主要成分为 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图

① 元素在元素周期表的位置是
元素在元素周期表的位置是_______ 。
②基态 原子的简化电子排布式是
原子的简化电子排布式是_______ 。
③补全反应器中发生反应的化学方程式:_______ 。

④由合成器得到的粗产品是 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于_______  即可。
即可。
(2)超高硬度生物材料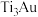 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。

① 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有_______ 个。
② 的晶胞边长为
的晶胞边长为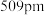 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是_______  (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,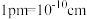 )
)
③与 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的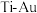 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是_______ (填“ ”或“
”或“ ”)。
”)。
(1)工业上由钛铁矿(主要成分为
 )在高温下经氯化得到
)在高温下经氯化得到 ,再制取金属钛的流程如图
,再制取金属钛的流程如图
①
 元素在元素周期表的位置是
元素在元素周期表的位置是②基态
 原子的简化电子排布式是
原子的简化电子排布式是③补全反应器中发生反应的化学方程式:

④由合成器得到的粗产品是
 、
、 、
、 的混合物,可采用真空蒸馏的方法分离得到
的混合物,可采用真空蒸馏的方法分离得到 。依据下表信息,加热的温度略高于
。依据下表信息,加热的温度略高于 即可。
即可。 |  |  |  | |
熔点/ |  | 648.8 | 714 | 1667 |
沸点/ | 136.4 | 1090 | 1412 | 3287 |
(2)超高硬度生物材料
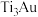 合金是理想的人工髋关节和膝关节材料,其晶体有
合金是理想的人工髋关节和膝关节材料,其晶体有 、
、 两种结构,如下图所示。
两种结构,如下图所示。
①
 晶胞中,
晶胞中, 原子周围与它最近且距离相等的
原子周围与它最近且距离相等的 原子有
原子有②
 的晶胞边长为
的晶胞边长为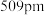 ,每个晶胞面上有两个
,每个晶胞面上有两个 原子。
原子。 晶体的密度是
晶体的密度是 (列出计算式)。(已知:阿伏加德罗常数为
(列出计算式)。(已知:阿伏加德罗常数为 ,
,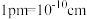 )
)③与
 晶体相比,
晶体相比, 晶体有更长的
晶体有更长的 键键长。上述两种晶体中硬度较高的是
键键长。上述两种晶体中硬度较高的是 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
名校
5 . 我国科学家制备了一种 太阳电池,其结构示意图如下。
太阳电池,其结构示意图如下。
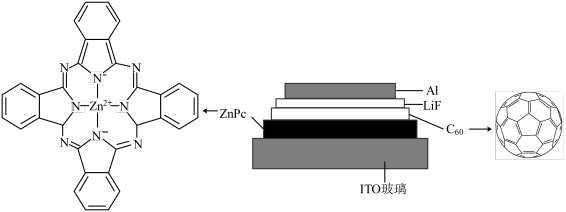
(1)铝元素属于______ 区(填“s”“d”“ds”或“p”)。
(2) 分子中60个碳原子都是等价的,均以近似
分子中60个碳原子都是等价的,均以近似_____ 杂化的方式形成3个不共平面的 键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,
键,余下的1个p轨道电子互相重叠形成闭壳层电子结构, 电子云分布在
电子云分布在 分子笼的内外层表面上。循环伏安测试表明:
分子笼的内外层表面上。循环伏安测试表明: 在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
(3)① 中基态
中基态 的电子排布式为
的电子排布式为_______ 。
②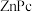 中存在配位键的原因是
中存在配位键的原因是________ 。
(4)某溶剂中,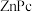 可以和
可以和 形成分子间电荷转移复合物,反应方程式可表示为:
形成分子间电荷转移复合物,反应方程式可表示为: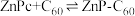 ,不同温度下生成电荷转移复合物的平衡常数如下表。
,不同温度下生成电荷转移复合物的平衡常数如下表。
反应: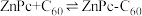

____ 0(填“>”或。“<”),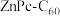 中
中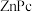 是电子
是电子_____ (填“给体”或“受体”)。
(5) 晶体结构属于氯化钠型,其晶胞结构如图所示。
晶体结构属于氯化钠型,其晶胞结构如图所示。

① 的熔点和沸点比
的熔点和沸点比 的高,请解释原因
的高,请解释原因________ 。
② 晶体的密度约为
晶体的密度约为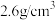 ,
, 晶胞的体积约为
晶胞的体积约为______  (计算结果保留一位有效数字)。
(计算结果保留一位有效数字)。
③一种 的晶胞如图所示。
的晶胞如图所示。
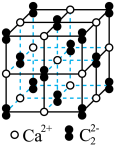
 晶体属于
晶体属于_____ (填晶体类型)晶体,每个 在
在____ 个阴离子构成的多面体中心。一个 晶胞中,含有
晶胞中,含有____ 个 键和
键和____ 个 键。
键。
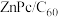 太阳电池,其结构示意图如下。
太阳电池,其结构示意图如下。
(1)铝元素属于
(2)
 分子中60个碳原子都是等价的,均以近似
分子中60个碳原子都是等价的,均以近似 键,余下的1个p轨道电子互相重叠形成闭壳层电子结构,
键,余下的1个p轨道电子互相重叠形成闭壳层电子结构, 电子云分布在
电子云分布在 分子笼的内外层表面上。循环伏安测试表明:
分子笼的内外层表面上。循环伏安测试表明: 在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。
在溶液中可以逐步可逆地接受6个电子形成负离子,却很难失去电子变为阳离子。(3)①
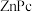 中基态
中基态 的电子排布式为
的电子排布式为②
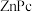 中存在配位键的原因是
中存在配位键的原因是(4)某溶剂中,
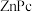 可以和
可以和 形成分子间电荷转移复合物,反应方程式可表示为:
形成分子间电荷转移复合物,反应方程式可表示为: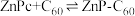 ,不同温度下生成电荷转移复合物的平衡常数如下表。
,不同温度下生成电荷转移复合物的平衡常数如下表。| 温度 | 生成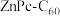 的K 的K |
 | 1.2329 |
 | 0.9674 |
 | 0.4923 |
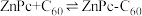

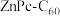 中
中 是电子
是电子(5)
 晶体结构属于氯化钠型,其晶胞结构如图所示。
晶体结构属于氯化钠型,其晶胞结构如图所示。
①
 的熔点和沸点比
的熔点和沸点比 的高,请解释原因
的高,请解释原因②
 晶体的密度约为
晶体的密度约为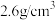 ,
, 晶胞的体积约为
晶胞的体积约为 (计算结果保留一位有效数字)。
(计算结果保留一位有效数字)。③一种
 的晶胞如图所示。
的晶胞如图所示。
 晶体属于
晶体属于 在
在 晶胞中,含有
晶胞中,含有 键和
键和 键。
键。
您最近一年使用:0次
名校
解题方法
6 .  为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为:
为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为: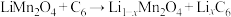 。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
 为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为:
为尖晶石型锰系锂离子电池材料,其晶胞由8个立方单元组成,这8个立方单元可分为A、B两种类型。电池充电过程的总反应可表示为: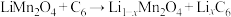 。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。
。已知:充放电前后晶体中锰的化合价只有+3、+4,分别表示为Mn(III)、Mn(IV)。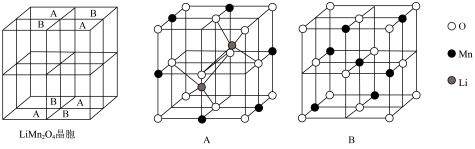
A.每个晶胞含8个 |
B.立方单元B中Mn、O原子个数比为 |
C.放电时,正极反应为 |
D.若 ,则充电后材料中Mn(Ⅲ)与Mn(Ⅳ)的比值为 ,则充电后材料中Mn(Ⅲ)与Mn(Ⅳ)的比值为 |
您最近一年使用:0次
2024-01-19更新
|
581次组卷
|
5卷引用:北京市第一六一中学2023-2024学年高三下学期开学考化学试题
名校
解题方法
7 . BTCu是荧光增强型Cu2+荧光分子探针,可对环境和生物体内的微量Cu2+进行有效检测。BTCu识别Cu2+机理如下图:

回答下列问题:
(1)基态Cu原子的价电子排布式为___________ 。
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有___________ mol,B原子的杂化轨道类型是___________ 。
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有___________ 个。
②该晶体的化学式是___________ 。
③该晶体的密度是___________ g/cm3 (列出计算式)。

回答下列问题:
(1)基态Cu原子的价电子排布式为
(2)BTCu中所含第二周期元素的第一电离能由小到大的顺序为
(3)探针BTCu与Cu2+的识别过程既有氧化脱氢反应,也有配合形式的参与。1molBTCu-Cu+中,Cu+形成的配位键有
(4)某晶体的晶胞结构如下图所示。已知:a=b=0.524 nm,c-1.032 nm,晶胞棱边夹角均为90°,NA为阿伏加德罗常数的值。(1nm=1×10-7cm)

①距离Fe最近且等距的S有
②该晶体的化学式是
③该晶体的密度是
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为___________ 。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是___________ 、___________ 。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。已知该晶胞的密度为 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___________ cm。(用含p、NA的计算式表示)___________ 。
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
您最近一年使用:0次
名校
解题方法
9 . 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)基态钛原子的电子排布式为___________
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为___________ (用元素符号表示);SO 的空间构型为
的空间构型为___________ ,其中S原子的杂化方式为___________ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是___________ (选填字母序号)。
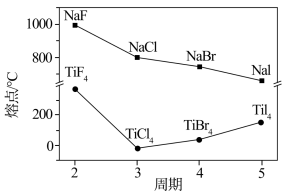
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
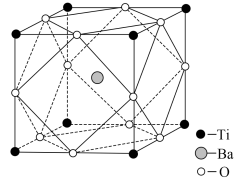
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为___________ ;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是___________ ;其晶胞参数约为a pm,钛酸钡晶体的密度ρ=___________ g·cm-3(阿伏加德罗常数的值为NA,1pm=1×10-12m)
(1)基态钛原子的电子排布式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为
 的空间构型为
的空间构型为(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是

a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为

您最近一年使用:0次
2023-12-28更新
|
217次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
10 . 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图所示。下列说法不正确 的是
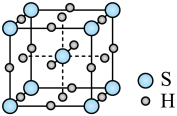

| A.该晶体属于分子晶体 |
| B.S位于元素周期表p区 |
C.该物质的化学式为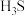 |
| D.与S等距且最近的H的个数为6 |
您最近一年使用:0次
2023-12-14更新
|
212次组卷
|
4卷引用:北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题
北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题(已下线)T9-物质结构与性质(已下线)选择题11-15



