1 . 随着科学的发展,氟及其化合物的用途日益广泛。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。
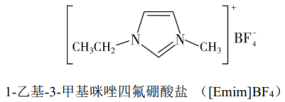
(1)基态N原子的价层电子轨道表示式为_______ 。
(2)①N、F、P三种元素的电负性由大到小的顺序为_______ 。
②根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为_______ 形。
(3) 是制备此离子液体的原料。
是制备此离子液体的原料。
①微粒中F—B—F键角:
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
② 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是_______ 。
(4)以 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为_______ ,电解质溶液中 向
向_______ (填“阴”或“阳”)极移动。
Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm 。
。

(5)与 距离最近且相等的
距离最近且相等的 有
有_______ 个。
(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
Ⅰ.离子液体具有电导率高、化学稳定性高等优点,在电化学领域用途广泛。某离子液体的结构简式如下图。

(1)基态N原子的价层电子轨道表示式为
(2)①N、F、P三种元素的电负性由大到小的顺序为
②根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 是制备此离子液体的原料。
是制备此离子液体的原料。①微粒中F—B—F键角:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②
 可以与NaF反应生成
可以与NaF反应生成 的原因是
的原因是(4)以
 和
和 的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为
的混合体系做电解质溶液,可以实现在不锈钢上镀铜。镀铜时,阳极材料为 向
向Ⅱ.NaF等氟化物可以做光导纤维材料,一定条件下,某NaF的晶胞结构示意图如下图所示,晶胞的边长为apm
 。
。
(5)与
 距离最近且相等的
距离最近且相等的 有
有(6)已知NaF的摩尔质量是Mg/mol,阿伏伽德罗常数为
 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
2 . 氧族元素Se(硒)及其化合物有着广泛应用价值。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
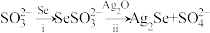
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表___________ 区。
②SeSO 的空间结构是
的空间结构是___________ 。
③过程ii中SeSO 一定断裂的化学键是
一定断裂的化学键是___________ 。
(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由___________ 。
②NH 中H—N—H键角
中H—N—H键角___________ (填“>”或“<”)NH3中H—N—H键角。
③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为___________ g·cm-3。(1nm=10-7cm)
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。
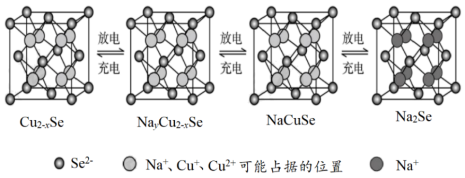
每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为___________ 。
(1)Na2SeSO3(硒代硫酸钠,其中SeSO
 可看作是SO
可看作是SO 中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下:
中的一个O原子被Se原子取代的产物)在某些肿瘤治疗中能够提高治愈率。其制备和转化关系如下: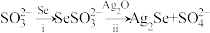
①按照核外电子排布,可把元素周期表划分为5个区。Se位于元素周期表
②SeSO
 的空间结构是
的空间结构是③过程ii中SeSO
 一定断裂的化学键是
一定断裂的化学键是(2)非铅双钙钛矿材料[(NH4)2SeBr6]有望大规模应用于太阳能电池。一定压力下合成的[(NH4)2SeBr6]晶体的晶胞结构如下图,其中[SeBr6]2-位于正方体的顶点和面心。

①比较Se原子和Br原子的第一电离能大小,并从原子结构的角度说明理由
②NH
 中H—N—H键角
中H—N—H键角③ 一定压力下形成的[(NH4)2SeBr6]晶胞形状为正方体,边长为a nm。已知[(NH4)2SeBr6]的摩尔质量是M g·mol-1,阿伏伽德罗常数为NA,该晶体密度为
(3)Cu2-xSe是一种钠离子电池的正极材料,充、放电过程中正极材料立方晶胞(示意图)的组成变化如下图所示(晶胞内未标出因放电产生的0价Cu原子)。

每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为
您最近一年使用:0次
2024-02-23更新
|
452次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三下学期开学考化学试题
解题方法
3 . 氟在已知元素中电负性最大、非金属性最强,其单质在1886年才被首次分离出来。
(1)基态F原子的核外电子排布式为___________ 。
(2)氟氧化物 、
、 的结构已经确定。
的结构已经确定。
①依据数据推测O—O键的稳定性:
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 中F—O—F键角小于
中F—O—F键角小于 中H—O—H键角,解释原因:
中H—O—H键角,解释原因:___________ 。
(3) 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明, 固体中
固体中 分子排列为锯齿形,画出含2个
分子排列为锯齿形,画出含2个 的重复单元结构:
的重复单元结构:___________ 。
② 溶剂中加入
溶剂中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:___________ 。
(4)工业上用萤石(主要成分 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。 晶体中距离
晶体中距离 最近的
最近的 有
有___________ 个。
②晶体中 与
与 的最近距离为
的最近距离为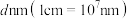 ),阿伏加德罗常数值为
),阿伏加德罗常数值为 。该晶体的密度
。该晶体的密度
___________  (列出计算式)。
(列出计算式)。
 |  | |
O—O键长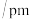 | 121 | 148 |
(2)氟氧化物
 、
、 的结构已经确定。
的结构已经确定。①依据数据推测O—O键的稳定性:

 (填“>”或“<”)。
(填“>”或“<”)。②
 中F—O—F键角小于
中F—O—F键角小于 中H—O—H键角,解释原因:
中H—O—H键角,解释原因:(3)
 是一种有特殊性质的氢化物。
是一种有特殊性质的氢化物。①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,
 固体中
固体中 分子排列为锯齿形,画出含2个
分子排列为锯齿形,画出含2个 的重复单元结构:
的重复单元结构:②
 溶剂中加入
溶剂中加入 可以解离出
可以解离出 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
和具有正四面体形结构的阴离子,写出该过程的离子方程式:(4)工业上用萤石(主要成分
 )制备
)制备 。
。 晶体的一种立方晶胞如图所示。
晶体的一种立方晶胞如图所示。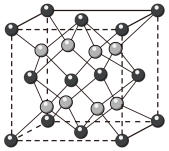
 晶体中距离
晶体中距离 最近的
最近的 有
有②晶体中
 与
与 的最近距离为
的最近距离为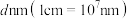 ),阿伏加德罗常数值为
),阿伏加德罗常数值为 。该晶体的密度
。该晶体的密度
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023-04-06更新
|
672次组卷
|
2卷引用:北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷
名校
解题方法
4 . 砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
名校
解题方法
5 . 硅是地壳中储量仅次于氧的元素,在自然界中主要以 和硅酸盐的形式存在。
和硅酸盐的形式存在。
(1)基态硅原子的价电子排布式为___________ 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次为___________ 。
(3)晶态 的晶胞如图。
的晶胞如图。

①硅原子的杂化方式为___________ 。
②已知 晶胞的棱长均为a pm,则
晶胞的棱长均为a pm,则 晶体的密度
晶体的密度
___________  (列出计算式)。
(列出计算式)。
(4)硅元素最高价氧化物对应的水化物为原硅酸 。
。
资料:原硅酸()( )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
①原硅酸钠 溶液吸收空气中的
溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:___________ 。
②从结构的角度解释 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:___________ 。
 和硅酸盐的形式存在。
和硅酸盐的形式存在。(1)基态硅原子的价电子排布式为
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次为
(3)晶态
 的晶胞如图。
的晶胞如图。
①硅原子的杂化方式为
②已知
 晶胞的棱长均为a pm,则
晶胞的棱长均为a pm,则 晶体的密度
晶体的密度
 (列出计算式)。
(列出计算式)。(4)硅元素最高价氧化物对应的水化物为原硅酸
 。
。资料:原硅酸()(
 )可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。
)可溶于水,原硅酸中的羟基可发生分子间脱水,逐渐转化为硅酸、硅胶。①原硅酸钠
 溶液吸收空气中的
溶液吸收空气中的 会生成
会生成 ,结合元素周期律解释原因:
,结合元素周期律解释原因:②从结构的角度解释
 脱水后溶解度降低的原因:
脱水后溶解度降低的原因:
您最近一年使用:0次
2022-04-01更新
|
701次组卷
|
6卷引用:北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题



