名校
解题方法
1 . 回答下列问题:
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为___________ 。
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是___________ 、___________ 。
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____ 。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________ (填晶体类型)。
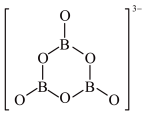
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________ 。已知该晶胞的密度为 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=___________ cm。(用含p、NA的计算式表示)___________ 。
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
(1)金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)]和Fe(CO)x等。
①基态氧原子的价电子排布式为
②尿素(H2NCONH2)分子中C、N原子的杂化方式分别是
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为
 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=
a.第一电离能大小:S>P>Si
b.电负性顺序:C<N<O<F
c.因为晶格能CaO比KC1高,所以KCl比CaO熔点低
d.SO2与CO2的化学性质类似,分子结构也都呈直线形,相同条件下SO2的溶解度更大
您最近一年使用:0次
名校
解题方法
2 . 钛酸钡具有优良的介电、压电特性,主要用于电容器、自动温控等领域。
(1)基态钛原子的电子排布式为___________
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为___________ (用元素符号表示);SO 的空间构型为
的空间构型为___________ ,其中S原子的杂化方式为___________ 。
(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是___________ (选填字母序号)。
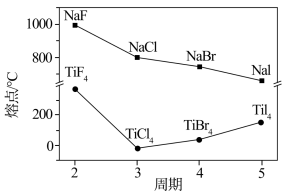
a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
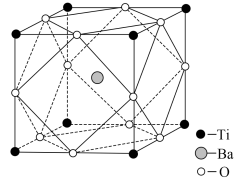
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为___________ ;晶体中每个钡离子周围与其距离最近且相等的氧离子的数量是___________ ;其晶胞参数约为a pm,钛酸钡晶体的密度ρ=___________ g·cm-3(阿伏加德罗常数的值为NA,1pm=1×10-12m)
(1)基态钛原子的电子排布式为
(2)钡元素在自然界中主要以重晶石形式存在,其成分为BaSO4,其中所含三种元素的电负性从大到小的顺序为
 的空间构型为
的空间构型为(3)卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示,已知TiF4的晶体类型与TiCl4、TiBr4、TiI4不同,下列判断不正确的是

a.NaX均为离子晶体
b.随X半径的增大,NaX的离子键减弱,熔点逐渐降低
c.TiF4的熔点反常升高是由于氢键的作用
d.TiCl4、TiBr4、TiI4的相对分子质量依次增大,分子间作用力增大,熔点逐渐升高
(4)钛酸钡的晶胞结构如图所示,钛酸钡的化学式为

您最近一年使用:0次
2023-12-28更新
|
217次组卷
|
2卷引用:北京市中国人民大学附属中学2021-2022学年高三下学期开学考试化学试卷
3 . 单质硫和氢气在低温高压下可形成一种新型超导材料,其晶胞如图所示。下列说法不正确 的是
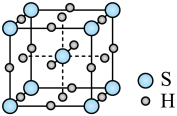

| A.该晶体属于分子晶体 |
| B.S位于元素周期表p区 |
C.该物质的化学式为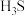 |
| D.与S等距且最近的H的个数为6 |
您最近一年使用:0次
2023-12-14更新
|
212次组卷
|
4卷引用:北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题
北京市首都师范大学附属中学2022-2023学年高三上学期开学测试化学试题辽宁省沈阳市同泽高级中学2023-2024学年高二上学期第二次月考化学试题(已下线)T9-物质结构与性质(已下线)选择题11-15
名校
解题方法
4 . 完成下列问题
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式___________ ;H、B、N中,原子半径最大的是___________ 。
② 分子中
分子中___________ (填“存在”或“不存在”)配位键。
③氨硼烷在一定条件下和水发生如下反应: ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由___________ 变为___________ ;反应涉及的N、B、O三种元素的第一电离能从大到小的顺序为___________ 。
(2) 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
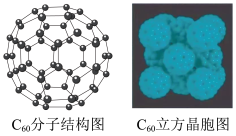
① 晶体属于
晶体属于___________ 晶体,每个 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为___________ 个;
②凸多面体中有欧拉定理:顶点+面-棱边=2,则 分子中的五边形数目为
分子中的五边形数目为___________ ,六边形的数目为___________ ;
(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为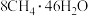 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面,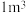 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下___________  甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
(1)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种有潜力的固体储氢材料,回答问题:
①画出B的价电子轨道表示式
②
 分子中
分子中③氨硼烷在一定条件下和水发生如下反应:
 ,
, 的结构如图,在该反应中,B原子的杂化轨道类型由
的结构如图,在该反应中,B原子的杂化轨道类型由
(2)
 是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是
是碳元素的一种单质,因为其特殊的结构和性质而受到科学家的关注。如图是 分子结构图和
分子结构图和 立方晶胞图。
立方晶胞图。
①
 晶体属于
晶体属于 分子周围紧邻的分子数目为
分子周围紧邻的分子数目为②凸多面体中有欧拉定理:顶点+面-棱边=2,则
 分子中的五边形数目为
分子中的五边形数目为(3)许多气体可以在深海低温、高压的状态下,与水形成水合物晶体,其中可燃冰因为其良好的应用前景而备受关注,如图是天然气分子藏在水分子笼中的示意图。

天然气分子藏在水分子笼内
甲烷等分子是装在通过氢键相连的几个水分子构成的笼内。假设天然气水合物的化学式为
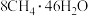 ,其密度为
,其密度为 ,把甲烷水合物从海底提升到海平面,
,把甲烷水合物从海底提升到海平面, 的固体理论上最多可释放标准状况下
的固体理论上最多可释放标准状况下 甲烷气体(列出计算式)。
甲烷气体(列出计算式)。
您最近一年使用:0次
名校
解题方法
5 . Ti和P的化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)Ti的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是___________ 。(已知:电负性:Ti 1.5;F 4.0;Cl 3.0;Br 2.8;I 2.5)
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态 原子的核外电子排布式为
原子的核外电子排布式为___________ 。
② 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为___________ 。 的配位数是
的配位数是___________ 。 、
、 和有机碱离子
和有机碱离子 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中___________ 的空间位置相同。 的立体结构为
的立体结构为___________ 。
②磷酸通过分子间脱水缩合形成多磷酸,如:___________ 。
(1)Ti的四卤化物熔点如下表所示,
 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,四种卤化物熔点变化的原因是
熔点依次升高,四种卤化物熔点变化的原因是| 化合物 |  |  |  |  |
| 熔点/℃ | 377 | 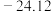 | 38.3 | 155 |
(2)钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器等的功能材料。
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 的晶胞如图甲所示,金属离子与氧离子间的作用力为
的晶胞如图甲所示,金属离子与氧离子间的作用力为 的配位数是
的配位数是
 、
、 和有机碱离子
和有机碱离子 ,晶胞如图乙所示(与甲晶胞取法不同)。其中
,晶胞如图乙所示(与甲晶胞取法不同)。其中 与图甲中
与图甲中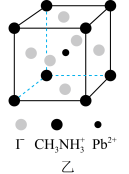
 的立体结构为
的立体结构为②磷酸通过分子间脱水缩合形成多磷酸,如:
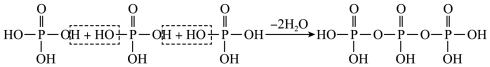
您最近一年使用:0次
名校
6 . 锗(Ge)是典型的半导体元素,Ge单晶具有金刚石型结构,在电子、材料等领域应用广泛。锗卤化物的熔点数据如下表所示,下列说法正确的是
 | 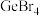 | 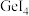 | |
| 熔点/℃ | -49.5 | 26 | 146 |
A.基态Ge原子的价电子排布式为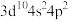 |
B.Ge单晶中,Ge原子为 杂化,配位数为12 杂化,配位数为12 |
C.卤化锗熔化时破坏共价键,键能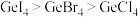 |
| D.卤化锗的价层电子对构型(VSEPR)与分子构型一致,均为正四面体形 |
您最近一年使用:0次
名校
解题方法
7 . 甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si_________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为_________________ 。
(2)利用 与
与 可制得氮化硅(
可制得氮化硅(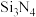 )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中 的键角
的键角__________  中
中 的键角(“>”“<”或“=”),其键角差异的原因是
的键角(“>”“<”或“=”),其键角差异的原因是_____________________________ 。
(3)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。__________ ,SiC的晶体类型是_____________ 。
②已知碳化硅的晶胞边长为a nm(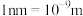 ),阿伏伽德罗常数为
),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为_____________  (列出计算式)。
(列出计算式)。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)Si原子与H原子结合时,Si表现为正价,则电负性:Si
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 可制得氮化硅(
可制得氮化硅(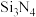 )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中 的键角
的键角 中
中 的键角(“>”“<”或“=”),其键角差异的原因是
的键角(“>”“<”或“=”),其键角差异的原因是(3)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。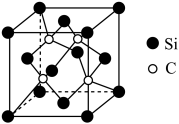
②已知碳化硅的晶胞边长为a nm(
 ),阿伏伽德罗常数为
),阿伏伽德罗常数为 。则碳化硅晶体的密度为
。则碳化硅晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2023-07-12更新
|
328次组卷
|
2卷引用:北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题
名校
解题方法
8 . 砷化铝(AlAs)常用作光谱分析试剂和制备电子组件的原料,是一种新型半导体材料。回答下列问题:
(1)基态As原子的核外价电子排布图为_______ ;第一电离能I1(As)_______ I1(Se) (填“大于”或“小于”),其原因是_______ 。
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为_______ ;分子中As、S原子的杂化轨道类型分别为_______ 、_______ 。
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是_______ 、_______ 。
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为_______ ;该晶体密度为ρ g·cm-3,设NA为阿伏加德罗常数的值,晶胞参数为_______ pm。

(1)基态As原子的核外价电子排布图为
(2)As4S4的分子结构中均为单键,且每个原子最外层均满足8e-稳定结构,则该分子中所含共价键数目为
(3)AlF3的熔点约为1 040 ℃,AlCl3的熔点为194 ℃,其晶体类型分别是
(4)高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图1所示,其中的致密保护膜可阻止H2O2刻蚀液与下层GaAs(砷化镓)反应。

已知AlAs的立方晶胞如图2所示,其中As的配位数为

您最近一年使用:0次
名校
解题方法
9 . 富勒烯( )是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
)是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
Ⅰ. 以其完美的球烯受到科学家重视,其结构如右图所示。60个碳原子是等同的,均为近似
以其完美的球烯受到科学家重视,其结构如右图所示。60个碳原子是等同的,均为近似 杂化,但却有两种不同类型的碳碳键。其中一种为
杂化,但却有两种不同类型的碳碳键。其中一种为 ;另一种为
;另一种为 。
。

(1) 在水中溶解度
在水中溶解度______  在甲苯中溶解度(填“>”、“<”或“≈”);
在甲苯中溶解度(填“>”、“<”或“≈”);
(2)请在图中标明这2种类型的键,注明键长_________ ;
(3)石墨、 互为同素异形体,但相同条件下,石墨的熔点比
互为同素异形体,但相同条件下,石墨的熔点比 高得多,原因是
高得多,原因是____________ 。
Ⅱ. 常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
(4)从结构角度解释为什么 不导电
不导电____________ ;
(5) 的晶胞结构如图所示.每个白球代表1个
的晶胞结构如图所示.每个白球代表1个 分子.已知一定条件下晶胞的棱长为
分子.已知一定条件下晶胞的棱长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该条件下
,则该条件下 的摩尔体积为
的摩尔体积为_______  (用含a、
(用含a、 的代数式表示)
的代数式表示)
(6) 晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙).所有空隙中均填充一个金属M原子,可获得某条件下的超导材料.则该超导材料中,平均一个
晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙).所有空隙中均填充一个金属M原子,可获得某条件下的超导材料.则该超导材料中,平均一个 晶胞需掺杂
晶胞需掺杂______ 个M原子。

 )是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。
)是一类完全由碳组成的中空分子,在催化、光电等很多领域都有重要作用。Ⅰ.
 以其完美的球烯受到科学家重视,其结构如右图所示。60个碳原子是等同的,均为近似
以其完美的球烯受到科学家重视,其结构如右图所示。60个碳原子是等同的,均为近似 杂化,但却有两种不同类型的碳碳键。其中一种为
杂化,但却有两种不同类型的碳碳键。其中一种为 ;另一种为
;另一种为 。
。
(1)
 在水中溶解度
在水中溶解度 在甲苯中溶解度(填“>”、“<”或“≈”);
在甲苯中溶解度(填“>”、“<”或“≈”);(2)请在图中标明这2种类型的键,注明键长
(3)石墨、
 互为同素异形体,但相同条件下,石墨的熔点比
互为同素异形体,但相同条件下,石墨的熔点比 高得多,原因是
高得多,原因是Ⅱ.
 常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。
常态下是为紫色固体,不导电,但给富勒烯掺杂金属后(用金属原子把富勒烯分子连起来或者把金属原子放进富勒烯笼子里),其在一定条件下甚至可以成为超导体。(4)从结构角度解释为什么
 不导电
不导电(5)
 的晶胞结构如图所示.每个白球代表1个
的晶胞结构如图所示.每个白球代表1个 分子.已知一定条件下晶胞的棱长为
分子.已知一定条件下晶胞的棱长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该条件下
,则该条件下 的摩尔体积为
的摩尔体积为 (用含a、
(用含a、 的代数式表示)
的代数式表示)(6)
 晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙).所有空隙中均填充一个金属M原子,可获得某条件下的超导材料.则该超导材料中,平均一个
晶体结构中存在四面体空隙(如图中1、3、6、7围成的空隙)和八面体空隙(如图中3、6、7、8、9、12围成的空隙).所有空隙中均填充一个金属M原子,可获得某条件下的超导材料.则该超导材料中,平均一个 晶胞需掺杂
晶胞需掺杂
您最近一年使用:0次
2023-02-14更新
|
807次组卷
|
2卷引用:北京市海淀区教师进修学校2022-2023学年高三下学期开学检测化学试题
10 . 因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构也不同。两种铁晶胞(均为立方体,边长分别为以anm和1.22anm)的结构示意图如下。不正确 的是
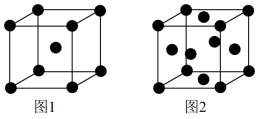
| A.用X射线衍射可测定铁晶体的结构 |
| B.图2代表的铁单质中,一个铁原子周围最多有4个紧邻的铁原子 |
| C.图1与图2代表的铁单质中,原子之间以金属键相互结合 |
| D.图1与图2代表的铁单质的密度不同 |
您最近一年使用:0次
2023-01-06更新
|
775次组卷
|
5卷引用:北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题
北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题北京市东城区2022-2023学年高三上学期1月期末统一检测化学试卷(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)(已下线)通关练07 原子、分子、晶体结构再归纳-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)北京市首都师大附中2023-2024学年高二上学期期末考试化学试卷



