名校
1 . 指出下列物质的晶体类型。(填“分子晶体”或“共价晶体”或“离子晶体”)
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电___________ 。
(2)五氧化二矾,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中___________ 。
(3)溴化钾,无色晶体,熔融时或溶于水中都能导电___________ 。
(4)氯化铁常温下为固体,熔点为282℃,沸点为315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氧化铁晶体为___________ 。
(1)碳化铝,黄色晶体,熔点2200℃,熔融态不导电
(2)五氧化二矾,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
(3)溴化钾,无色晶体,熔融时或溶于水中都能导电
(4)氯化铁常温下为固体,熔点为282℃,沸点为315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氧化铁晶体为
您最近一年使用:0次
名校
解题方法
2 . 各图为几种分子、晶体或晶胞的结构示意图。
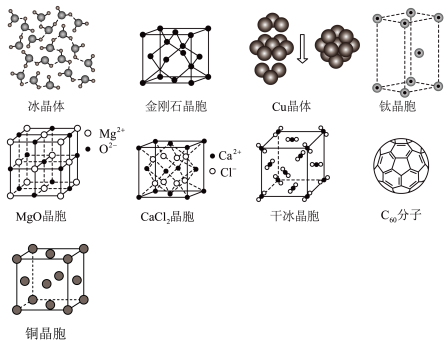
请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是_____ 、C60晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是_____ 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____ 。
(3)每个Cu晶胞中实际占有_____ 个Cu原子,每个MgO晶胞中实际占有_____ 个镁离子,CaCl2晶体中每个Ca2+周围距离最近且相等的Cl-有_____ 个。
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,已知阿伏加德罗常数的值为NA,若晶胞的棱长为acm,则晶胞的密度为______ g•cm-3(列出含a、NA的计算式即可)。

请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
(3)每个Cu晶胞中实际占有
(4)超高热导率半导体材料-砷化硼(BAs)的晶胞结构如图所示,已知阿伏加德罗常数的值为NA,若晶胞的棱长为acm,则晶胞的密度为

您最近一年使用:0次
名校
解题方法
3 . 各图为几种分子、晶体或晶胞的结构示意图。

请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是_____ 、C60晶体;构成晶体的粒子之间主要以氢键结合形成的晶体是_____ 。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_____ 。
(3)每个Cu晶胞中实际占有_____ 个Cu原子,每个MgO晶胞中实际占有_____ 个镁离子,CaCl2晶体中每个Ca2+周围距离最近且相等的Cl-有_____ 个。
(4)金刚石和C60晶体都是碳元素形成的单质,120gC60晶体中含π键数目为_____ 。

请回答下列问题:
(1)这些物质对应的晶体中,构成晶体的粒子之间主要以范德华力结合形成的晶体是
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为
(3)每个Cu晶胞中实际占有
(4)金刚石和C60晶体都是碳元素形成的单质,120gC60晶体中含π键数目为
您最近一年使用:0次
解题方法
4 . 回答下列问题
(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500 ℃
试推断它们的晶体类型:A._______ ;B._______ ;C._______ ;D._______ 。
(2)如图所示的甲、乙、丙三种晶体:

试推断,甲晶体的化学式(X为阳离子):_______ ;
乙晶体中A、B、C三种微粒的个数比是_______ ;丙晶体中每个D周围结合E的个数是_______ 。
(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500 ℃
试推断它们的晶体类型:A.
(2)如图所示的甲、乙、丙三种晶体:

试推断,甲晶体的化学式(X为阳离子):
乙晶体中A、B、C三种微粒的个数比是
您最近一年使用:0次
5 . 非金属元素在生产、生活中应用广泛。根据所学知识,回答下列问题:
(1)磷与氯气在一定条件下反应,可以生成 。
。
①基态磷原子的核外电子排布式为_______ 。
② 分子中磷原子采用的杂化方式是
分子中磷原子采用的杂化方式是_______ ,分子的空间构型为_______ 。
(2)氮元素是植物生长所需的元素,常见氮肥有铵盐( )、尿素(
)、尿素( )等,
)等, 中H-N-H键的键角
中H-N-H键的键角_______ (填“>”“<”“=”) 中N-C-N键的键角;1mol尿素分子含有
中N-C-N键的键角;1mol尿素分子含有 键的数目为
键的数目为_______ 。
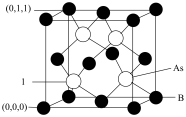
(3)C与N可以形成一种超硬的新材料,其晶体部分结构如图所示,下列有关该晶体的说法正确的是_______(填字母)。

(1)磷与氯气在一定条件下反应,可以生成
 。
。①基态磷原子的核外电子排布式为
②
 分子中磷原子采用的杂化方式是
分子中磷原子采用的杂化方式是(2)氮元素是植物生长所需的元素,常见氮肥有铵盐(
 )、尿素(
)、尿素( )等,
)等, 中H-N-H键的键角
中H-N-H键的键角 中N-C-N键的键角;1mol尿素分子含有
中N-C-N键的键角;1mol尿素分子含有 键的数目为
键的数目为(3)C与N可以形成一种超硬的新材料,其晶体部分结构如图所示,下列有关该晶体的说法正确的是_______(填字母)。

| A.该晶体属于分子晶体 |
| B.该晶体的硬度比金刚石还大 |
C.该晶体的化学式是 |
| D.该晶体熔化时共价键被破坏 |
您最近一年使用:0次
2022-04-28更新
|
160次组卷
|
2卷引用:黑龙江省齐齐哈尔市2022-2023学年高二下学期4月期中考试化学试题
2022高三·全国·专题练习
6 . 区分晶体Ni和非晶体Ni的最可靠的科学方法为_______
您最近一年使用:0次
7 . A、B、C、D为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P能级中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于___________ 分子(填“极性”或“非极性”)。
(2)当n=3时, A与B形成的晶体属于___________ 晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为___________ 。H2O分子中心原子的杂化方式为___________ 。
(5)金属铜晶体的堆积方式为___________ 。
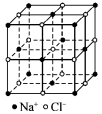
(6)如图是NaCl晶体的结构示意图,已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,NaCl的相对分子质量为M,则NaCl晶体的密度为___________ g·cm-3。
(1)当n=2时,AB2属于
(2)当n=3时, A与B形成的晶体属于
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是
(4)已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中作为配位体之一的NH3分子的空间构型为
(5)金属铜晶体的堆积方式为
(6)如图是NaCl晶体的结构示意图,已知阿伏加德罗常数的值(Na),X射线测得NaCl晶体中靠得最近的Na+、Cl-间的平均距离为a cm,NaCl的相对分子质量为M,则NaCl晶体的密度为

您最近一年使用:0次
解题方法
8 . 现有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是___________ ,直接由原子构成的晶体是___________ ,直接由原子构成的分子晶体是___________ 。
(2)由极性分子构成的晶体是___________ ,含有共价键的离子晶体是___________ ,属于分子晶体的单质是___________ 。
(3)在一定条件下能导电而不发生化学变化的是___________ ,受热熔化后化学键不发生变化的是___________ ,熔化时需克服共价键的是___________ 。
A.水晶 B.冰醋酸 C.氧化镁 D.白磷 E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于共价晶体的是
(2)由极性分子构成的晶体是
(3)在一定条件下能导电而不发生化学变化的是
您最近一年使用:0次
2021-02-20更新
|
933次组卷
|
4卷引用:黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题
黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题鲁科版2019选择性必修2第3章综合检测卷(人教版2019)选择性必修2 第三章 晶体结构与性质 综合检测卷(已下线)第3.2.2讲 共价晶体-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
9 . 下表是元素周期表的一部分,针对表中的①~⑩中10种元素回答以下问题:
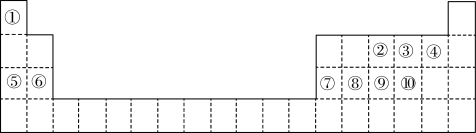
(1)写出⑧元素在周期表的位置______________________ ;
(2)实验室制取②氢化物的化学方程式_______________________________________ ;
②的氢化物与其最高价氧化物水化物反应生成的物质是________________ (填名称)
(3)⑦的氯化物物理性质非常特殊,如熔点为190℃,但在180℃就开始升华。据此判断该氯化物是________ (填“共价化合物”或“离子化合物”),可以证明你判断正确的实验依据为:________________________ 。
(4)用电子式表示④、⑥两元素结合成化合物的形成过程____________________________ 。

(1)写出⑧元素在周期表的位置
(2)实验室制取②氢化物的化学方程式
②的氢化物与其最高价氧化物水化物反应生成的物质是
(3)⑦的氯化物物理性质非常特殊,如熔点为190℃,但在180℃就开始升华。据此判断该氯化物是
(4)用电子式表示④、⑥两元素结合成化合物的形成过程
您最近一年使用:0次
名校
10 . 按要求填空。
(1)前20号元素中气态氢化物最稳定的是:_____ (填化学式)。
(2)前20号元素中最高价氧化物对应水化物碱性最强的碱为:_____ (填写名称)。
(3)第Ⅵ A族元素所形成的氢化物中沸点最高的是:____ (填化学式)。
(4)短周期主族元素中原子半径最大的元素是:_____ (填写名称)。
(5)Fe在元素周期表中位置为:______ 。
(6)以下晶体,存在分子间作用力的共价化合物是_______ (填序号)。
①Ne晶体 ②NH4Cl晶体 ③CaCl2晶体 ④干冰 ⑤水晶
(7)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是_______ (填序号)。
① HCl的溶解度比H2S的大
② HCl的酸性比H2S的强
③ HCl的稳定性比H2S的强
④ Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑤ HClO4的酸性比H2SO4的强
⑥ Cl2能与H2S反应生成S
(1)前20号元素中气态氢化物最稳定的是:
(2)前20号元素中最高价氧化物对应水化物碱性最强的碱为:
(3)第Ⅵ A族元素所形成的氢化物中沸点最高的是:
(4)短周期主族元素中原子半径最大的元素是:
(5)Fe在元素周期表中位置为:
(6)以下晶体,存在分子间作用力的共价化合物是
①Ne晶体 ②NH4Cl晶体 ③CaCl2晶体 ④干冰 ⑤水晶
(7)下列能说明氯元素原子得电子能力比硫元素原子得电子能力强的是
① HCl的溶解度比H2S的大
② HCl的酸性比H2S的强
③ HCl的稳定性比H2S的强
④ Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑤ HClO4的酸性比H2SO4的强
⑥ Cl2能与H2S反应生成S
您最近一年使用:0次



