名校
解题方法
1 . 中华饮食文化源远流长,食盐、醋、料酒是饮食中重要的调料。其中所含物质氯化钠、乙酸、乙醇又是重要的化工原料。
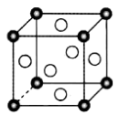
(1)我校首届“化学模型制作”大赛高二14班(B7)肖玗琪同学第一个提交了作品——氯化钠晶胞模型如图所示。

①氯化钠晶体中1个 ,同时跟
,同时跟___________ 个 形成离子键。
形成离子键。
②氯化钠晶体中1个 周围有
周围有___________ 个 距离最近且相等。
距离最近且相等。
③氯化钠晶胞是一个正方体,若设其边长为acm,设阿伏加德罗常数的值为 ,则晶体密度为
,则晶体密度为___________  (列出计算式)。
(列出计算式)。
(2)乙醇跟二甲醚互为___________ (填“同系物”或“同分异构体”)。乙醇分子中所含官能团的名称为___________ 。跟金属钠反应时,乙醇不如水剧烈,其原因是乙醇中的___________ 键的极性相对较弱。
(3)酸性:乙酸>丙酸,从键的极性角度解释原因:___________ 。
(4) 乙酸分子中碳原子与氧原子形成的
乙酸分子中碳原子与氧原子形成的 键的物质的量为
键的物质的量为___________ mol。
(5)“化学模型制作”大赛中高二15班李岩、王一同学提交的作品—— 分子的空间结构模型如图所示。已知
分子的空间结构模型如图所示。已知 可跟某种杯酚结合形成超分子,从而与
可跟某种杯酚结合形成超分子,从而与 分离。这个例子描述的超分子的重要特征是
分离。这个例子描述的超分子的重要特征是___________ (填“分子识别”或“自组装”)。

(1)我校首届“化学模型制作”大赛高二14班(B7)肖玗琪同学第一个提交了作品——氯化钠晶胞模型如图所示。

①氯化钠晶体中1个
 ,同时跟
,同时跟 形成离子键。
形成离子键。②氯化钠晶体中1个
 周围有
周围有 距离最近且相等。
距离最近且相等。③氯化钠晶胞是一个正方体,若设其边长为acm,设阿伏加德罗常数的值为
 ,则晶体密度为
,则晶体密度为 (列出计算式)。
(列出计算式)。(2)乙醇跟二甲醚互为
(3)酸性:乙酸>丙酸,从键的极性角度解释原因:
(4)
 乙酸分子中碳原子与氧原子形成的
乙酸分子中碳原子与氧原子形成的 键的物质的量为
键的物质的量为(5)“化学模型制作”大赛中高二15班李岩、王一同学提交的作品——
 分子的空间结构模型如图所示。已知
分子的空间结构模型如图所示。已知 可跟某种杯酚结合形成超分子,从而与
可跟某种杯酚结合形成超分子,从而与 分离。这个例子描述的超分子的重要特征是
分离。这个例子描述的超分子的重要特征是
您最近一年使用:0次
2 . 非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态F原子核外电子的运动状态有_______ 种。
(2)O、F、Cl电负性由大到小的顺序为_______ ;OF2分子的空间构型为_______ ;OF2的熔、沸点_______ (填“高于”或“低于”)Cl2O。
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ ,下列对XeF2中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有_______ 个XeF2分子。

(1)基态F原子核外电子的运动状态有
(2)O、F、Cl电负性由大到小的顺序为
(3)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
(4)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有

您最近一年使用:0次
解题方法
3 . 钛在许多领域都有重要用途,因为可以制造人类关节和接骨,被称为“生物金属”。请回答下列问题:
(1)钛在元素周期表中位于第_______ 周期第_______ 族,其基态原子核外电子排布式为_______ 。
(2)某种钛氧化物晶体的晶胞如图,该晶体每个晶胞中的钛、氧原子个数比为_______ 。

(3)一种铜金合金晶胞如图所示( 原子位于顶角,
原子位于顶角, 原子位于面上),则该合金中
原子位于面上),则该合金中 原子与
原子与 原子个数之比为
原子个数之比为_______ ,若该晶胞的边长为 ,则合金的密度为
,则合金的密度为_______  (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
(1)钛在元素周期表中位于第
(2)某种钛氧化物晶体的晶胞如图,该晶体每个晶胞中的钛、氧原子个数比为

(3)一种铜金合金晶胞如图所示(
 原子位于顶角,
原子位于顶角, 原子位于面上),则该合金中
原子位于面上),则该合金中 原子与
原子与 原子个数之比为
原子个数之比为 ,则合金的密度为
,则合金的密度为 (只要求列算式,不必计算出数值,阿伏加德罗常数的值为
(只要求列算式,不必计算出数值,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
4 . 现在人们已经有多种方法来测定阿伏加德罗常数,X射线衍射法就是其中的一种。通过对金晶体的X射线衍射图像的分析,可以得出金晶体的晶胞如表、若金原子的半径为 ,金的密度为
,金的密度为 ,金的摩尔质量为
,金的摩尔质量为 ,试通过这些数据计算阿伏加德罗常数的数值
,试通过这些数据计算阿伏加德罗常数的数值______
 ,金的密度为
,金的密度为 ,金的摩尔质量为
,金的摩尔质量为 ,试通过这些数据计算阿伏加德罗常数的数值
,试通过这些数据计算阿伏加德罗常数的数值| 常见金属 | Ca、Al、Cu、Ag、Au、Pd、Pt | Li、Na、K、Ba、W、Fe | Mg、Zn、Ti |
| 结构示意图 |  |  |  |
您最近一年使用:0次
解题方法
5 . 已知铜的晶胞结构如图(a)所示。若铜原子的半径为1.29×10−10m,试求:

(1)每个晶胞中含有铜原子的个数为多少_______ ?
(2)铜晶体中晶胞的边长[即图(b)中AB的长度]为多少_______ ?

(1)每个晶胞中含有铜原子的个数为多少
(2)铜晶体中晶胞的边长[即图(b)中AB的长度]为多少
您最近一年使用:0次
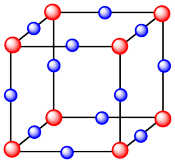
6 . 某离子化合物A3B的晶胞结构示意图如图所示。晶胞中与一个B相紧邻的A有____ 个,与一个A相紧邻的B有_____ 个。

您最近一年使用:0次
2022-11-25更新
|
102次组卷
|
2卷引用:苏教2020版选择性必修2专题3第二单元 离子键 离子晶体课后习题
7 . 金属晶体中金属原子有三种常见的堆积方式:简单立方堆积、面心立方堆积和体心立方堆积,图a、b、c分别代表这三种晶胞的结构。请回答下列问题:

(1)a、b、c三种晶胞内金属原子数目之比为_______ 。
(2)三种堆积方式的实质是金属阳离子的堆积方式,那么自由电子有无确切的堆积方式?_______ (填“有”或“无”)。
(3)影响金属晶体熔点的主要因素是_______ 。

(1)a、b、c三种晶胞内金属原子数目之比为
(2)三种堆积方式的实质是金属阳离子的堆积方式,那么自由电子有无确切的堆积方式?
(3)影响金属晶体熔点的主要因素是
您最近一年使用:0次
2022-11-25更新
|
224次组卷
|
3卷引用:苏教2020版选择性必修2专题3第一单元 金属键 金属晶体课后习题
8 . 铁及铁的化合物在生产、生活中有广泛应用。请回答下列问题:
(1)基态 的最外层电子排布式为:
的最外层电子排布式为:________ 。
(2)工业上常利用 与
与 形成稳定
形成稳定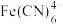 ;(六氰合亚铁离子)的特性来处理含
;(六氰合亚铁离子)的特性来处理含 的工业废水。在
的工业废水。在 中C原子的杂化方式为
中C原子的杂化方式为_______ ,写出 的电子式:
的电子式:_______ 。
(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为_______ 。

(4)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中黑色小球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为_______ 。

(1)基态
 的最外层电子排布式为:
的最外层电子排布式为:(2)工业上常利用
 与
与 形成稳定
形成稳定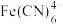 ;(六氰合亚铁离子)的特性来处理含
;(六氰合亚铁离子)的特性来处理含 的工业废水。在
的工业废水。在 中C原子的杂化方式为
中C原子的杂化方式为 的电子式:
的电子式:(3)三氯化铁易溶于水,也易溶于乙醚等有机溶剂。它在300℃以上易升华,在400℃时其蒸气中有以配位键结合的双聚分子存在,其结构如图所示。请判断三氯化铁的晶体类型为

(4)应用于合成氨反应的催化剂(铁)的表面上存在氮原子,如图为氮原子在铁的晶面上的单层附着局部示意图(图中黑色小球代表氮原子,灰色球代表铁原子)。则图示铁颗粒表面上氮原子与铁原子的个数比为

您最近一年使用:0次
解题方法
9 . 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____ 。元素Mn与O中,第一电离能较大的是____ ,基态原子核外未成对电子数较多的是____ 。
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为____ ,原因是____ 。
(3)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为____ nm。MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为____ nm。

(1)Co基态原子核外电子排布式为
(2)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为
(3)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为

您最近一年使用:0次
解题方法
10 . 我国有丰富的海水资源,海水中的元素共含有80多种,总储量很大。常量元素包括H、B、C、O、F、Na、Mg、S、Cl、K、Ca、Br、Sr等13种元素,同时还含有Cr、Mn、Fe、Ni、Cu、Zn等微量元素,因此开发利用海水资源具有非常广阔的前景。
(1)Sr元素在元素周期表中的位置是___ 。
(2)上述元素能形成众多微粒,其中CO 的中心原子价层电子对数为
的中心原子价层电子对数为___ 对,SO 的空间构型为
的空间构型为___ ,CH3COOH中C的杂化方式为___ 。
(3)已知钠的晶胞棱长为apm,NA为阿伏加德罗常数的值,钠的晶胞结构如图,则其密度为___ g/cm3。

(1)Sr元素在元素周期表中的位置是
(2)上述元素能形成众多微粒,其中CO
 的中心原子价层电子对数为
的中心原子价层电子对数为 的空间构型为
的空间构型为(3)已知钠的晶胞棱长为apm,NA为阿伏加德罗常数的值,钠的晶胞结构如图,则其密度为

您最近一年使用:0次



