1 . 设  为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是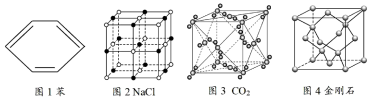
A.每摩尔苯中含有碳碳双键的数目为  |
B. 晶体中含有 晶体中含有  分子的数目为 分子的数目为  |
C. (干冰) 晶胞中含有的共用电子对的数目为 (干冰) 晶胞中含有的共用电子对的数目为  |
D. 金刚石含有的碳碳单键的数目为 金刚石含有的碳碳单键的数目为  |
您最近一年使用:0次
2 . 下面有关晶体的叙述中,不正确的是
A.氯化钠晶体中,每个 周围距离相等的 周围距离相等的 共有6个 共有6个 |
| B.金刚石为空间网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子 |
C.氯化铯晶体中,每个 周围紧邻8个 周围紧邻8个 |
D.干冰晶体中,每个 分子周围紧邻12个 分子周围紧邻12个 分子 分子 |
您最近一年使用:0次
2023-10-09更新
|
183次组卷
|
2卷引用:四川省盐亭中学2022-2023学年高二上学期期中教学质量监测(理科)化学试题
解题方法
3 . 短周期元素X、Y、Z、W中,X元素的原子最外层电子排布为ns1,Y元素的原子价电子排布为ns2np2,Z元素的最外层电子数是其电子层数的3倍,W元素原子的M电子层的p能级中有3个未成对电子。
(1)Z原子的电子排布式为___________ ,若X为非金属元素,则按原子轨道的重叠方式,X与Z形成的化合物中的共价键属于___________ 键(填“σ”或“π”)。
(2)当n=2时,Y在元素周期表的位置为___________ ,YZ2属于___________ 分子(填“极性”或“非极性”)。
(3)当n=3时,YZ2晶体属于___________ 晶体;YZ2晶体中Y原子与Y-Z键的数目之比为___________ 。
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(1)Z原子的电子排布式为
(2)当n=2时,Y在元素周期表的位置为
(3)当n=3时,YZ2晶体属于
(4)若X元素的原子最外层电子排布为2s1,Y元素的原子价电子排布为3s23p2,X、Y、Z、W四种元素的第一电离能由大到小的顺序是
您最近一年使用:0次
名校
解题方法
4 . 下列关于SiO2和金刚石的叙述正确的是
| A.SiO2的晶体结构中,每个Si原子与2个O原子直接相连 |
| B.通常状况下,1molSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数的值) |
| C.金刚石的网状结构中,由共价键形成的最小环上有6个碳原子 |
| D.1mol金刚石中含有4NA个C-C键(NA表示阿伏加德罗常数的值) |
您最近一年使用:0次
2023-01-13更新
|
1424次组卷
|
12卷引用:四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷
四川省成都市龙泉驿区教育科学研究院2021-2022学年高二下学期期中考试化学试卷甘肃省武威市凉州区2022-2023学年高二下学期期中考试化学试题2014-2015学年辽宁实验中学等五校高二下期末化学试卷(人教版2019)选择性必修2 第三章 晶体结构与性质 第二节 分子晶体与共价晶体 课时2 共价晶体(已下线)第43练 分子晶体与共价晶体-2023年高考化学一轮复习小题多维练(全国通用)吉林省通化市梅河口市第五中学2022-2023学年高二上学期期末考试化学试题(已下线)3.2.2 共价晶体-同步学习必备知识湖南省株洲市第一中学2022-2023学年高二下学期第一次月考化学试题湖北省宜昌英杰学校2022-2023学年高二3月月考化学试题黑龙江省哈尔滨市第四中学校2022-2023学年高二下学期4月月考化学试题(已下线)热点07 分子晶体与共价晶体3.2.2 共价晶体-随堂练习
12-13高二上·四川遂宁·期中
名校
解题方法
5 . 下列说法错误的是
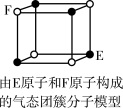
A.从CH4、 、 、 为正四面体结构,可推测PH 为正四面体结构,可推测PH 、 、 也为正四面体结构 也为正四面体结构 |
| B.1mol金刚石晶体中,平均含有2molC-C键 |
| C.水的沸点比硫化氢的高,是因为H2O分子间存在氢键,H2S分子间不能形成氢键 |
| D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE |
您最近一年使用:0次
2022-10-31更新
|
243次组卷
|
8卷引用:2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷
6 . 硅烷SiH4可用于制造高纯硅。采用硅化镁法制备SiH4的化学方程式如下:Mg2Si+4NH4Cl+8NH3=SiH4+2MgCl2·6NH3
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)①SiH4的电子式是___________ 。
②SiH4的沸点比CH4的___________ 。(填“高”或“低”),原因是___________ 。
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于___________ 晶体(填晶体类型),一种SiO2晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如图)。其中Si原子的杂化轨道类型是___________ 。___________ 个紧邻的Mg原子。已知Mg2Si的晶胞边长为acm,阿伏加德罗常数的值为NA,则Mg2Si晶体的密度为___________ g·cm-3。
(1)硅在元素周期表中的位置是
(2)①SiH4的电子式是
②SiH4的沸点比CH4的
(3)Mg2Si可由Mg和SiO2反应制得。晶体SiO2属于
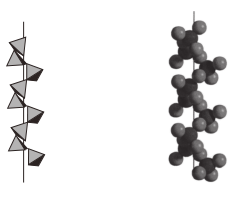
您最近一年使用:0次
2022-01-14更新
|
638次组卷
|
7卷引用:湖北省武汉市新洲区部分学校2022-2023学年高二下学期期中考试化学试题
解题方法
7 . 下列有关晶体的说法正确的有
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
①石英和金刚石都是共价晶体,最小环上都有6个原子
②在晶体中只要有阴离子就一定有阳离子
③金刚石、金刚砂、冰、干冰晶体的熔点依次降低
④石墨晶体中碳原子数和C-C键个数之比为1:2
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
| A.1项 | B.2项 | C.3项 | D.4项 |
您最近一年使用:0次
解题方法
8 . (1)碳可以形成CO、CO2、H2CO3等多种无机化合物。
①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是_______ (填字母)。

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是_______ (填字母)。
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为_______ ,写出一种与氨硼烷互为等电子体的分子_______ (填化学式)。
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式_______ 。
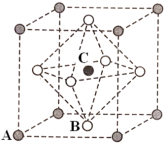
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于_______ 位置(填“顶点”,“体心”或“面心”)。晶胞有两种基本要素,其中一种是原子坐标参数,表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为(0.5,0.5,0),则C点的原子坐标参数为_______ 。

①国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,CO2原子晶体的晶胞如图所示,下列关于CO2的原子晶体说法正确的是

A.CO2原子晶体的熔点比SiO2晶体低
B.1molCO2原子晶体和1molCO2分子晶体均有2mol共价键
C.在一定条件下,CO2原子晶体转化为CO2分子晶体属于化学变化
②在反应CO转化成CO2的过程中,下列说法正确的是
A.每个分子中孤对电子数不变 B.分子极性变化 C.原子间成键方式改变
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为
(3)硼酸(B(OH)3)本身不能电离出H+,因在水中能生成[B(OH)4]-而体现弱酸性,请写出硼酸溶于水呈酸性的离子方程式
(4)Na3OCl是一种良好的离子半导体,Na3OCl晶体属于立方晶系,晶胞结构如图所示,Na3OCl晶胞中,Cl位于各顶点位置,则Na位于


您最近一年使用:0次
2021-04-30更新
|
233次组卷
|
2卷引用:福建省龙岩市长汀、连城、上杭、武平、漳平、永定六校(一中)2020-2021学年高二下学期期中联考化学试题
9 . 下面有 关晶体的叙述中,错误的是
| A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
| B.在CaF2晶体中每个Ca2+周围紧邻8个F-,每个F-周围紧邻4个Ca2+ |
| C.白磷晶体中,粒子之间通过共价键结合,键角为60° |
| D.离子晶体在熔化时,离子键被破坏;而分子晶体熔化时,化学键不被破坏 |
您最近一年使用:0次
2020-08-12更新
|
668次组卷
|
4卷引用:山东省青岛第一中学2022-2023学年高二下学期期中考试化学试题
山东省青岛第一中学2022-2023学年高二下学期期中考试化学试题辽宁省多校联盟2019-2020学年高二下学期期末考试化学试题(已下线)第32讲 晶体结构与性质(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第五章 物质结构与性质元素周期律 第31练 晶体结构与性质
10 . 非金属元素虽然种类不多,但是在自然界中的丰度却很大,请回答下列问题:
(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断:BN可能是______ 晶体,CO2可能是______ 晶体,BN 晶体中B原子的杂化轨道类型为______ ,干冰中C原子的杂化轨道类型为______

(2)分子极性:OF2______ H2O,键角:OF2______ H2O(填“>””或者“<”)
(3)金刚石和石墨都是碳元素的单质,但石墨晶体熔点比金刚石______ ,原因是______
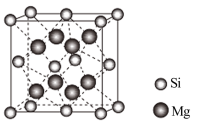
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构。在SiC结构中,每个C原子周围距离相等且最近的C原子数目为______ ,假设C-Si键长为acm,则晶胞密度为______ g/cm3。

(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断:BN可能是

(2)分子极性:OF2
(3)金刚石和石墨都是碳元素的单质,但石墨晶体熔点比金刚石
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC)结构。在SiC结构中,每个C原子周围距离相等且最近的C原子数目为

您最近一年使用:0次
2020-06-11更新
|
458次组卷
|
3卷引用:四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题



