1 . A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如表①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子。它们之间的转化关系如图②所示。
表①
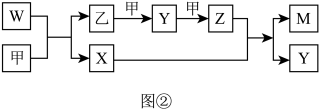
请回答下列问题:
(1)Z的化学式为___________ ;X分子的空间构型为___________ 。
(2)E的单质与水反应的离子方程式为___________ 。 D、E元素可分别与硅(Si)、钛(Ti)元素形成化合物,其中SiD2的熔点为1723℃,沸点2230℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是___________ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为___________ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为___________ ,该温度下的平衡常数为___________ 。
表①
| B | D | |
| E |

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近一年使用:0次
名校
解题方法
2 . 硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:___________ 。
②常温下,不能与R单质发生反应的是___________ (选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:___________ 。
②配平上述反应的化学方程式:___________ 。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
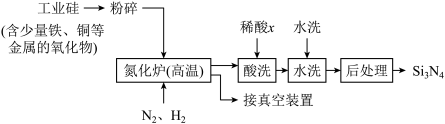
适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是___________ (选填:“盐酸”“硝酸”或“硫酸”),理由是___________ 。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:
②常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2
 Si3N4+CO
Si3N4+CO①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:
②配平上述反应的化学方程式:
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是
您最近一年使用:0次
3 . 电子科技大学孙旭平教授团队报道了一种磷化硼纳米颗粒作为高选择性 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
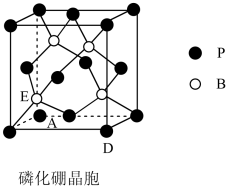
(1)氮化硼与磷化硼具有相似的结构,比较BN晶体和BP晶体的熔点高低并说明原因:_______ 。
(2)磷化硼晶体中与硼原子距离最近且相等的硼原子数为_______ 。
(3)若图中A处磷原子坐标为 ,D处磷原子坐标为
,D处磷原子坐标为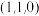 ,则E处的硼原子坐标为
,则E处的硼原子坐标为_______ 。
(4)已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为 ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为_______  。
。
 电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
电化学还原为甲醇的非金属电催化剂。磷化硼熔点特别高,处于极高温的空气环境时也具有抗氧化作用。其晶胞结构如图所示:
(1)氮化硼与磷化硼具有相似的结构,比较BN晶体和BP晶体的熔点高低并说明原因:
(2)磷化硼晶体中与硼原子距离最近且相等的硼原子数为
(3)若图中A处磷原子坐标为
 ,D处磷原子坐标为
,D处磷原子坐标为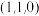 ,则E处的硼原子坐标为
,则E处的硼原子坐标为(4)已知磷化硼晶胞中A处磷原子与D处磷原子间的距离为
 ,则硼原子与最近磷原子的核间距为
,则硼原子与最近磷原子的核间距为 。
。
您最近一年使用:0次
4 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
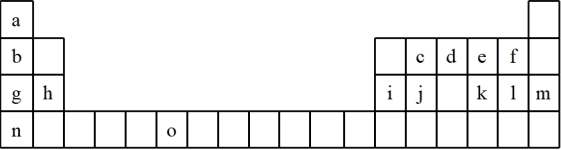
(1)请写出元素“o”的基态原子的价电子排布式_______ 。
(2)k在空气中燃烧产物的分子构型为_______ ,中心原子的杂化形式为_______ ,该分子是_______ (填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)_______ ,试从结构角度加以解释_______ 。
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为_______ 。
②该晶体的密度为_______ g/cm3。

(1)请写出元素“o”的基态原子的价电子排布式
(2)k在空气中燃烧产物的分子构型为
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是(写化学式)
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为
②该晶体的密度为
您最近一年使用:0次
名校
5 . 回答下列问题:
(1)SiC晶体结构同金刚石相似,SiC晶体熔点_______ (填“高于”或“低于”)金刚石熔点,SiC晶体中最小环上有_______ 个C原子。
(2)PCl3分子的空间构型为_______ ,其中心原子的杂化方式为_______ 。
(3)用一种试剂鉴别苯酚溶液、乙醛溶液、己烷、己烯四种无色液体,该试剂为_______ (填名称)。
(4)短周期元素X、Y、Z原子序数依次增大。X是周期表中原子半径最小的元素。Y原子核外电子有六种不同的运动状态。Z基态原子核外L层有2个未成对的电子,则由X、Y、Z能组成的化合物可能为_______。
(5) 的结构如图:
的结构如图:

① 中S—O—O
中S—O—O_______ (填“是”或“不是”)在一条直线上。
② 中的O—O比H2O2中的更
中的O—O比H2O2中的更_______ (填“难”或“易”)断裂。
(1)SiC晶体结构同金刚石相似,SiC晶体熔点
(2)PCl3分子的空间构型为
(3)用一种试剂鉴别苯酚溶液、乙醛溶液、己烷、己烯四种无色液体,该试剂为
(4)短周期元素X、Y、Z原子序数依次增大。X是周期表中原子半径最小的元素。Y原子核外电子有六种不同的运动状态。Z基态原子核外L层有2个未成对的电子,则由X、Y、Z能组成的化合物可能为_______。
| A.X2YZ | B.X2YZ4 | C.X2Y2Z4 | D.XYZ3 |
 的结构如图:
的结构如图:
①
 中S—O—O
中S—O—O②
 中的O—O比H2O2中的更
中的O—O比H2O2中的更
您最近一年使用:0次
解题方法
6 . 碳族元素中的碳、硅、锗及其化合物在诸多领域有重要用途。
(1)碳族元素位于周期表_______ 区,基态锗原子外围电子的轨道表示式为_______ ,基态锗原子核外有_______ 种空间运动状态不同的电子。
(2)科学家以 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是_______ 。
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:
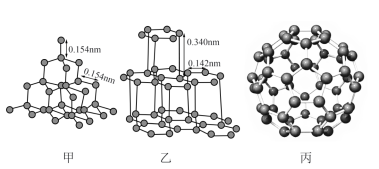
①12g金刚石和石墨中含有的σ键数目之比为_______ 。
②金刚石的熔点高于C60,但低于石墨,原因是_______ 。
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是_______ 。
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:
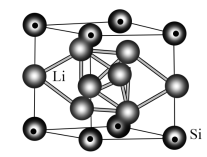
①该晶体的化学式为_______ 。
②若晶胞参数为apm,该晶体的密度ρ=_______  。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
(1)碳族元素位于周期表
(2)科学家以
 、
、 等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。
等双吡唑有机物为原料,制备了可去除痕量苯的吸附剂。 和
和 结构中含氮碳环均为平面结构,则N的杂化方式是
结构中含氮碳环均为平面结构,则N的杂化方式是
(3)金刚石(甲)、石墨(乙)、C60(丙)的结构如下图所示:

①12g金刚石和石墨中含有的σ键数目之比为
②金刚石的熔点高于C60,但低于石墨,原因是
③C60的晶胞呈分子密堆积,下列晶体中,与C60具有相同晶体结构的是
A.CO2 B.冰 C.Zn D.Ag E.NaCl
(4)一种低温超导体立方晶胞结构如下图所示:

①该晶体的化学式为
②若晶胞参数为apm,该晶体的密度ρ=
 。(列出计算式即可,设NA表示阿伏加德罗常数的值)
。(列出计算式即可,设NA表示阿伏加德罗常数的值)
您最近一年使用:0次
解题方法
7 . 单质硼的硬度近似于金刚石,有很高的电阻。但它的导电率随温度的升高而增大,高温时为良导体。硼在自然界中主要以硼酸和硼酸盐的形式存在。
(1)基态硼原子的价电子排布式为_______ ,晶体硼的熔沸点_______ (填“高于”或“低于”)金刚石,原因是_______ 。
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为_______ ,O原子的杂化类型为_______ ,B原子与相连的3个O原子围成的图形为_______ ,第一电离能介于硼元素和氧元素之间的第二周期元素有_______ 种。

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为_______ ,晶胞密度为_______ (写出表达式即可)。

(1)基态硼原子的价电子排布式为
(2)硼酸与氢氧化钠在一定条件下可以生成四硼酸钠,结构如图所示,四硼酸钠中含有的化学键类型为

(3)硼和氮可以构成多种类型的晶体,其中一种晶体的晶胞如图所示,晶胞上下底面均为菱形,晶胞参数如图所示,该晶体的化学式为

您最近一年使用:0次
解题方法
8 . A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于第Ⅷ族,在地壳中含量排金属中第二位。
(1)F2+的价电子排布图为_______ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为_______ ,等物质的量B、C、D的这种氢化物的分子中含有σ键的个数之比为_______ 。
(4)D常见的两种单质D2和D3,其中_______ (填化学式)在水中的溶解度更大。
(5)B、E可形成分子式为BE2的化合物,其电子式为_______ 。
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为_______ , 预测该化合物熔点_______ 金刚石(填“高于”或“低于”)。
(1)F2+的价电子排布图为
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C、D的某些氢化物的分子中都含有18个电子,B的这种氢化物的中心原子杂化方式为
(4)D常见的两种单质D2和D3,其中
(5)B、E可形成分子式为BE2的化合物,其电子式为
(6)实验室合成一种由B和C两种元素形成的化合物,该化合物具有三维骨架结构,其中每个B原子与4个C原子形成共价键,每个C原子与3个B原子形成共价键。其化学式为
您最近一年使用:0次
9 . 硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为___________ ,晶体硅和碳化硅熔点较高的是___________ (填化学式);
(2) 与N-甲基咪唑
与N-甲基咪唑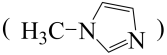 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为___________ ,1个 中含有
中含有___________ 个 键;
键;
(3)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为___________ ;晶胞中A、B间距离d=___________ pm。

(1)基态硅原子最外层的电子排布图为
(2)
 与N-甲基咪唑
与N-甲基咪唑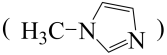 反应可以得到
反应可以得到 ,其结构如图所示:
,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为
 中含有
中含有 键;
键;(3)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(
 ,
, ,
, )。已知Xe—F键长为rpm,则B点原子的分数坐标为
)。已知Xe—F键长为rpm,则B点原子的分数坐标为
您最近一年使用:0次
名校
解题方法
10 . 碳族中的碳、硅、锗及其化合物在多领域有重要用途。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。 分子中存在
分子中存在___________ 个 键和
键和___________ 个 键,
键, 分子是
分子是___________ 分子(填“极性”或“非极性”)。
(3)关于 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述不正确 的是___________。
(4) 与
与 -甲基咪唑(
-甲基咪唑(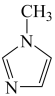 )反应可以得到
)反应可以得到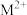 ,其结构如下图所示:
,其结构如下图所示:

 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有___________ 。
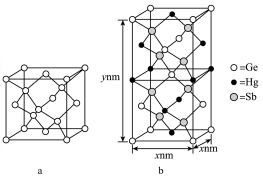
(5)汞( )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。注:
(列出计算式)。注:
(1)基态
 的电子排布式为
的电子排布式为(2)我国科学家研发的“液态阳光”计划是通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
 分子中存在
分子中存在 键和
键和 键,
键, 分子是
分子是(3)关于
 、
、 及其化合物的结构与性质,下列论述
及其化合物的结构与性质,下列论述A.键能 、 、 ,因此 ,因此 稳定性小于 稳定性小于 |
B. 是与金刚石结构相似的共价晶体,因此 是与金刚石结构相似的共价晶体,因此 具有较高的硬度 具有较高的硬度 |
C. 中 中 的化合价为 的化合价为 , , 中 中 的化合价为 的化合价为 ,因此 ,因此 还原性小于 还原性小于 |
D. 原子间难形成双键和三键而 原子间难形成双键和三键而 原子间可以,是因为 原子间可以,是因为 的原子半径大于 的原子半径大于 ,因此难以形成 ,因此难以形成 键 键 |
 与
与 -甲基咪唑(
-甲基咪唑( )反应可以得到
)反应可以得到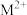 ,其结构如下图所示:
,其结构如下图所示:
 -甲基咪唑中碳原子的杂化轨道类型有
-甲基咪唑中碳原子的杂化轨道类型有(5)汞(
 )、锗(
)、锗( )、锑(
)、锑( )形成的一种新物质
)形成的一种新物质 为潜在的拓扑绝缘体材料。
为潜在的拓扑绝缘体材料。 的晶体(晶胞为下图
的晶体(晶胞为下图 )可视为
)可视为 晶体(晶胞为下图
晶体(晶胞为下图 )中部分
)中部分 原子被
原子被 和
和 取代后形成。
取代后形成。
 的最简式的相对分子质量为
的最简式的相对分子质量为 ,阿伏加德罗常数的数值为
,阿伏加德罗常数的数值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。注:
(列出计算式)。注:
您最近一年使用:0次



