1 . 某化学小组模拟工业生产原理:以废铁屑(含少量 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:
实验流程:
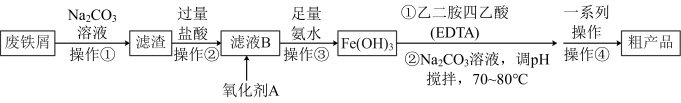
方案1:
(1)由 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择_________ (填“酒精灯直接加热”或“水浴加热”)。
(2)氧化剂A可以选择 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式___________ 。
(3)下列说法正确的是___________ 。
A.为避免 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水
B.该流程中两次用到 溶液,均可用
溶液,均可用 溶液代替
溶液代替
C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
(4)为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物___________ (填名称)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取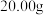 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的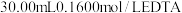 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用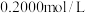 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。
已知: 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。
(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(7)计算铁元素的质量分数___________ 。
 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:

实验流程:
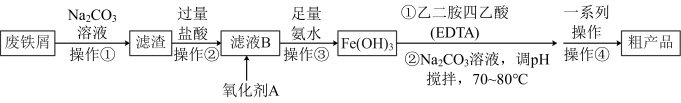
方案1:
(1)由
 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择(2)氧化剂A可以选择
 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式(3)下列说法正确的是
A.为避免
 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水B.该流程中两次用到
 溶液,均可用
溶液,均可用 溶液代替
溶液代替C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、
 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。(4)为使沉淀颗粒增大,实验中往往可以采取
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取
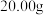 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的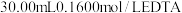 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用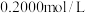 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。已知:
 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A.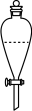 | B. | C.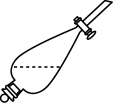 | D. |
(7)计算铁元素的质量分数
您最近一年使用:0次
解题方法
2 . 高纯硫酸锰作为合成镍钴锰三元聚合物锂电池的正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下图所示:
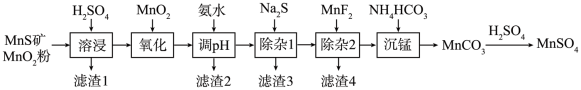
相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答:
(1)“溶浸”步骤中,可加快溶浸速率的措施有___________ (写两条)。
(2)下列有关该工艺流程的叙述正确的是___________。
(3)“除杂2”步骤的目的是生成MgF2沉淀从而除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,请从平衡移动的角度解释其原因___________ 。
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。______
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
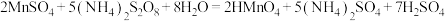
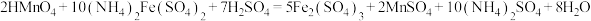 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
用___________ 称量 MnSO4样品0.250g→用100mL容量瓶将MnSO4样品配成100mL溶液→用___________ 取待测液25.00mL于锥形瓶中→加入适量硫磷混合酸和硝酸银,再加入足量过硫酸铵充分反应→加热煮沸除去多余的过硫酸铵→用酸式滴定管盛装0.1000mol/L(NH4)2Fe(SO4)2标准溶液,滴定3次,分别消耗20.04mL、19.30mL、19.96mL。
②根据以上数据计算样品中MnSO4的质量分数___________ 。

相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”步骤中,可加快溶浸速率的措施有
(2)下列有关该工艺流程的叙述正确的是___________。
| A.“溶浸”步骤中的“滤渣1”的主要成分是S和SiO2(或不溶性硅酸盐) |
| B.“氧化”步骤中添加的MnO2的作用是催化剂 |
| C.“调pH”步骤中,溶液的pH范围应调节为4.7~6 |
D.“沉锰”步骤的离子方程式为 |
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
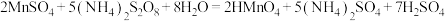
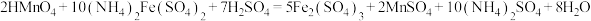 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:用
②根据以上数据计算样品中MnSO4的质量分数
您最近一年使用:0次
2022·浙江·模拟预测
解题方法
3 . 二氯异氰尿酸钠 是一种高效、安全的消毒剂,常温下为白色固体,20℃以上易溶于水。某研究团队在实验室中利用高浓度的NaClO溶液和
是一种高效、安全的消毒剂,常温下为白色固体,20℃以上易溶于水。某研究团队在实验室中利用高浓度的NaClO溶液和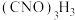 (氰尿酸,三元弱酸)固体反应制备二氯异氰尿酸钠,并测定产品中氯元素的含量。
(氰尿酸,三元弱酸)固体反应制备二氯异氰尿酸钠,并测定产品中氯元素的含量。
实验装置如图所示(部分夹持装置略)。

已知:
①
②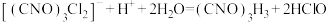
③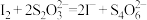
回答下列问题:
(1)装置A中盛放氯酸钾的仪器名称为___________ 。
(2)当装置B出现___________ 现象时,向B中加入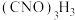 固体,在反应过程中仍需不断通入
固体,在反应过程中仍需不断通入 的目的是
的目的是___________ 。
(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是___________ 。
(4)反应结束后,装置B中的物质需经“过滤、洗涤”操作,此过程中主要除去的杂质为___________ (填化学式),洗涤操作过程中用___________ 洗涤,再经干燥得粗产品。
(5)为测定产品中氯元素的含量,请从下列选项中选出合理的选项,并对操作进行排序___________ :准确称取mg产品于锥形瓶中→(___________)→b→(___________)→(___________)→(___________)。
a、向锥形瓶中滴加2~3滴淀粉溶液
b、加入足量的KI溶液
c、加入约25mL蒸馏水,使产品完全溶解
d、加入25mL一定浓度的醋酸溶液(足量),使产品完全溶解
e、加入25mL一定浓度的盐酸溶液(足量),使产品完全溶解
f、洗涤酸式滴定管后装入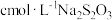 标准溶液,排气泡、调液面、记录读数
标准溶液,排气泡、调液面、记录读数
g、洗涤碱式滴定管后装入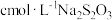 标准溶液,排气泡、调液面、记录读数
标准溶液,排气泡、调液面、记录读数
h、用 标准溶液滴定,消耗标准液VmL
标准溶液滴定,消耗标准液VmL
样品中氯元素的质量分数表达式为___________ 。
 是一种高效、安全的消毒剂,常温下为白色固体,20℃以上易溶于水。某研究团队在实验室中利用高浓度的NaClO溶液和
是一种高效、安全的消毒剂,常温下为白色固体,20℃以上易溶于水。某研究团队在实验室中利用高浓度的NaClO溶液和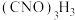 (氰尿酸,三元弱酸)固体反应制备二氯异氰尿酸钠,并测定产品中氯元素的含量。
(氰尿酸,三元弱酸)固体反应制备二氯异氰尿酸钠,并测定产品中氯元素的含量。实验装置如图所示(部分夹持装置略)。

已知:
①

②
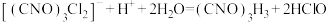
③
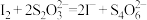
回答下列问题:
(1)装置A中盛放氯酸钾的仪器名称为
(2)当装置B出现
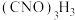 固体,在反应过程中仍需不断通入
固体,在反应过程中仍需不断通入 的目的是
的目的是(3)实验发现装置B中NaOH溶液的利用率较低,改进方法是
(4)反应结束后,装置B中的物质需经“过滤、洗涤”操作,此过程中主要除去的杂质为
(5)为测定产品中氯元素的含量,请从下列选项中选出合理的选项,并对操作进行排序
a、向锥形瓶中滴加2~3滴淀粉溶液
b、加入足量的KI溶液
c、加入约25mL蒸馏水,使产品完全溶解
d、加入25mL一定浓度的醋酸溶液(足量),使产品完全溶解
e、加入25mL一定浓度的盐酸溶液(足量),使产品完全溶解
f、洗涤酸式滴定管后装入
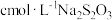 标准溶液,排气泡、调液面、记录读数
标准溶液,排气泡、调液面、记录读数g、洗涤碱式滴定管后装入
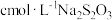 标准溶液,排气泡、调液面、记录读数
标准溶液,排气泡、调液面、记录读数h、用
 标准溶液滴定,消耗标准液VmL
标准溶液滴定,消耗标准液VmL样品中氯元素的质量分数表达式为
您最近一年使用:0次
2022·浙江·模拟预测
解题方法
4 . 铁矿石中含铁量的测定是铁元素提炼的基础和前提,目前主要采用重铬酸钾法测定铁矿石中的铁含量,其流程如图所示:

已知:已知:①氧化性顺序: >Fe3+>
>Fe3+> 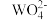 ;
;
②Sn在溶液中的主要存在形式为Sn2+和 ;
;
③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有_______ (任写两条)。
(2)“SnCl2还原”过程的离子反应方程式为_______ 。
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为_______ ,Na2WO4的作用为_______ 。
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是_______ 。
(5)“滴定”过程中,用移液管吸取一定体积待测液后,将移液管垂直放入稍倾斜的锥形瓶中,_______ ,数秒后,取出移液管。
(6)现称取m g铁矿石进行测定,“滴定”时共消耗V mL c mol·L−1 K2Cr2O7,则该铁矿石中铁的质量分数为_______ (用含m、c、V的代数式表示)。

已知:已知:①氧化性顺序:
 >Fe3+>
>Fe3+> 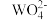 ;
;②Sn在溶液中的主要存在形式为Sn2+和
 ;
;③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有
(2)“SnCl2还原”过程的离子反应方程式为
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是
(5)“滴定”过程中,用移液管吸取一定体积待测液后,将移液管垂直放入稍倾斜的锥形瓶中,
(6)现称取m g铁矿石进行测定,“滴定”时共消耗V mL c mol·L−1 K2Cr2O7,则该铁矿石中铁的质量分数为
您最近一年使用:0次
名校
5 . 过硼酸钠(NaBO3·4H2O)可用于漂白剂及杀菌消毒。由硼镁矿(Mg2B2O5·H2O)制取过硼酸钠的过程及装置如下:

已知:I.过硼酸钠微溶于水,热水中不稳定;硼砂(Na2B4O7·10H2O)溶于水吸热,在水中的溶解度如图1所示。

Ⅱ.当pH高于10时,硼元素以BO 形式存在;当pH在9左右时,以
形式存在;当pH在9左右时,以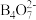 形式存在。
形式存在。
回答下列问题:
(1)步骤I中的化学方程式为___________ ;步骤II中通入CO2的目的是___________ ,操作②获得硼砂Na2B4O7·10H2O的方法是___________ ,过滤。
(2)步骤III回流反应时所进行的操作为:按图2组装好装置→___________ (填序号,下同)→打开磁力搅拌器→打开冷凝水→___________ 。

①用纸槽向c处加入硼砂;②打开a处旋塞加入双氧水;③c处加入氢氧化钠溶液④调低恒温水浴温度;⑤调高恒温水浴温度
(3)步骤IV中洗涤时选用乙醇,原因是___________ 。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥10%(1mol H2O2相当于1 mol活性氧原子)。已知:KMnO4不与H3BO3反应。为了确定所得产品是否合格,进行如下实验:称取0.2g干燥样品置于锥形瓶中,加少量水润湿,加入3mol·L-1 25.0 mL稀硫酸使试样全部溶解,产生过氧化氢,摇匀。用0.100mol·L-1高锰酸钾标准溶液滴定溶液的H2O2至终点,发生的反应为:KMnO4+H2O2+H2SO4→K2SO4+MnSO4+H2O+O2↑,三次滴定平均消耗KMnO4溶液6.40mL。配制100mL 0.100mol·L-1高锰酸钾标准溶液,用到的玻璃仪器除玻璃棒、胶头滴管和烧杯外,还有___________ ,若滴定前滴定管尖嘴处无气泡,滴定后出现气泡,会使测得的活性氧含量___________ (填“偏高”“偏低”或“不变”),活性氧的质量分数为___________ %(保留一位小数)。

已知:I.过硼酸钠微溶于水,热水中不稳定;硼砂(Na2B4O7·10H2O)溶于水吸热,在水中的溶解度如图1所示。

Ⅱ.当pH高于10时,硼元素以BO
 形式存在;当pH在9左右时,以
形式存在;当pH在9左右时,以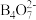 形式存在。
形式存在。回答下列问题:
(1)步骤I中的化学方程式为
(2)步骤III回流反应时所进行的操作为:按图2组装好装置→

①用纸槽向c处加入硼砂;②打开a处旋塞加入双氧水;③c处加入氢氧化钠溶液④调低恒温水浴温度;⑤调高恒温水浴温度
(3)步骤IV中洗涤时选用乙醇,原因是
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥10%(1mol H2O2相当于1 mol活性氧原子)。已知:KMnO4不与H3BO3反应。为了确定所得产品是否合格,进行如下实验:称取0.2g干燥样品置于锥形瓶中,加少量水润湿,加入3mol·L-1 25.0 mL稀硫酸使试样全部溶解,产生过氧化氢,摇匀。用0.100mol·L-1高锰酸钾标准溶液滴定溶液的H2O2至终点,发生的反应为:KMnO4+H2O2+H2SO4→K2SO4+MnSO4+H2O+O2↑,三次滴定平均消耗KMnO4溶液6.40mL。配制100mL 0.100mol·L-1高锰酸钾标准溶液,用到的玻璃仪器除玻璃棒、胶头滴管和烧杯外,还有
您最近一年使用:0次
2022-06-02更新
|
1609次组卷
|
3卷引用:浙江省东阳中学2023届高三浙江省普通高校招生选考科目考试仿真训练化学试题
解题方法
6 . 茶叶中有两种含量最多的功效成分,一是咖啡因,是一种生物碱,易溶于水、乙醇、氯仿,熔点234.5℃,100℃以上开始升华,有兴奋大脑神经和利尿等作用。二是茶多酚,易溶于水、乙醇、乙酸乙酯,难溶于氯仿,是一种天然抗氧化剂,在潮湿环境中更易被氧化。茶叶中除了有机成分外,还含有多种有益于人体健康的钙、镁、铁、铝等微量元素。
(1)实验室可通过下列简单方法从茶叶中提取咖啡因:


①实验时需将茶叶研细,研细的目的是___ 。
②下列说法正确的是___ 。
A.95%的乙醇也可换成水进行萃取,用生石灰可除去浓缩液中的水分
B.可用上右图所示装置提取咖啡因,索氏提取器的好处是使用溶剂少,可连续萃取
C.“蒸馏浓缩”所需的仪器有圆底烧瓶、蒸馏头、球形冷凝管、温度计、接收管
D.该流程中涉及的实验操作和方法只有蒸馏和萃取
(2)若要从茶叶中提取茶多酚 ,从下列选项中选出合理的操作(每个操作都要用到),并排序:___ 。
将茶叶研碎→(____)→(____)→浓缩液→(____)→(____)→(____)→粗产品
a.用乙酸乙酯多次萃取分液
b.用氯仿多次萃取分液
c.用水浸取并过滤
d.减压蒸发
e.减压蒸馏
(3)用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图所示,原因是___ 。

(4)某化学兴趣小组的同学设计实验来定量检验茶叶中Ca、Mg元素的含量,具体流程如图:

已知Ca2+、Mg2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Mg(OH)2:pH≥10.9;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
①仪器A的名称____ ;加热煮沸除了增大Ca2+与Mg2+浸出率外,还有___ 目的。
②从容量瓶中准确吸取试液25mL溶液置于250mL锥形瓶中,加入三乙醇胺5mL,再加入NH3∙H2O~NH4Cl缓冲溶液10mL,摇匀,最后加入铬黑T指示剂少许,用0.01mol∙L−1 EDTA标准溶液滴定至溶液由红紫色恰好变成纯蓝色,半分钟颜色不再变化,即达终点,三次平均消耗EDTA的体积为15.40mL,则茶叶中Ca、Mg的总量为以MgO的质量分数表示____ ,已知:Ca2+、Mg2+与EDTA反应均是1∶1反应)。
(1)实验室可通过下列简单方法从茶叶中提取咖啡因:


①实验时需将茶叶研细,研细的目的是
②下列说法正确的是
A.95%的乙醇也可换成水进行萃取,用生石灰可除去浓缩液中的水分
B.可用上右图所示装置提取咖啡因,索氏提取器的好处是使用溶剂少,可连续萃取
C.“蒸馏浓缩”所需的仪器有圆底烧瓶、蒸馏头、球形冷凝管、温度计、接收管
D.该流程中涉及的实验操作和方法只有蒸馏和萃取
(2)若要从茶叶中提取
将茶叶研碎→(____)→(____)→浓缩液→(____)→(____)→(____)→粗产品
a.用乙酸乙酯多次萃取分液
b.用氯仿多次萃取分液
c.用水浸取并过滤
d.减压蒸发
e.减压蒸馏
(3)用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图所示,原因是

(4)某化学兴趣小组的同学设计实验来定量检验茶叶中Ca、Mg元素的含量,具体流程如图:

已知Ca2+、Mg2+、Al3+、Fe3+完全沉淀的pH:Ca(OH)2:pH≥13;Mg(OH)2:pH≥10.9;Al(OH)3:pH≥5.5;Fe(OH)3:pH≥4.1。
①仪器A的名称
②从容量瓶中准确吸取试液25mL溶液置于250mL锥形瓶中,加入三乙醇胺5mL,再加入NH3∙H2O~NH4Cl缓冲溶液10mL,摇匀,最后加入铬黑T指示剂少许,用0.01mol∙L−1 EDTA标准溶液滴定至溶液由红紫色恰好变成纯蓝色,半分钟颜色不再变化,即达终点,三次平均消耗EDTA的体积为15.40mL,则茶叶中Ca、Mg的总量为以MgO的质量分数表示
您最近一年使用:0次
7 . 硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3。常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O 于 40~45℃熔化,48℃分解;
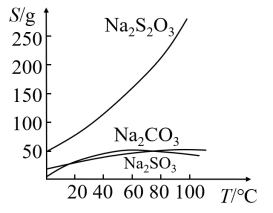
Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为_____________ ,装置6中可放入_____________ 。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2② Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④ Na2SO3+S Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通入SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________ (用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O 并测定含量:

(3)从热的反应混合液中获得 Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→________ →________ →________ →________ →获得Na2S2O3·5H2O粗晶体。
a.用冰水浴冷却结晶,抽滤; b.用少量水洗涤晶体、烘干;
c.80℃蒸发浓缩滤液至溶液表面出现晶膜; d.用乙醇洗涤晶体、晾干;
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊; f.趁热过滤。
(4)制得的粗晶体中往往含有少量杂质。为了测定粗产品中 Na2S2O3·5H2O的含量, 一般采用在酸性条件下用 KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.280 g的粗样品溶于水,用 0.4000 mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗 KMnO4溶液体积20.00 mL。 试回答:
①对于上述实验操作,下列说法正确的是_____ 。
A.用电子天平称量粗样品时,若电子天平未进行调平,则纯度偏高
B.装 KMnO4标准液的酸式滴定管洗涤后若未润洗,则纯度偏高
C.滴定至锥形瓶内溶液刚好由无色变为浅红色立即进行读数,则纯度偏高
D.滴定时若滴定速度过慢或摇晃锥形瓶过于剧烈,则纯度偏高
②产品中Na2S2O3·5H2O的质量分数为_____________ 。


Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图所示。
Ⅰ.现按如下方法制备Na2S2O3·5H2O:将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2=Na2SO3+CO2② Na2S+SO2+H2O=Na2SO3+H2S
③2H2S+SO2=3S↓+2H2O ④ Na2SO3+S
 Na2S2O3
Na2S2O3随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通入SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:
Ⅱ.分离Na2S2O3·5H2O 并测定含量:

(3)从热的反应混合液中获得 Na2S2O3·5H2O粗晶体,需经过下列实验步骤,请选择正确的选项:热的反应混合液→活性炭脱色并保温→
a.用冰水浴冷却结晶,抽滤; b.用少量水洗涤晶体、烘干;
c.80℃蒸发浓缩滤液至溶液表面出现晶膜; d.用乙醇洗涤晶体、晾干;
e.45℃蒸发浓缩滤液至溶液呈微黄色浑浊; f.趁热过滤。
(4)制得的粗晶体中往往含有少量杂质。为了测定粗产品中 Na2S2O3·5H2O的含量, 一般采用在酸性条件下用 KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。称取1.280 g的粗样品溶于水,用 0.4000 mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32-全部被氧化时,消耗 KMnO4溶液体积20.00 mL。 试回答:
①对于上述实验操作,下列说法正确的是
A.用电子天平称量粗样品时,若电子天平未进行调平,则纯度偏高
B.装 KMnO4标准液的酸式滴定管洗涤后若未润洗,则纯度偏高
C.滴定至锥形瓶内溶液刚好由无色变为浅红色立即进行读数,则纯度偏高
D.滴定时若滴定速度过慢或摇晃锥形瓶过于剧烈,则纯度偏高
②产品中Na2S2O3·5H2O的质量分数为
您最近一年使用:0次
名校
8 . 某学习小组以电路板刻蚀液(含有大量Cu2+、Fe2+、Fe3+)为原料制备纳米Cu20,制备流程如下:

已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4∙H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤Ⅱ,写出生成CuR2反应的离子方程式:____________________________
(2)步骤Ⅱ,需对水层多次萃取并合并萃取液的目的是___________________________
(3)步骤ⅢI,反萃取剂为_____________
(4)步骤Ⅳ,①制备纳米Cu2O时,控制溶液的pH为5的原因是_______________
A. B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是_________
③Cu2O干燥的方法是_________________
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为_______
②若无操作误差,测定结果总是偏高的原因是_____

已知:①Cu2O在潮湿的空气中会慢慢氧化生成CuO,也易被还原为Cu; Cu2O不溶于水,极易溶于碱性溶液;Cu2O+2H+ =Cu2++Cu+H2O。
②生成Cu2O的反应:4Cu(OH)2+N2H4∙H2O=2Cu2O+N2↑+7H2O
请回答:
(1)步骤Ⅱ,写出生成CuR2反应的离子方程式:
(2)步骤Ⅱ,需对水层多次萃取并合并萃取液的目的是
(3)步骤ⅢI,反萃取剂为
(4)步骤Ⅳ,①制备纳米Cu2O时,控制溶液的pH为5的原因是
A.
 B.
B.  C.
C. 
②从溶液中分离出纳米Cu2O采用离心法,下列方法也可分离Cu2O的是
③Cu2O干燥的方法是
(5)为测定产品中Cu2O的含量,称取3.960g产品于锥形瓶中,加入30mL硫酸酸化的Fe2(SO4)3溶液(足量),充分反应后用0.2000 mol·L-1标准KMnO4溶液滴定,重复2~3次,平均消耗KMnO4溶液50.00mL。
①产品中Cu2O的质量分数为
②若无操作误差,测定结果总是偏高的原因是
您最近一年使用:0次
2019-12-24更新
|
354次组卷
|
5卷引用:浙江省名校新高考研究联盟(Z20联盟)2020届高三第二次联考化学试题
解题方法
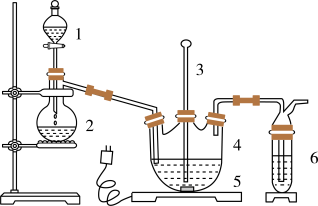
9 . 硫代尿素 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
步骤Ⅱ: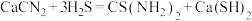
步骤Ⅲ: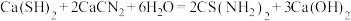
已知:硫代尿素 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚_________ (填仪器名称)。
(2)下列说法不正确的是_________。
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:________ 。
(_________)→(_________)→a→(_________)→e→f→(_________)
c.调节装置B温控磁力搅拌器,并控制温度为
d.调节装置B温控磁力搅拌器,并迅速控温在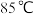
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的主要 操作是(请补上第一步):_________ →洗涤、合并滤液→冷冻结晶。
上述步骤中的最适宜洗涤剂是_________ 。
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应: ;
;
主要步骤:
Ⅰ.称取 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液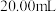 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用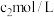 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定,近终点时,加 3mL淀粉指示液 ,继续滴定至终点,消耗体积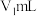 。
。
Ⅱ.空白实验:将上述样品溶液改为蒸馏水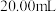 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。
①需要加入淀粉指示液时,锥形瓶中溶液的现象是_________ 。
②产品的质量分数为_________ 。
 是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:
是重要的工业原料.某小组按如图流程开展制备实验(部分装置及夹持仪器已省略)。主要反应:步骤Ⅱ:
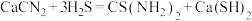
步骤Ⅲ:
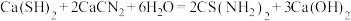
已知:硫代尿素
 可溶于水、乙醇,微溶于乙醚
可溶于水、乙醇,微溶于乙醚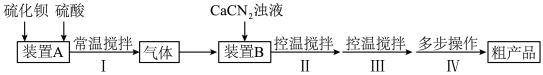
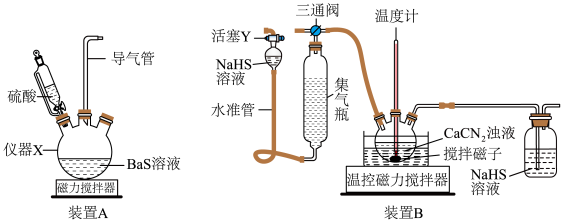
(2)下列说法不正确的是_________。
A.配制5%的 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 溶液必须用到的玻璃仪器有烧杯、玻璃棒、容量瓶等 |
| B.装置A使用恒压分液漏斗添加硫酸溶液时,可以打开漏斗上部的玻璃塞 |
C.在反应前若向装置B中通入一段时间 ,能提高产品的产率 ,能提高产品的产率 |
| D.步骤Ⅱ反应完全的现象是溶液变澄清,集气瓶液面不再改变 |
(3)步骤Ⅰ、Ⅱ、Ⅲ的部分操作如下,其正确的顺序是:
(_________)→(_________)→a→(_________)→e→f→(_________)
a.调节三通阀如图 ,收集气体一段时间
,收集气体一段时间
c.调节装置B温控磁力搅拌器,并控制温度为

d.调节装置B温控磁力搅拌器,并迅速控温在
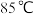
e.调节三通阀如图
g.检测气体纯净后连接三通阀
(4)步骤Ⅳ的
上述步骤中的最适宜洗涤剂是
A.冷水 B.热水 C.乙醚 D.滤液
(5)产品含量的测定:
滴定反应:
 ;
;
主要步骤:
Ⅰ.称取
 产品用蒸馏水溶解并定容至
产品用蒸馏水溶解并定容至 。移取该溶液
。移取该溶液 注入碘量瓶中,加
注入碘量瓶中,加 碘标准液,
碘标准液, 氢氧化钠溶液,于暗处放置
氢氧化钠溶液,于暗处放置 。加适量水及盐酸摇匀,用
。加适量水及盐酸摇匀,用 硫代硫酸钠标准溶液滴定,
硫代硫酸钠标准溶液滴定,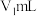 。
。Ⅱ.空白实验:将上述样品溶液改为蒸馏水
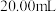 注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积
注入碘量瓶中,重复后续步骤,滴定至终点时消耗体积 。
。①需要加入淀粉指示液时,锥形瓶中溶液的现象是
②产品的质量分数为
您最近一年使用:0次
2024-04-01更新
|
395次组卷
|
4卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷02)-2024年高考押题预测卷(已下线)压轴题12 化学实验综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
2024高三下·全国·专题练习
10 . Cu元素在生命活动中占有举足轻重的地位,缺铜会造成贫血、记忆力减退、反应迟钝、运动失常等。设计如下实验制备有机补铜剂顺式甘氨酸合铜水合物并测定其组成。
查阅资料:
①制备反应为:
②该反应同时生成顺式产物(天蓝色针状)和反式产物(蓝紫色鳞片状),其反应进程如图所示:

制备有机补铜剂顺式甘氨酸合铜水合物实验过程为:


回答下列问题:
(1)步骤Ⅱ中控制反应温度为70℃的原因是___________ ,可采用的加热方式为___________ 。
(2)下列有关说法正确的是___________。
(3)用间接碘量法测定产物中Cu(Ⅱ)的质量分数。
已知:2Cu2++4I-=I2+2CuI↓ I2+2S2O =S4O
=S4O +2I-
+2I-
请选择以下正确的操作排序:
取2.0g所制备的产品,用稀硫酸溶解配成100mL溶液→a→___________ ,重复操作3次,消耗Na2S2O3标准液平均值为amL。
a.取25mL该溶液转移入锥形瓶
b.立即用酸式滴定管中0.01 molL-1Na2S2O3标准液快速进行滴定
c.立即用碱式滴定管中0.01 mol L-1Na2S2O3标准液快速进行滴定
d.当溶液变为浅黄色时,加入1mL淀粉溶液
e.加入蒸馏水和过量的KI溶液,得到棕黄色溶液
f.继续滴定至溶液蓝色恰好褪去
g.继续滴定至溶液由无色变为蓝色
根据实验数据,所得晶体中Cu(Ⅱ)质量分数为___________ ,若要提高产品的纯度,所用的实验方法名称是___________ 。
查阅资料:
①制备反应为:

②该反应同时生成顺式产物(天蓝色针状)和反式产物(蓝紫色鳞片状),其反应进程如图所示:

制备有机补铜剂顺式甘氨酸合铜水合物实验过程为:


回答下列问题:
(1)步骤Ⅱ中控制反应温度为70℃的原因是
(2)下列有关说法正确的是___________。
| A.CuSO4和NaOH快速生成的Cu(OH)2絮状沉淀易裹挟杂质,故不采用CuSO4和NaOH直接反应制备Cu(OH)2 |
| B.步骤Ⅲ中趁热过滤是为了防止杂质析出 |
| C.步骤Ⅳ加入95%的乙醇可以得到纯度更高的产品,说明顺式甘氨酸的极性大于反式甘氨酸 |
| D.步骤Ⅴ用25%酒精和丙酮分别洗涤晶体的目的是:25%酒精用于除去可溶性杂质(剩余反应物),丙酮用于除去晶体中残余的水 |
(3)用间接碘量法测定产物中Cu(Ⅱ)的质量分数。
已知:2Cu2++4I-=I2+2CuI↓ I2+2S2O
 =S4O
=S4O +2I-
+2I-请选择以下正确的操作排序:
取2.0g所制备的产品,用稀硫酸溶解配成100mL溶液→a→
a.取25mL该溶液转移入锥形瓶
b.立即用酸式滴定管中0.01 molL-1Na2S2O3标准液快速进行滴定
c.立即用碱式滴定管中0.01 mol L-1Na2S2O3标准液快速进行滴定
d.当溶液变为浅黄色时,加入1mL淀粉溶液
e.加入蒸馏水和过量的KI溶液,得到棕黄色溶液
f.继续滴定至溶液蓝色恰好褪去
g.继续滴定至溶液由无色变为蓝色
根据实验数据,所得晶体中Cu(Ⅱ)质量分数为
您最近一年使用:0次



