名校
1 . (1)NaHCO3是氨碱法和联合制碱法制纯碱的中间产物,在滤出小苏打后,母液提取氯化铵有两种方法:①通入氨,冷却、加食盐,过滤
②不通入氨,冷却、加食盐,过滤。两种方法中___________ (填编号) 析出的氯化铵纯度更高
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是___________ (填化学式)。写出产生白烟化学方程式___________ 。
(3)TiO2的熔沸点远高于CO2的原因是___________ ,MgTiO3的熔点高于BaTiO3的原因是___________ 。
(4)
②不通入氨,冷却、加食盐,过滤。两种方法中
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成份是
(3)TiO2的熔沸点远高于CO2的原因是
(4)
| 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| H2O(Br2) | ||
| 氯化镁溶液(氯化铁) |
您最近一年使用:0次
解题方法
2 . 亚氯酸钠( )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:

(1)饱和 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为_ 、_ 。
(2)写出“无隔膜电解”步骤发生反应的化学方程式____ 。
(3) 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是___________________ (填字母)
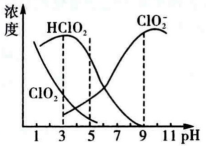
A. 在碱性条件下较稳定
在碱性条件下较稳定
B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c( )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)
(4) 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。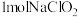 完全变质,理论上转移电子
完全变质,理论上转移电子_ mol。
(5)通过下列实验可测定所得 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: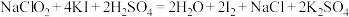 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的 溶液;
溶液;
②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。
计算该样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)__________ 。
 )是一种重要的含氯消毒剂。电解法生产
)是一种重要的含氯消毒剂。电解法生产 的部分工艺流程如下:
的部分工艺流程如下:
(1)饱和
 溶液由粗盐水精制而成,为除去粗盐水中的
溶液由粗盐水精制而成,为除去粗盐水中的 和
和 ,需加入的试剂分别为
,需加入的试剂分别为(2)写出“无隔膜电解”步骤发生反应的化学方程式
(3)
 在溶液中可生成
在溶液中可生成 、
、 、
、 等微粒,其中
等微粒,其中 和
和 都具有漂白作用,但
都具有漂白作用,但 是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
是毒性很大的的气体。25℃时各组分物质的量浓度随pH变化情况如下图所示,下列说法正确的是
A.
 在碱性条件下较稳定
在碱性条件下较稳定B. 25℃时,该溶液在pH=4时比pH=11时更适合漂白
C.pH=7时,溶液中含氯微粒浓度大小为:c(
 )>c(
)>c( )>e(
)>e( )>c(
)>c( )
)(4)
 可发生反应3
可发生反应3 =2
=2 +
+ 而变质。
而变质。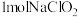 完全变质,理论上转移电子
完全变质,理论上转移电子(5)通过下列实验可测定所得
 产品的纯度,实验检测原理为:
产品的纯度,实验检测原理为: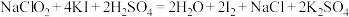 ;
;
①取1.000g样品,用适量蒸馏水溶解后,加入略过量的
 溶液;
溶液;②充分反应后,将反应液定容至200.00mL;
③取出20.00mL于锥形瓶中,向锥形瓶中滴加两滴淀粉溶液,用0.2000mol∙L-1的溶液
 与之反应,至恰好完全反应时消耗
与之反应,至恰好完全反应时消耗 溶液22.00mL。
溶液22.00mL。计算该样品中
 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
I.已知:① ②
② ③
③ ④
④ ⑤稀硫酸 ⑥硼酸 ⑦饱和
⑤稀硫酸 ⑥硼酸 ⑦饱和 溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
(1)属于电解质的是_______ 。(填数字序号)
(2) 具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出
具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出 在水中的电离方程式:
在水中的电离方程式:_______ 。
Ⅱ.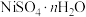 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备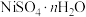 ,采用热重分析法测定所得
,采用热重分析法测定所得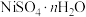 样品所含结晶水数。
样品所含结晶水数。
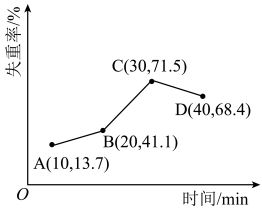
(3)将样品在900℃下进行锻烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为_______ ;C点产物的化学式为_______ 。
(4)高铁酸钾( ,
, 为
为 价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知
价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知 是紫色固体,可溶于水、微溶于浓
是紫色固体,可溶于水、微溶于浓 溶液。实验室可通过如下反应制取
溶液。实验室可通过如下反应制取 溶液:
溶液: (未配平)。
(未配平)。
①配平反应的方程式,并用单线桥表示电子转移的方向和数目_______ 。
②反应结束后,为从溶液中获得 晶体,可采取的实验操作是
晶体,可采取的实验操作是_______ 。
Ⅲ.锰酸锂离子蓄电池是第二代锂离子动力电池。锰酸锂可充电电池的总反应为 。
。
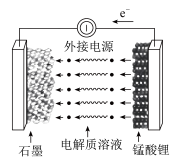
(5)充电时,电池的阳极反应式为_______ ,若此时转移
 ,则石墨电极将增重
,则石墨电极将增重_______ g。
(6)一种锰的硅化物的晶胞结构 如图所示:
如图所示:
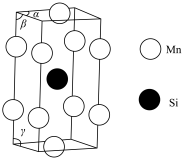
a.基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
b.该锰的硅化物的化学式为_______ 。
Ⅳ.我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
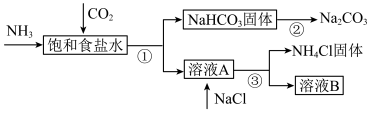
(7)饱和食盐水中通二氧化碳和氨气的离子方程式是_______ 。
(8)下列说法中合理的是_______(填标号)。
I.已知:①
 ②
② ③
③ ④
④ ⑤稀硫酸 ⑥硼酸 ⑦饱和
⑤稀硫酸 ⑥硼酸 ⑦饱和 溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:
溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。根据上述提供的物质,回答下列问题:(1)属于电解质的是
(2)
 具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出
具有一元弱酸的性质,在水中可产生正四面体结构的离子,写出 在水中的电离方程式:
在水中的电离方程式:Ⅱ.
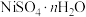 易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备
易溶于水,难溶于乙醇,其水溶液显酸性。从电镀污泥中可回收制备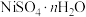 ,采用热重分析法测定所得
,采用热重分析法测定所得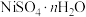 样品所含结晶水数。
样品所含结晶水数。
(3)将样品在900℃下进行锻烧,失重率随时间变化如图所示,A点时失掉2个结晶水,n的值为
(4)高铁酸钾(
 ,
, 为
为 价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知
价)是一种高效水处理剂,具有氧化能力强、安全性好等优点。已知 是紫色固体,可溶于水、微溶于浓
是紫色固体,可溶于水、微溶于浓 溶液。实验室可通过如下反应制取
溶液。实验室可通过如下反应制取 溶液:
溶液: (未配平)。
(未配平)。①配平反应的方程式,并用单线桥表示电子转移的方向和数目
②反应结束后,为从溶液中获得
 晶体,可采取的实验操作是
晶体,可采取的实验操作是Ⅲ.锰酸锂离子蓄电池是第二代锂离子动力电池。锰酸锂可充电电池的总反应为
 。
。
(5)充电时,电池的阳极反应式为

 ,则石墨电极将增重
,则石墨电极将增重(6)一种锰的硅化物的晶胞结构
 如图所示:
如图所示:
a.基态
 原子的核外电子排布式为
原子的核外电子排布式为b.该锰的硅化物的化学式为
Ⅳ.我国化学家侯德榜发明了联合制碱法,为世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。

(7)饱和食盐水中通二氧化碳和氨气的离子方程式是
(8)下列说法中合理的是_______(填标号)。
A.副产物 可用作氮肥 可用作氮肥 |
B.溶液B中的主要离子是 、 、 、 、 、 、 |
C.制碱流程中可回收并循环利用的物质只有碳酸氢钠分解产生的 |
| D.饱和食盐水中应该先通二氧化碳至饱和,再通入氨气至饱和 |
您最近一年使用:0次
名校
解题方法
4 . 戊二醛( )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
I.吡喃法制备戊二醛的反应步骤如下:
第一步:
第二步:CH2=CHCHO+CH2=CHOC2H5
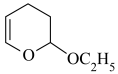
第三步: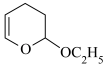

有关有机物性质如下表所示:
(1)分离第二步反应后混合物的方法是_______ 。
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出 与
与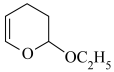 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①_______ 。
原因3:②_______ 。
(3)该制备过程中可循环使用的物质是_______ 。
Ⅱ.在某催化剂下,用环戊烯( )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
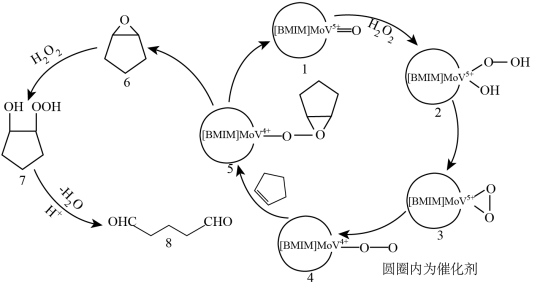
(4)过氧化氢氧化环戊烯的化学方程式为_______ 。
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:_______ 。
Ⅲ.测定戊二醛的含量:取 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺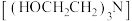 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。
以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液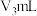 。
。
滴定过程中发生如下反应:
反应a: +
+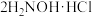 =
=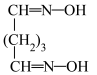 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)
反应b: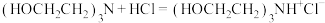
反应c: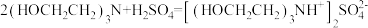
(6)该样品液中戊二醛的含量为_______  。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: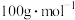 )
)
 )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。I.吡喃法制备戊二醛的反应步骤如下:
第一步:

第二步:CH2=CHCHO+CH2=CHOC2H5


第三步:


有关有机物性质如下表所示:
| 结构简式 | 溶解性 | 密度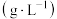 | 沸点( ) ) |
 | 溶于水 | 0.84 | 52.5 |
 | 微溶于水 | 0.753 | 33.0 |
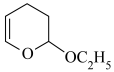 | 微溶于水 | 0.969 | 144.8 |
 | 溶于水 | 1.063 | 187.0 |
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出
 与
与 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①原因3:②
(3)该制备过程中可循环使用的物质是
Ⅱ.在某催化剂下,用环戊烯(
 )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
(4)过氧化氢氧化环戊烯的化学方程式为
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:
Ⅲ.测定戊二醛的含量:取
 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺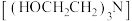 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液
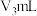 。
。滴定过程中发生如下反应:
反应a:
 +
+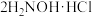 =
=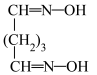 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)反应b:
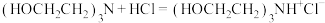
反应c:
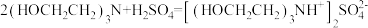
(6)该样品液中戊二醛的含量为
 。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: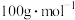 )
)
您最近一年使用:0次
2023-05-28更新
|
350次组卷
|
2卷引用:北京市十一学校2023届高三下学期三模化学试题
名校
解题方法
5 . 镁、铝、钙的某些化合物在生产、生活中有着重要应用。请按要求回答下列问题。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)除去固体产物中Al2O3的离子方程式为_________________ 。
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为_______________ 。
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1) 可循环使用的物质是______ 。工业生产中常选用过量的反应物是Ca(OH)2而不是H2O2,这是因为__________________ 。
(2) 检验CaO2·8H2O是否洗净的操作是________ 。
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)__________ 。
Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时有如下分解反应:2Mg5Al3(OH)19(H2O)4
 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3(1)除去固体产物中Al2O3的离子方程式为
(2)常温,MgO可溶于NH4Cl溶液的化学方程式为
Ⅱ.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体消毒剂。工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;②不断搅拌的同时加入30% H2O2溶液(弱酸性),生成CaO2·8H2O沉淀;③经过陈化、过滤、水洗得到CaO2·8H2O,再脱水干燥得到CaO2。
(1) 可循环使用的物质是
(2) 检验CaO2·8H2O是否洗净的操作是
(3) 测定产品中CaO2含量:取m g样品,与足量稀硫酸反应充分,生成的H2O2用c mol·L-1的KMnO4溶液滴定,消耗标准液的体积为V mL,则该样品中CaO2质量百分数为(含m、c、V的表达式)
您最近一年使用:0次
名校
6 . 钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如图(废料中含有Al、Li、Co2O3和Fe2O3 等物质)。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为______________________ 。如是氧化还原反应,在方程式中用单线桥标记电子转移:_________________________ 。如不是此步略。
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:_____________________ 。
(3)废渣中的主要成分除了LiF外,还有____________________ 。
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是___________________ 。
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
经测定,加热到210℃时,固体物质的化学式为__________________ 。加热到210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是_________________________ 。温度高于890℃时,固体产物发生分解反应,固体产物为________________ 。

已知:物质溶解性:LiF难溶于水,Li2CO3微溶于水
请回答:
(1)Ⅰ中发生反应的化学方程式为
(2)写出步骤Ⅰ中Co2O3 与盐酸反应生成Cl2的离子方程式:
(3)废渣中的主要成分除了LiF外,还有
(4) NaF与溶液中的Li+形成LiF 沉淀,此反应对步骤Ⅳ所起的作用是
(5)在空气中加热10.98g 草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。已知:M(CoC2O4·2H2O)= 183g/mol。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 8.82 |
| 290~320 | 4. 82 |
| 890~920 | 4.5 |
经测定,加热到210℃时,固体物质的化学式为
您最近一年使用:0次



