真题
解题方法
1 . (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______ 。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______ 。
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
您最近一年使用:0次
2021-06-15更新
|
3637次组卷
|
9卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题08.微粒间相互作用力-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
2 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
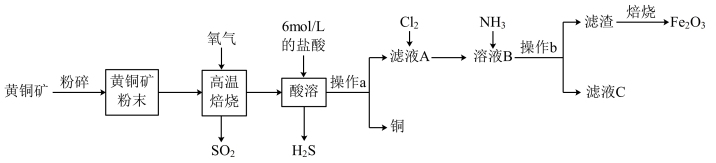
(1)将黄铜矿粉碎的目的是____ 。
(2)高温熔烧时发生的反应是CuFeS2+O2 SO2+FeS+Cu、1molO2参加反应时,反应中转移电子
SO2+FeS+Cu、1molO2参加反应时,反应中转移电子____ mol。
(3)操作a为____ 。
(4)向滤液A中通入Cl2的目的是____ 。
(5)向溶液B中通入NH3后发生反应的离子方程式为____ 。
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
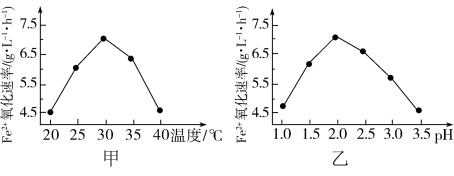
由图甲和图乙判断使用硫杆菌的最佳条件为___ ,若反应温度过高,反应速率下降,其原因是___ 。

(1)将黄铜矿粉碎的目的是
(2)高温熔烧时发生的反应是CuFeS2+O2
 SO2+FeS+Cu、1molO2参加反应时,反应中转移电子
SO2+FeS+Cu、1molO2参加反应时,反应中转移电子(3)操作a为
(4)向滤液A中通入Cl2的目的是
(5)向溶液B中通入NH3后发生反应的离子方程式为
(6)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
2022-06-16更新
|
1299次组卷
|
5卷引用:北京市第一七一中学2021-2022学年高一下学期6月月考化学试题
北京市第一七一中学2021-2022学年高一下学期6月月考化学试题河南省项城市第三高级中学2021-2022学年高二下学期期末考试化学试题(已下线)模拟卷02-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(已下线)模拟卷06-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)(已下线)模拟卷05-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
3 . 养殖业废水中含有一定量的氨氮(以 形式存在)污染物,通过沉淀法或折点氯化法处理后可使水中氨氮达到国家规定的排放标准。
形式存在)污染物,通过沉淀法或折点氯化法处理后可使水中氨氮达到国家规定的排放标准。
(1)沉淀法:向酸性废水中加入一定比例的 和
和 ,将氨氮转化为
,将氨氮转化为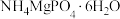 沉淀除去。
沉淀除去。
①该反应的离子方程式为___________ 。
②增大废水的 ,除生成
,除生成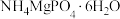 沉淀和
沉淀和 沉淀外,还可能生成另一沉淀的化学式为
沉淀外,还可能生成另一沉淀的化学式为___________ 。
(2)折点氯化法:向废水中加入 溶液,将氨氮最终转化为
溶液,将氨氮最终转化为 除去。
除去。 时,
时, 投加量
投加量 [即
[即 ]与水中余氯(即氧化性的氯,包括
]与水中余氯(即氧化性的氯,包括 、
、 、
、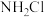 、
、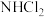 等)含量关系如图-1所示。
等)含量关系如图-1所示。

① 时发生反应的离子方程式为
时发生反应的离子方程式为___________ 。
②废水的 对氨氮去除率的影响如图-2所示。氨氮去除率在
对氨氮去除率的影响如图-2所示。氨氮去除率在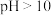 后迅速下降、
后迅速下降、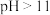 后下降变缓,其原因可能是
后下降变缓,其原因可能是___________ 。
(3)由于 不稳定,实验前需测定试剂
不稳定,实验前需测定试剂 溶液中有效氯含量(即单位体积溶液中含氯化合物作为消毒剂时,氧化能力相当的
溶液中有效氯含量(即单位体积溶液中含氯化合物作为消毒剂时,氧化能力相当的 的质量,单位
的质量,单位 )。取
)。取 市售待测
市售待测 溶液,加水稀释至
溶液,加水稀释至 ,用乙酸-乙酸钠溶液控制稀释液
,用乙酸-乙酸钠溶液控制稀释液 为3.5~4.2;加入过量
为3.5~4.2;加入过量 溶液充分反应后,滴加2~3滴淀粉溶液,用
溶液充分反应后,滴加2~3滴淀粉溶液,用 的标准
的标准 溶液滴定至终点,共消耗标准
溶液滴定至终点,共消耗标准 溶液
溶液 (已知:
(已知: )。计算该市售
)。计算该市售 溶液中有效氯含量
溶液中有效氯含量___________ (写出计算过程)。
 形式存在)污染物,通过沉淀法或折点氯化法处理后可使水中氨氮达到国家规定的排放标准。
形式存在)污染物,通过沉淀法或折点氯化法处理后可使水中氨氮达到国家规定的排放标准。(1)沉淀法:向酸性废水中加入一定比例的
 和
和 ,将氨氮转化为
,将氨氮转化为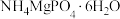 沉淀除去。
沉淀除去。①该反应的离子方程式为
②增大废水的
 ,除生成
,除生成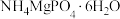 沉淀和
沉淀和 沉淀外,还可能生成另一沉淀的化学式为
沉淀外,还可能生成另一沉淀的化学式为(2)折点氯化法:向废水中加入
 溶液,将氨氮最终转化为
溶液,将氨氮最终转化为 除去。
除去。 时,
时, 投加量
投加量 [即
[即 ]与水中余氯(即氧化性的氯,包括
]与水中余氯(即氧化性的氯,包括 、
、 、
、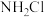 、
、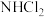 等)含量关系如图-1所示。
等)含量关系如图-1所示。
①
 时发生反应的离子方程式为
时发生反应的离子方程式为②废水的
 对氨氮去除率的影响如图-2所示。氨氮去除率在
对氨氮去除率的影响如图-2所示。氨氮去除率在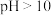 后迅速下降、
后迅速下降、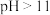 后下降变缓,其原因可能是
后下降变缓,其原因可能是(3)由于
 不稳定,实验前需测定试剂
不稳定,实验前需测定试剂 溶液中有效氯含量(即单位体积溶液中含氯化合物作为消毒剂时,氧化能力相当的
溶液中有效氯含量(即单位体积溶液中含氯化合物作为消毒剂时,氧化能力相当的 的质量,单位
的质量,单位 )。取
)。取 市售待测
市售待测 溶液,加水稀释至
溶液,加水稀释至 ,用乙酸-乙酸钠溶液控制稀释液
,用乙酸-乙酸钠溶液控制稀释液 为3.5~4.2;加入过量
为3.5~4.2;加入过量 溶液充分反应后,滴加2~3滴淀粉溶液,用
溶液充分反应后,滴加2~3滴淀粉溶液,用 的标准
的标准 溶液滴定至终点,共消耗标准
溶液滴定至终点,共消耗标准 溶液
溶液 (已知:
(已知: )。计算该市售
)。计算该市售 溶液中有效氯含量
溶液中有效氯含量
您最近一年使用:0次
2022高三·全国·专题练习
4 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:

回答下列问题:
(1)“酸浸氧化”发生的主要氧化还原反应的化学方程式为_______ 。
(2)“高温气相沉积”过程中发生的化学反应方程式为_______ 。

回答下列问题:
(1)“酸浸氧化”发生的主要氧化还原反应的化学方程式为
(2)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
名校
5 . Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=______ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用______ (填“Na2CO3”或“Na2S”)
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为______ mol·L-1(已知:Ksp(CdS)=7.9×10-27,Cd的相对原子质量为112);此时是否符合水源标准?______ (填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
(4)加入H2O2溶液的作用是______ 。
(5)流程图中,调节pH时,加入的试剂X可以是______ (填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到______ 。再将生成的氢氧化铁沉淀除去。
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:

| 金属离子 | Fe3+ | Zn2+ | Fe2+ |
| 开始沉淀的pH | 1.1 | 5.2 | 5.8 |
| 沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(4)加入H2O2溶液的作用是
(5)流程图中,调节pH时,加入的试剂X可以是
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到
您最近一年使用:0次
2023-11-10更新
|
810次组卷
|
3卷引用:广东省茂名市信宜市2023-2024学年高二上学期11月期中考试化学试题
6 . 从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO−、 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:
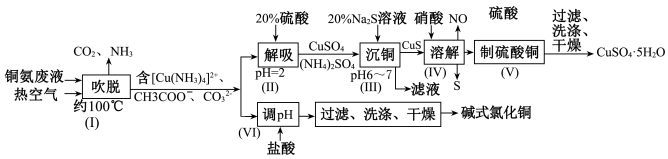
回答下列问题:
(1)步骤(Ⅰ)中被氧化的元素是_____________ ,由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的_____________ (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为_______________________ ,利用Na2S溶液而不选用NaOH溶液“沉铜”的优点是_______________________ 。
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为_____________ 。
(4)该流程中可以循环利用的物质是__________________________ (填化学式)。
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为__________________________ 。
 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:
回答下列问题:
(1)步骤(Ⅰ)中被氧化的元素是
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为
(4)该流程中可以循环利用的物质是
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为
您最近一年使用:0次
解题方法
7 . 按要求填空
(1)向CuCl2溶液中滴加NaOH溶液,现象:_________ ,离子方程式:_____ ,
(2)向NaHCO3溶液中滴加稀硫酸,现象:_____ ,离子方程式:_______ ;
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂_____ ,离子方程式;_____ 。
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂________ ,离子方程式__________ 。
(1)向CuCl2溶液中滴加NaOH溶液,现象:
(2)向NaHCO3溶液中滴加稀硫酸,现象:
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂
您最近一年使用:0次
2021-01-09更新
|
1977次组卷
|
5卷引用:贵州省安顺市大洋实验学校2020-2021学年高一上学期期中考试化学试题
名校
8 . 选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:___________ 。
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:___________ 。
(3)提取碘水中的碘:___________ 。
(4)除去混在乙烷中的乙烯:___________ 。
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:___________ 。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:
(3)提取碘水中的碘:
(4)除去混在乙烷中的乙烯:
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:
您最近一年使用:0次
2022-02-14更新
|
1647次组卷
|
5卷引用:2016-2017学年内蒙古集宁一中高二下月考二化学卷
2016-2017学年内蒙古集宁一中高二下月考二化学卷课前-1.2.1 有机化合物的分离、提纯-人教2019选择性必修3(已下线)第03讲 有机物的分离、提纯(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)(已下线)【知识图鉴】单元讲练测选择性必修3第1单元01讲核心安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题
9 . 氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为NiO,杂质为 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。

已知几种金属离子沉淀的pH如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣1的主要成分是_______ (填化学式)。
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式_______ 。
(4)“除铁”在40~50°C下进行,加入 的作用是
的作用是_______ , 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是_______ ,NaOH用于调节溶液的pH,应调节pH的范围是_______ 。
(5)NiOOH中Ni的化合价为_______ 。“氧化”中会有 生成,反应的离子方程式为
生成,反应的离子方程式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为_______ %(保留两位有效数字)。
 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。
已知几种金属离子沉淀的pH如表:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式
(4)“除铁”在40~50°C下进行,加入
 的作用是
的作用是 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是(5)NiOOH中Ni的化合价为
 生成,反应的离子方程式为
生成,反应的离子方程式为(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为
您最近一年使用:0次
2023高三·全国·专题练习
10 . 一种用软锰矿(主要成分是MnO2、Al2O3、SiO2)和黄铁矿(主要成分是FeS2、SiO2)为原料制取MnSO4溶液的流程如下:

(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为_______ 。
(2)“氧化”过程中发生反应的离子方程式为_______ 。

(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为
(2)“氧化”过程中发生反应的离子方程式为
您最近一年使用:0次



