名校
1 . 化学实验 化学是一门以实验为基础的学科。请回答以下问题:
(1)对下列事实的解释正确的是
(2)将盛有 12 mLNO2和O2混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL无色气体,则原混合气体中O2的体积是
(3)CuBr 是一种白色晶体,见光或潮湿时受热易分解。实验室制备CuBr的反应原理为SO2+2CuSO4+2NaBr+2H2O=2CuBr+2H2SO4+Na2SO4,用下列装置进行实验,不能达到实验目的的是

(4)实验室中要制取少量蒸馏水,其装置如下图所示:
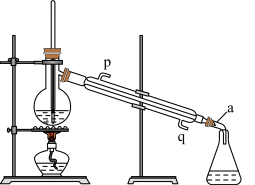
①仪器 a 的名称为_______ ,冷凝水应从_______ (选填“p”或“q”)口进入冷凝管。
②请指出图中装置的一处明显错误:_______ 。
③现需480 mL 0.1 mol/L 的CuSO4溶液,所需的玻璃仪器有烧杯、胶头滴管、_____ 、_____ ; 在配制过程中,需要用电子天平称取胆矾的质量为_______ g。
(5)某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置。实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸,反应即可连续发生。请完成下列空白。
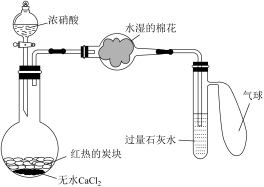
①烧瓶中反应的化学方程式为_______ ,烧瓶中的现象是_______ 。
②水湿棉花的作用是_______ ,气球的作用是_______ 。
(1)对下列事实的解释正确的是
| A.蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应 |
| B.医疗上可用硫酸钡作 X 射线透视肠胃的内服药,是因为硫酸钡不溶于酸 |
| C.向 50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量为0.45 mol |
| D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓硫酸不反应 |
| A.1.2mL | B.2.4 mL | C.3.6mL | D.4mL |

| A.用装置甲制取 SO2 | B.用装置乙制取 CuBr |
| C.用装置丙避光将 CuBr 与母液分离 | D.用装置丁干燥 CuBr |

①仪器 a 的名称为
②请指出图中装置的一处明显错误:
③现需480 mL 0.1 mol/L 的CuSO4溶液,所需的玻璃仪器有烧杯、胶头滴管、
(5)某校为了改进碳与浓硝酸反应的实验,设计了如图所示的装置。实验步骤:先预热盛有无水氯化钙的烧瓶,然后投入几小块红热的炭块,再缓缓向炭块上滴加浓硝酸,反应即可连续发生。请完成下列空白。

①烧瓶中反应的化学方程式为
②水湿棉花的作用是
您最近一年使用:0次
解题方法
2 .  法可用于吸收燃煤发电厂的
法可用于吸收燃煤发电厂的 ,同时获得产品
,同时获得产品 。反应的原理为:
。反应的原理为: 。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:
。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:
(1)搭建如图装置,先通入 。通入
。通入 的仪器采用干燥管替代长导管的目的是
的仪器采用干燥管替代长导管的目的是_______ ;然后通入 ,当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为
,当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为_______ ,不继续通入 直至过量的可能原因是
直至过量的可能原因是_______ 。

(2)已知 的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为
的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为_______ 和_______ ;实验时,烘干温度不易过高,其原因为_______ 。

(3)实验所得 的量较少,为提高其产量,工业上可采取的措施是
的量较少,为提高其产量,工业上可采取的措施是_______ 。(任写一条即可)
为了测定样品中 的纯度,进行实验。取1.500g硫酸铵在碱性溶液中反应,蒸馏出生成的氨气,用
的纯度,进行实验。取1.500g硫酸铵在碱性溶液中反应,蒸馏出生成的氨气,用 硫酸标准液吸收,再用氢氧化钠标准溶液滴定吸收氨气后过量的硫酸。
硫酸标准液吸收,再用氢氧化钠标准溶液滴定吸收氨气后过量的硫酸。
(4)若滴定时消耗了 的NaOH溶液20.00mL,则该硫酸铵产品的纯度为
的NaOH溶液20.00mL,则该硫酸铵产品的纯度为_______ %。
(5)若蒸馏出的氨气中含有较多水蒸气,则实验结果将_______ (选填“偏大”“偏小”或“无影响”)。
 法可用于吸收燃煤发电厂的
法可用于吸收燃煤发电厂的 ,同时获得产品
,同时获得产品 。反应的原理为:
。反应的原理为: 。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:
。实验室根据上述反应原理,模拟生产硫酸铵。完成下列填空:(1)搭建如图装置,先通入
 。通入
。通入 的仪器采用干燥管替代长导管的目的是
的仪器采用干燥管替代长导管的目的是 ,当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为
,当液体由红色变为浅红色时,立即停止实验,此时溶液的pH范围为 直至过量的可能原因是
直至过量的可能原因是
(2)已知
 的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为
的溶解度曲线如图。将反应后的混合液进行如下实验:过滤、蒸发浓缩、冷却结晶、过滤、洗涤烘干。两次过滤依次得到的物质分别为
(3)实验所得
 的量较少,为提高其产量,工业上可采取的措施是
的量较少,为提高其产量,工业上可采取的措施是为了测定样品中
 的纯度,进行实验。取1.500g硫酸铵在碱性溶液中反应,蒸馏出生成的氨气,用
的纯度,进行实验。取1.500g硫酸铵在碱性溶液中反应,蒸馏出生成的氨气,用 硫酸标准液吸收,再用氢氧化钠标准溶液滴定吸收氨气后过量的硫酸。
硫酸标准液吸收,再用氢氧化钠标准溶液滴定吸收氨气后过量的硫酸。(4)若滴定时消耗了
 的NaOH溶液20.00mL,则该硫酸铵产品的纯度为
的NaOH溶液20.00mL,则该硫酸铵产品的纯度为(5)若蒸馏出的氨气中含有较多水蒸气,则实验结果将
您最近一年使用:0次
2023-04-05更新
|
480次组卷
|
3卷引用:上海市浦东新区2022-2023学年高三下学期4月模拟质量调研化学试题
名校
解题方法
3 . 戊二醛( )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
I.吡喃法制备戊二醛的反应步骤如下:
第一步:
第二步:CH2=CHCHO+CH2=CHOC2H5
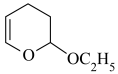
第三步: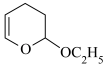
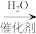

有关有机物性质如下表所示:
(1)分离第二步反应后混合物的方法是_______ 。
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出 与
与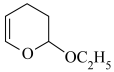 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①_______ 。
原因3:②_______ 。
(3)该制备过程中可循环使用的物质是_______ 。
Ⅱ.在某催化剂下,用环戊烯( )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
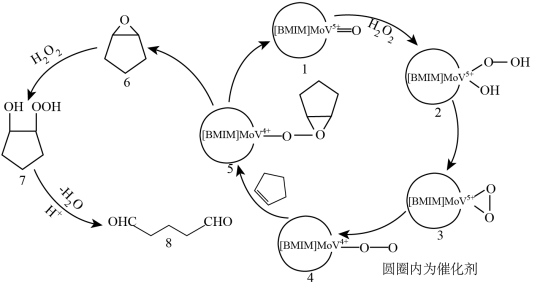
(4)过氧化氢氧化环戊烯的化学方程式为_______ 。
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:_______ 。
Ⅲ.测定戊二醛的含量:取 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺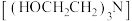 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。
以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液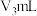 。
。
滴定过程中发生如下反应:
反应a: +
+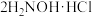 =
=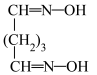 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)
反应b: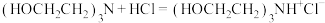
反应c: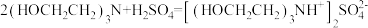
(6)该样品液中戊二醛的含量为_______  。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: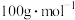 )
)
 )是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。
)是一种重要的化工中间体及精细化工产品,被广泛用作杀菌剂,还被应用于皮革工业、石油化工、造纸等领域。I.吡喃法制备戊二醛的反应步骤如下:
第一步:

第二步:CH2=CHCHO+CH2=CHOC2H5


第三步:


有关有机物性质如下表所示:
| 结构简式 | 溶解性 | 密度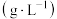 | 沸点( ) ) |
 | 溶于水 | 0.84 | 52.5 |
 | 微溶于水 | 0.753 | 33.0 |
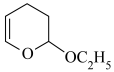 | 微溶于水 | 0.969 | 144.8 |
 | 溶于水 | 1.063 | 187.0 |
(2)第二步反应中有管道堵塞情况,分析原因。
原因1:产物在催化剂条件下发生开环聚合生成堵塞管道的物质。
原因2:反应物与产物反应生成堵塞管道的物质。写出
 与
与 发生类似第二步反应所生成产物的结构简式:①
发生类似第二步反应所生成产物的结构简式:①原因3:②
(3)该制备过程中可循环使用的物质是
Ⅱ.在某催化剂下,用环戊烯(
 )法制备戊二醛的反应途径如下图所示。
)法制备戊二醛的反应途径如下图所示。
(4)过氧化氢氧化环戊烯的化学方程式为
(5)已知过氧化氢用量过少、过多都降低戊二醛的选择性。请结合反应途径解释可能的原因:
Ⅲ.测定戊二醛的含量:取
 含戊二醛的样品液于
含戊二醛的样品液于 碘量瓶中。加入过量6.5%三乙醇胺
碘量瓶中。加入过量6.5%三乙醇胺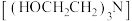 溶液
溶液 与盐酸羟胺
与盐酸羟胺 中性溶液
中性溶液 ,摇匀,静置反应
,摇匀,静置反应 。用
。用 硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液
硫酸标准液滴定。达到滴定终点时,消耗硫酸标准液 。
。以不含戊二醛的三乙醇胺、盐酸羟胺中性溶液重复上述操作,消耗硫酸标准液
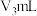 。
。滴定过程中发生如下反应:
反应a:
 +
+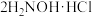 =
=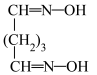 +2HCl+2H2O(反应较慢)
+2HCl+2H2O(反应较慢)反应b:
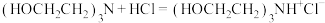
反应c:
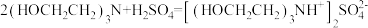
(6)该样品液中戊二醛的含量为
 。(戊二醛的摩尔质量:
。(戊二醛的摩尔质量: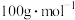 )
)
您最近一年使用:0次
2023-05-28更新
|
350次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期10月月考化学试卷
名校
解题方法
4 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴、碘单质等资源。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水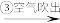 含溴空气
含溴空气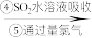 溴水混合物
溴水混合物 溴蒸气
溴蒸气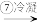 液溴
液溴
乙:苦卤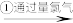 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的__________ 性。甲同学步骤④所发生反应的化学反应方程式为___________________ 。步骤④中SO2被氧化生成 ,写出检验
,写出检验 的方法
的方法___________________ 。
(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是_______ (填“甲”或“乙”),理由_____________________________________ 。
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)____________________ 。
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是_________ 。(选填编号)
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:
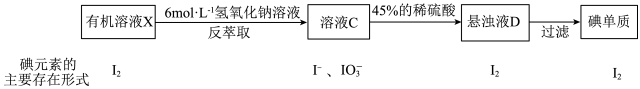
①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的_____________ 仪器(填名称)。
②相较于操作II,反萃取法的优点在于_______________ 。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴乙:苦卤
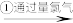 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的
 ,写出检验
,写出检验 的方法
的方法(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是
试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:

①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的
②相较于操作II,反萃取法的优点在于
您最近一年使用:0次
2022-12-14更新
|
758次组卷
|
2卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
5 . 溴元素和碘元素在工农业生产和日常生活中有着广泛应用。根据信息,完成下列填空。
Ⅰ.下图是从海水中提取粗溴的主要流程

(1)步骤①中,海水通过___________ (操作名称)、趁热过滤,得到苦卤;步骤②选用 作氧化剂,请写出发生反应的离子方程式
作氧化剂,请写出发生反应的离子方程式______ 。
(2)可用热空气吹出溴是因为溴的___________(选填编号)
(3)下列关于含溴化合物的用途说法错误的是___________(选填编号)
Ⅱ.实验小组从海带中提取碘
(4)将干海带经过浸泡、_____ (操作名称),得到滤液
(5)用如图所示的仪器提取碘水中的碘。该仪器名称为___________ ,该步操作的名称为___________ ;图示的提取剂可以是___________ (选填编号)。
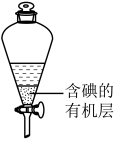
a.酒精b.苯c.四氯化碳d.醋酸
碘在该溶剂中显___________ 色
Ⅰ.下图是从海水中提取粗溴的主要流程

(1)步骤①中,海水通过
 作氧化剂,请写出发生反应的离子方程式
作氧化剂,请写出发生反应的离子方程式(2)可用热空气吹出溴是因为溴的___________(选填编号)
| A.熔点较低 | B.熔点较高 | C.沸点较低 | D.沸点较高 |
| A.食盐添加剂 | B.杀虫剂 | C.镇静剂 | D.感光材料 |
Ⅱ.实验小组从海带中提取碘
(4)将干海带经过浸泡、
(5)用如图所示的仪器提取碘水中的碘。该仪器名称为

a.酒精b.苯c.四氯化碳d.醋酸
碘在该溶剂中显
您最近一年使用:0次
2022-01-17更新
|
416次组卷
|
2卷引用:上海市金山区2021-2022学年高一上学期期末质量检测化学试题
2022高一·上海·专题练习
6 . 对知识的归纳和总结是学好化学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图所示),即氢氧化钙与图中四类物质能够发生化学反应。
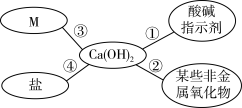
(1)图中M所属的物质类别是_______ 。
(2)氢氧化钙可由生石灰与水反应制得,该反应能_______ (填“吸收”或“放出”)热量。
(3)利用图中氢氧化钙能与_______ 反应的性质,可以解释“用石灰浆粉刷墙壁,干燥后墙面就变硬了”的现象。
(4)利用图中④氢氧化钙与盐反应的性质中,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该反应的化学方程式_______ 。

(1)图中M所属的物质类别是
(2)氢氧化钙可由生石灰与水反应制得,该反应能
(3)利用图中氢氧化钙能与
(4)利用图中④氢氧化钙与盐反应的性质中,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该反应的化学方程式
您最近一年使用:0次
名校
7 . 完成下列问题。
(1)欲提纯含少量MgSO4的KNO3固体试样,设计了以下流程:
试样
 滤液
滤液


 KNO3
KNO3
以上流程中所加入的试剂A、B、C分别应为:A_______ ,B_______ ,C_______ 。
(2)化工生产中Cl2来源于电解食盐水。电解精制饱和食盐水的化学方程式为_______ 。电解过程中,阳极反应为2Cl--2e﹣=Cl2↑,阴极反应为2H2O+2e-=2OH-+H2↑。则电解时阳极发生_______ (填“氧化”或“还原”)反应。
化工厂用氯气与氢氧化钙生产漂白粉。该厂出厂产品说明书如下:某化工厂用氯气与氢氧化钙生产漂白粉。该厂出厂产品说明书如下:

(3)漂白粉的有效成分是____ (填化学式)。生产漂白粉原理是(用化学方程式表示)____ 。
(4)“密封避光保存于阴凉处,随用随配”是因为漂白粉有效成分与空气中CO2、H2O反应生成不稳定的次氯酸而易失效。生成次氯酸的化学方程式为_______ 。
(5)某次配制中,取一定质量漂白粉溶解于1000g水中,所得溶液次氯酸钙和氯化钙的物质的量浓度均为0.01mol/L。假设漂白粉不含其它杂质,且所得溶液的体积仍为1L,则此次溶液配制中,所加漂白粉的质量为_______ g。
(6)工业上利用H2和Cl2生产盐酸时,采用氢气过量的原因是_______ 。
(7)在标准状况下,一定体积的氯化氢溶解在1L的水(设此温度下水的密度为1g/cm3)中,形成密度为1.159g/cm3的溶液,经测定该盐酸的物质的量浓度为10mol/L,那么该条件下,此1L水中溶解的氯化氢的体积为_______ L。(保留一位小数)
(1)欲提纯含少量MgSO4的KNO3固体试样,设计了以下流程:
试样

 滤液
滤液


 KNO3
KNO3以上流程中所加入的试剂A、B、C分别应为:A
(2)化工生产中Cl2来源于电解食盐水。电解精制饱和食盐水的化学方程式为
化工厂用氯气与氢氧化钙生产漂白粉。该厂出厂产品说明书如下:某化工厂用氯气与氢氧化钙生产漂白粉。该厂出厂产品说明书如下:

(3)漂白粉的有效成分是
(4)“密封避光保存于阴凉处,随用随配”是因为漂白粉有效成分与空气中CO2、H2O反应生成不稳定的次氯酸而易失效。生成次氯酸的化学方程式为
(5)某次配制中,取一定质量漂白粉溶解于1000g水中,所得溶液次氯酸钙和氯化钙的物质的量浓度均为0.01mol/L。假设漂白粉不含其它杂质,且所得溶液的体积仍为1L,则此次溶液配制中,所加漂白粉的质量为
(6)工业上利用H2和Cl2生产盐酸时,采用氢气过量的原因是
(7)在标准状况下,一定体积的氯化氢溶解在1L的水(设此温度下水的密度为1g/cm3)中,形成密度为1.159g/cm3的溶液,经测定该盐酸的物质的量浓度为10mol/L,那么该条件下,此1L水中溶解的氯化氢的体积为
您最近一年使用:0次
名校
解题方法
8 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。工业上用废铁生产FeSO4·7H2O的一种流程如图所示:
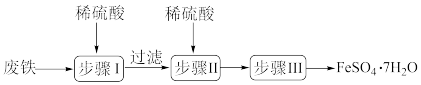
(1)步骤I中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:_______ 。
(2)证明步骤I滤液中只含有Fe2+的方法:取样,先滴加_______ ,再滴加_______ (填试剂名称),该过程的现象为_______ 。
(3)步骤III从硫酸亚铁溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的实验操作为蒸发浓缩、冷却结晶、_______ 、冰水洗涤、烘干。烘干操作需在低温条件下进行,原因是_______ 。
(4)取27.8gFeSO4·7H2O隔绝空气加热至不同温度,剩余固体的质量变化如下图所示。
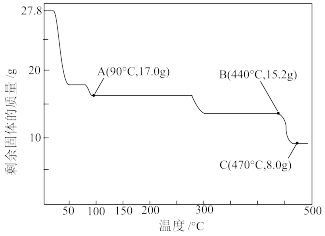
分析数据,写出90°C残留物的化学式_______ ;440°C~470°C时固体物质发生反应的化学方程式是_______ 。

(1)步骤I中除铁和硫酸、铁锈和硫酸反应外,还有一个反应的化学方程式为:
(2)证明步骤I滤液中只含有Fe2+的方法:取样,先滴加
(3)步骤III从硫酸亚铁溶液中获得硫酸亚铁晶体(FeSO4·7H2O)的实验操作为蒸发浓缩、冷却结晶、
(4)取27.8gFeSO4·7H2O隔绝空气加热至不同温度,剩余固体的质量变化如下图所示。

分析数据,写出90°C残留物的化学式
您最近一年使用:0次
2022-07-13更新
|
306次组卷
|
2卷引用:上海市川沙中学2021-2022学年高一下学期期末考试化学试题
名校
9 . 从太空遥望,地球是一颗蓝色星球,浩瀚的海洋覆盖了70%以上的地球表面。海洋可谓地球的“聚宝盆”,蕴藏着极为丰富的化学资源。氯、溴、碘等均可通过开发海洋资源获得。
(1)如图是某加碘食盐包装袋上的部分图表文字。由此你得到的信息和作出的推测是_______。

(2)新型冠状病毒由蛋白质外壳和单链核酸组成,直径为60-140 nm。下列说法错误的是_______。

(3)粗盐中存在 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是_______。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是_______。
①过量的 溶液 ②过量的
溶液 ②过量的 溶液 ③过量的NaOH溶液
溶液 ③过量的NaOH溶液
(4)我国著名实业家吴蕴初建设的天原化工厂为我国第一个氯碱厂,其生产原理即为电解饱和食盐水,阴极产物为_______ 。
(1)如图是某加碘食盐包装袋上的部分图表文字。由此你得到的信息和作出的推测是_______。

A.可以用酒精从该碘盐配制的溶液中萃取 |
| B.“烹调时待食品熟后加入碘盐”的原因可能是碘酸钾受热易分解 |
| C.1kg此食盐中含碘酸钾(35±15)mg |
| D.食用加碘盐的目的是预防龋齿 |

| A.新型冠状病毒扩散到空气中可能形成胶体 |
B.连花清瘟胶囊成分中的石膏 属于混合物 属于混合物 |
| C.止咳祛痰药:盐酸氨溴索中含有两种卤族元素 |
| D.“84”消毒液中含强氧化性物质,可用于新型冠状病毒的消杀 |
 、
、 、
、 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是_______。
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是_______。①过量的
 溶液 ②过量的
溶液 ②过量的 溶液 ③过量的NaOH溶液
溶液 ③过量的NaOH溶液| A.①②③ | B.②①③ | C.③②① | D.①③② |
您最近一年使用:0次
10 . 下图是实验室仿照工业分馏石油的装置,回答下列问题。

(1)指出图中a、b、c三种仪器的名称:a_____ 、b_____ 、c_____
(2)实验中在a仪器中应加入几片碎瓷片,其作用是_____
(3)冷却水从_____ 端进入
(4)就C6H14、C14H30、C17H36三种物质而言,蒸馏时最先收集到的_____

(1)指出图中a、b、c三种仪器的名称:a
(2)实验中在a仪器中应加入几片碎瓷片,其作用是
(3)冷却水从
(4)就C6H14、C14H30、C17H36三种物质而言,蒸馏时最先收集到的
您最近一年使用:0次



