真题
解题方法
1 . (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______ 。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______ 。
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
您最近一年使用:0次
2021-06-15更新
|
3660次组卷
|
9卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题08.微粒间相互作用力-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
2021高三·浙江·专题练习
2 . 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_______________________________________________________ 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
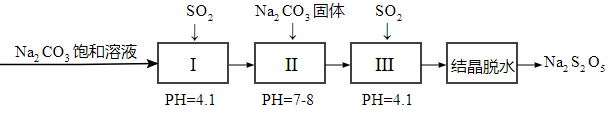
①pH=4.1时,Ⅰ中为________ 溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________________ 。
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为___________________________________________ ,该样品中Na2S2O5的残留量为____ g·L-1(以SO2计)。
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为
②工艺中加入Na2CO3固体、并再次充入SO2的目的是
(3)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为
您最近一年使用:0次
2021-03-13更新
|
1145次组卷
|
5卷引用:解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点31 化学实验与工艺流程-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)2021年高考全国甲卷化学试题变式题(已下线)题型53 多硫含氧酸盐的性质和用途
2021高三·浙江·专题练习
3 . 无色硫酸锌晶体,俗称皓矾,在医疗上用作收敛剂,工业上用作防腐剂、制造白色颜料(锌钡白)等。某实验小组欲用制氢废液制备硫酸锌晶体,进行了以下实验:
(1)取50 mL制氢废液,过滤。除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体。
①加入少量氧化锌调节滤液使pH≈2的目的是_________________________________ ;
②加热蒸发、浓缩溶液时,应加热到________ 时,停止加热。
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解。停止加热,让其自然冷却、结晶。抽滤(装置如图所示)。将所得晶体用少量无水乙醇洗涤1~2次,得到较纯的硫酸锌晶体。

①写出下列仪器的名称a________ ;b________ 。
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是___________________ 。
③用少量无水乙醇洗涤晶体的目的是___________________________ 。
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量________ (填“有”、“无”)影响,原因是___________________ 。
(1)取50 mL制氢废液,过滤。除去不溶性杂质后,用ZnO调节滤液使pH约等于2,加热、蒸发、浓缩制得较高温度下的硫酸锌饱和溶液,冷却结晶,得到粗制的硫酸锌晶体。
①加入少量氧化锌调节滤液使pH≈2的目的是
②加热蒸发、浓缩溶液时,应加热到
(2)粗晶体在烧杯中用适量蒸馏水溶解,滴加1~2滴稀硫酸,用沸水浴加热至晶体全部溶解。停止加热,让其自然冷却、结晶。抽滤(装置如图所示)。将所得晶体用少量无水乙醇洗涤1~2次,得到较纯的硫酸锌晶体。

①写出下列仪器的名称a
②抽滤跟普通过滤相比,除了得到沉淀较干燥外,还有一个优点是
③用少量无水乙醇洗涤晶体的目的是
(3)在制取氢气时,如果锌粒中混有少量的铁、铜杂质,对硫酸锌的质量
您最近一年使用:0次
4 . 现有A、B、C三种烃,其球棍模型如下图:

(1)等质量的以上三种物质完全燃烧时消耗 最多的是
最多的是___________ (填对应的字母,下同)。
(2)在120℃、 条件下,将以上三种烃和足量
条件下,将以上三种烃和足量 混合点燃,完全燃烧后恢复到相同条件,测得有些气体在反应前后气体总体积没有发生变化,满足条件的气体是
混合点燃,完全燃烧后恢复到相同条件,测得有些气体在反应前后气体总体积没有发生变化,满足条件的气体是___________ 。
(3)工业上合成一氯乙烷,应选___________ 为原料,反应的化学方程式为___________ 。
(4)要除去C中混有的B可以采用的方法是___________。

(1)等质量的以上三种物质完全燃烧时消耗
 最多的是
最多的是(2)在120℃、
 条件下,将以上三种烃和足量
条件下,将以上三种烃和足量 混合点燃,完全燃烧后恢复到相同条件,测得有些气体在反应前后气体总体积没有发生变化,满足条件的气体是
混合点燃,完全燃烧后恢复到相同条件,测得有些气体在反应前后气体总体积没有发生变化,满足条件的气体是(3)工业上合成一氯乙烷,应选
(4)要除去C中混有的B可以采用的方法是___________。
| A.将气体通过酸性高锰酸钾溶液 | B.将气体通过溴水 |
C.一定条件下,向混合气体中通入 | D.将气体通过溴的 溶液 溶液 |
您最近一年使用:0次
名校
解题方法
5 . 去除粗盐中少量K+、Ca2+、Mg2+和SO 精制盐的实验步骤如下:
精制盐的实验步骤如下:
I.取一定量粗盐于烧杯中,加蒸馏水搅拌,使粗盐全部溶解,得到粗盐水。
II.在粗盐水中加入适当过量的A溶液,使SO 完全沉淀;继续滴加适当过量的NaOH溶液,然后滴加过量的饱和Na2CO3溶液,静置后过滤,除去沉淀B,得到滤液。
完全沉淀;继续滴加适当过量的NaOH溶液,然后滴加过量的饱和Na2CO3溶液,静置后过滤,除去沉淀B,得到滤液。
III.向所得滤液加盐酸至溶液呈中性或微酸性,再蒸发至稠状 ,趁热过滤、热水洗涤、干燥,可得到去除杂质离子的精盐。
请回答:
(1)步骤II,试剂A是___ ;沉淀B的成分有___ (A、B均用化学式表示)。
(2)步骤III,检验溶液呈微酸性的实验方法是___ (不要求描述操作步骤和现象)。
(3)步骤III,将溶液蒸发至稠状的目的是_______ ;蒸发操作的主要仪器有酒精灯、三脚架、玻璃棒、坩埚钳、_______ 。
 精制盐的实验步骤如下:
精制盐的实验步骤如下:I.取一定量粗盐于烧杯中,加蒸馏水搅拌,使粗盐全部溶解,得到粗盐水。
II.在粗盐水中加入适当过量的A溶液,使SO
 完全沉淀;继续滴加适当过量的NaOH溶液,然后滴加过量的饱和Na2CO3溶液,静置后过滤,除去沉淀B,得到滤液。
完全沉淀;继续滴加适当过量的NaOH溶液,然后滴加过量的饱和Na2CO3溶液,静置后过滤,除去沉淀B,得到滤液。III.向所得滤液加盐酸至溶液呈中性或微酸性,再
请回答:
(1)步骤II,试剂A是
(2)步骤III,检验溶液呈微酸性的实验方法是
(3)步骤III,将溶液蒸发至稠状的目的是
您最近一年使用:0次
2022-12-07更新
|
490次组卷
|
2卷引用:2022年7月浙江省普通高中学业水平考试化学试题
名校
6 . 我国是世界产盐大国,海盐、湖盐和井盐的总产量居世界第二位。某同学进行粗盐的提纯并配制溶液、检验纯度实验。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。_______
将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)___________
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要___________
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,___________ ,再将容量瓶塞盖好,反复上下颠倒,摇匀。
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是___________ 。
(一)粗盐的提纯
(1)粗盐中含有泥沙、Ca2+、Mg2+、SO
 杂质,请选择合适的操作补全实验流程。
杂质,请选择合适的操作补全实验流程。将粗盐溶解→加入NaOH溶液→___________→___________→___________→___________→结晶得到精盐
加入稀盐酸 B.加入稀硫酸 C.过滤 D.加入BaCl2溶液 E.加入Na2CO3溶液
(2)以上流程中加酸的目的是(用离子方程式表示)
(二)一定浓度溶液的配制:用制得的精盐配制100 mL 1.00 mol/L NaCl溶液
(3)实验中用到的玻璃仪器,除了烧杯、量筒、胶头滴管外,还需要
(4)定容时的操作:当液面离容量瓶刻度线1~2cm时,
(5)下列操作会使配得的NaCl溶液浓度偏低的是___________。
| A.没有进行洗涤操作 |
| B.定容时俯视容量瓶的刻度线 |
| C.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线 |
| D.转移洗涤液时洒到容量瓶外,继续用该未清洗的容量瓶重新配制 |
(三)纯度测定
取25.00mL所配溶液于锥形瓶中,加入几滴K2CrO4溶液(指示反应终点),在不断摇动下,滴加1.00mol/L AgNO3溶液反应。平行测试3次,平均消耗AgNO3溶液23.50mL。
(6)制得的NaCl的纯度是
您最近一年使用:0次
2023-11-17更新
|
173次组卷
|
5卷引用:浙江省A9协作体2023-2024学年高一上学期期中联考化学试题
2021高三·浙江·专题练习
名校
解题方法
7 . 某酸性废液中含有Fe3+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对该废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
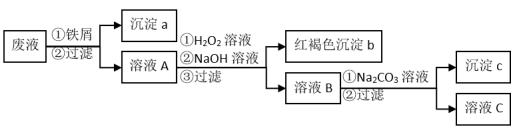
请回答:
(1)沉淀a中含有的单质是_____ 。
(2)沉淀c的化学式是_____ 。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_____ 。

请回答:
(1)沉淀a中含有的单质是
(2)沉淀c的化学式是
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是
您最近一年使用:0次
2021-10-19更新
|
347次组卷
|
3卷引用:专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)
(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)新疆柯坪县柯坪湖州国庆中学2021-2022学年高三上学期第一次月考化学试题新疆乌鲁木齐市第八中学2021-2022学年高一上学期第二次月考化学试题
23-24高二上·浙江·期末
8 . 氯化铁溶液常用作印刷电路铜板蚀刻液。请回答下列问题:
(1)常温下,若向某FeCl3溶液中加入一定量的澄清石灰水,调节溶液pH为4时,可得到红褐色沉淀,则溶液中Fe3+的物质的量浓度c(Fe3+)=_______ mol∙L−1。(已知:Ksp[(FeOH)3]=2.8×10−39)
(2)用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有Fe3+、Fe2+和Cu2+设计如图实验方案处理FeCl3溶液蚀刻铜板后的废液和资源回收。
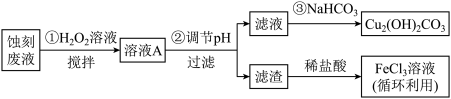
某些金属阳离子生成氢氧化物沉淀的pH如表:
①根据表中数据推测,步骤②应调节pH的范围是_______ ≤pH<_______ 。
②若步骤②中加入CuO调节pH,则反应的离子方程式为_______ 。
(1)常温下,若向某FeCl3溶液中加入一定量的澄清石灰水,调节溶液pH为4时,可得到红褐色沉淀,则溶液中Fe3+的物质的量浓度c(Fe3+)=
(2)用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有Fe3+、Fe2+和Cu2+设计如图实验方案处理FeCl3溶液蚀刻铜板后的废液和资源回收。

某些金属阳离子生成氢氧化物沉淀的pH如表:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
②若步骤②中加入CuO调节pH,则反应的离子方程式为
您最近一年使用:0次
20-21高二上·浙江绍兴·阶段练习
解题方法
9 . 某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾晶体,具体流程如下:
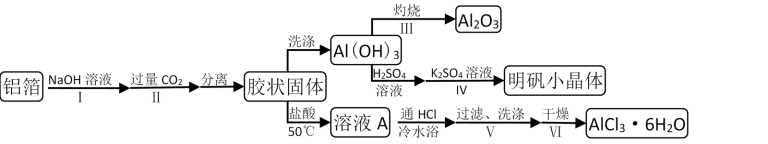
已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式______ ;步骤II中发生的离子方程式________
(2)步骤III,下列操作合理的是________ (多选)
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是__ 、________ 过滤、洗涤、干燥。
(4)步骤V,过滤时,用到的玻璃仪器有________ ;
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是________
A.常温干燥B.低温干燥C.高温干燥

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;请回答:
(1)步骤I中发生的化学方程式
(2)步骤III,下列操作合理的是
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.需用坩埚钳移动灼热的坩埚
D.坩埚取下后放在石棉网上冷却待用
(3)依次加入硫酸溶液、硫酸钾溶液后,步骤IV的操作是
(4)步骤V,过滤时,用到的玻璃仪器有
(5)步骤VI,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是
A.常温干燥B.低温干燥C.高温干燥
您最近一年使用:0次
2020高三·全国·专题练习
10 . 焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:_____________________________________________________ 。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为________ 溶液(写化学式)。
②工艺中加入Na2CO3固体,并再次充入SO2的目的是______________________________ 。
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:

①pH=4.1时,Ⅰ中为
②工艺中加入Na2CO3固体,并再次充入SO2的目的是
您最近一年使用:0次
2020-05-29更新
|
365次组卷
|
7卷引用:考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测(已下线)专题4.3 硫及其化合物(讲)——2020年高考化学一轮复习讲练测(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)



