真题
解题方法
1 . (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______ 。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______ 。
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
您最近一年使用:0次
2021-06-15更新
|
3660次组卷
|
9卷引用:考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)2021年6月新高考浙江化学高考真题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题08.微粒间相互作用力-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)
2022高三·全国·专题练习
2 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2。某探究小组回收处理流程如图:

回答下列问题:
(1)“酸浸氧化”发生的主要氧化还原反应的化学方程式为_______ 。
(2)“高温气相沉积”过程中发生的化学反应方程式为_______ 。

回答下列问题:
(1)“酸浸氧化”发生的主要氧化还原反应的化学方程式为
(2)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
名校
3 . Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=______ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用______ (填“Na2CO3”或“Na2S”)
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为______ mol·L-1(已知:Ksp(CdS)=7.9×10-27,Cd的相对原子质量为112);此时是否符合水源标准?______ (填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
(4)加入H2O2溶液的作用是______ 。
(5)流程图中,调节pH时,加入的试剂X可以是______ (填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到______ 。再将生成的氢氧化铁沉淀除去。
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:

| 金属离子 | Fe3+ | Zn2+ | Fe2+ |
| 开始沉淀的pH | 1.1 | 5.2 | 5.8 |
| 沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(4)加入H2O2溶液的作用是
(5)流程图中,调节pH时,加入的试剂X可以是
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到
您最近一年使用:0次
2023-11-10更新
|
818次组卷
|
3卷引用:广东省茂名市信宜市2023-2024学年高二上学期11月期中考试化学试题
4 . 实验室从废定影液[含Ag(S2O3)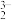 和Br-等]中回收Ag和Br2可能用到的装置如下图:
和Br-等]中回收Ag和Br2可能用到的装置如下图:
(1)向废定影液中加入Na2S溶液沉淀银离子,分离Ag2S时,选用的装置是_______ (填装置序号,下同)
(2)灼烧Ag2S制取金属Ag,用到的实验装置是_______
(3)制取Cl2并将Cl2通入滤液中氧化Br-,获取Br2,制取氯气的实验装置是_______ ,甲和乙中盛放浓盐酸的仪器名称为_______ ,丙中仪器B的名称为_______
(4)再用四氯化碳萃取分液得粗溴,萃取分液时用到的实验装置是_______ ,粗溴从_______ 放出,水层从_______ 倒出。
(5)可用下图装置精制粗溴:_______ 。
②仪器B的名称_______ ,图中冷却水应从B的_______ (填“a”或“b”)口进入,能否用仪器E代替B,_______ (填“能”或“否”)
③温度计的水银球能否插入粗溴中_______ (填“能”或“否”),原因是_______
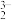 和Br-等]中回收Ag和Br2可能用到的装置如下图:
和Br-等]中回收Ag和Br2可能用到的装置如下图:

(1)向废定影液中加入Na2S溶液沉淀银离子,分离Ag2S时,选用的装置是
(2)灼烧Ag2S制取金属Ag,用到的实验装置是
(3)制取Cl2并将Cl2通入滤液中氧化Br-,获取Br2,制取氯气的实验装置是
(4)再用四氯化碳萃取分液得粗溴,萃取分液时用到的实验装置是
(5)可用下图装置精制粗溴:

②仪器B的名称
③温度计的水银球能否插入粗溴中
您最近一年使用:0次
名校
5 . 选择下列实验方法分离、提纯物质,将分离、提纯方法的字母填在横线上。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:___________ 。
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:___________ 。
(3)提取碘水中的碘:___________ 。
(4)除去混在乙烷中的乙烯:___________ 。
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:___________ 。
A.萃取 B.重结晶 C.分液 D.蒸馏 E.过滤 F.洗气
(1)分离水和汽油的混合物:
(2)分离四氯化碳 (沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物:
(3)提取碘水中的碘:
(4)除去混在乙烷中的乙烯:
(5)从硝酸钾和氯化钠的混合溶液中获得硝酸钾:
您最近一年使用:0次
2022-02-14更新
|
1690次组卷
|
5卷引用:【知识图鉴】单元讲练测选择性必修3第1单元01讲核心
(已下线)【知识图鉴】单元讲练测选择性必修3第1单元01讲核心2016-2017学年内蒙古集宁一中高二下月考二化学卷课前-1.2.1 有机化合物的分离、提纯-人教2019选择性必修3(已下线)第03讲 有机物的分离、提纯(word讲义)-【帮课堂】2021-2022学年高二化学同步精品讲义(人教2019选择性必修3)安徽省安庆市第七中学2021-2022学年高二下学期3月阶段性考试化学试题
6 . 氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为NiO,杂质为 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。

已知几种金属离子沉淀的pH如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣1的主要成分是_______ (填化学式)。
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式_______ 。
(4)“除铁”在40~50°C下进行,加入 的作用是
的作用是_______ , 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是_______ ,NaOH用于调节溶液的pH,应调节pH的范围是_______ 。
(5)NiOOH中Ni的化合价为_______ 。“氧化”中会有 生成,反应的离子方程式为
生成,反应的离子方程式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为_______ %(保留两位有效数字)。
 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。
已知几种金属离子沉淀的pH如表:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式
(4)“除铁”在40~50°C下进行,加入
 的作用是
的作用是 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是(5)NiOOH中Ni的化合价为
 生成,反应的离子方程式为
生成,反应的离子方程式为(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为
您最近一年使用:0次
2023高三·全国·专题练习
7 . 一种用软锰矿(主要成分是MnO2、Al2O3、SiO2)和黄铁矿(主要成分是FeS2、SiO2)为原料制取MnSO4溶液的流程如下:

(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为_______ 。
(2)“氧化”过程中发生反应的离子方程式为_______ 。

(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为
(2)“氧化”过程中发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ ,通过计算即可确定上述方案是否可行。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
2021-08-24更新
|
1679次组卷
|
9卷引用:吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题
吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后河南省洛阳市2020-2021学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山东省莱西市第一中学2020-2021学年高二上学期12月月考化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题
名校
9 . 工业废水中的重金属离子会导致环境污染危害人体健康,可用多种方法去除。
I.臭氧法
络合态的金属离子难以直接去除。O3与水反应产生的·OH(羟基自由基)可以氧化分解金属配合物[mRa+ ·nX]中的有机配体,使金属离子游离到水中,反应原理为:
·OH+[mRa+·nX] →mRa++CO2+H2O (Ra+表示金属离子,X表示配体)
·OH同时也能与溶液中的 、
、 反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
(1)基态Ni2+的核外电子排布式为_______ 。
(2)加入的Ca(OH)2的作用是_______ 。
Ⅱ.纳米零价铝法
纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生·OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。
(3)向AlCl3溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH)
(B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH) ,其离子方程式为
,其离子方程式为 _______ 。
(4)向含有甘氨酸铬的废水中加入纳米铝粉,研究溶液中总氮含量[ ]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是
]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 _______ 。

Ⅲ.金属炭法
其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

(5)废水pH为3时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是_______ 。
(6)废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是_______ 。
I.臭氧法
络合态的金属离子难以直接去除。O3与水反应产生的·OH(羟基自由基)可以氧化分解金属配合物[mRa+ ·nX]中的有机配体,使金属离子游离到水中,反应原理为:
·OH+[mRa+·nX] →mRa++CO2+H2O (Ra+表示金属离子,X表示配体)
·OH同时也能与溶液中的
 、
、 反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。(1)基态Ni2+的核外电子排布式为
(2)加入的Ca(OH)2的作用是
Ⅱ.纳米零价铝法
纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生·OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。
(3)向AlCl3溶液中滴加碱性NaBH4溶液,溶液中BH
 (B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH)
(B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH) ,其离子方程式为
,其离子方程式为 (4)向含有甘氨酸铬的废水中加入纳米铝粉,研究溶液中总氮含量[
 ]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是
]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 
Ⅲ.金属炭法
其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

(5)废水pH为3时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是
(6)废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是
您最近一年使用:0次
2022-05-07更新
|
915次组卷
|
3卷引用:江苏省扬州中学2022-2023学年高二下学期期中考试化学试题
2023高三·全国·专题练习
10 . 已知萃取剂A、B中pH对钴离子、锰离子萃取率的影响如图所示,为了除去Mn2+,应选择萃取剂___________ (填“A”或“B”)。


您最近一年使用:0次



