名校
解题方法
1 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ ,通过计算即可确定上述方案是否可行。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
2021-08-24更新
|
1679次组卷
|
9卷引用:第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)
(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)河南省洛阳市2020-2021学年高二上学期期中考试化学试题山东省莱西市第一中学2020-2021学年高二上学期12月月考化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后
名校
解题方法
2 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
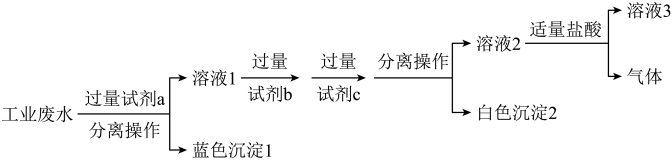
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
533次组卷
|
8卷引用:第一章 物质及其变化
3 . 海洋是一个巨大的宝藏,海水淡化是重要的化学研究课题。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是___ (填序号)。
a.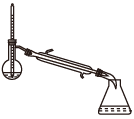 b.
b.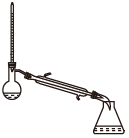
c.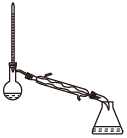 d.
d.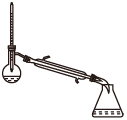
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是___ ,冷凝水一般不采用“上进下出”,其原因是____ 。
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):
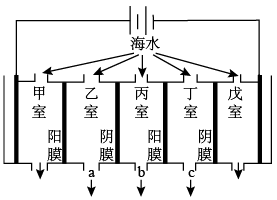
某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为___ ,产生水垢最多的是___ 室,淡水的出口为____ (填“a”、“b”或“c”)。
(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目____ (填“增加”“不变”或“减少”),阴离子交换树脂中发生了离子反应,其离子方程式为___ 。
(1)蒸馏法获取淡水,历史悠久,操作简单,图中符合模拟蒸馏海水的装置是
a.
 b.
b.
c.
 d.
d.
蒸馏前,应向烧瓶中加入沸石或碎瓷片,目的是
(2)电渗析法的技术原理如图(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过):

某地海水中主要含Na+、K+、Ca2+、Mg2+、Cl-、HCO
 、SO
、SO 等,则淡化过程中,甲室的电极反应式为
等,则淡化过程中,甲室的电极反应式为(3)离子交换法获取淡水模拟图如图:

经过阳离子交换树脂后水中阳离子数目
您最近一年使用:0次
2021-09-06更新
|
1253次组卷
|
5卷引用:第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】安徽省A10联盟2022届高三上学期摸底考试化学试题(已下线)3.3.1 粗盐提纯 从海水中提取溴-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)(已下线)专题35 物质的检验、分离和提纯(限时精炼)-2022年高三毕业班化学常考点归纳与变式演练
名校
4 . 海洋化学资源的综合利用对人类的发展意义重大。
(1)以海水为原料获得的粗盐中含有CaCl2、MgCl2、Na2SO4和难溶性杂质。
①除去难溶性杂质,实验室常用的分离操作是___________ 。
②除去可溶性杂质,所选试剂及加入的顺序依次是NaOH、___________ 、___________ 、稀盐酸。
(2)从海带中提取碘的工业生产过程如下:
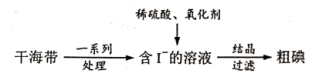
①氧化剂将 。下列氧化剂中,最好选用
。下列氧化剂中,最好选用___________ (填字母)。
a.酸性KMnO4 b. H2O2 c.浓硫酸
②实验室中常用CCl4从氧化后的溶液中萃取I2,其原理是___________ 。
(3)从海水中提取镁的过程是将海水中的Mg2+转变为无水MgCl2,电解熔融MgCl2得到金属镁。该过程中属于氧化还原反应的化学方程式为___________ 。
(1)以海水为原料获得的粗盐中含有CaCl2、MgCl2、Na2SO4和难溶性杂质。
①除去难溶性杂质,实验室常用的分离操作是
②除去可溶性杂质,所选试剂及加入的顺序依次是NaOH、
(2)从海带中提取碘的工业生产过程如下:

①氧化剂将
 。下列氧化剂中,最好选用
。下列氧化剂中,最好选用a.酸性KMnO4 b. H2O2 c.浓硫酸
②实验室中常用CCl4从氧化后的溶液中萃取I2,其原理是
(3)从海水中提取镁的过程是将海水中的Mg2+转变为无水MgCl2,电解熔融MgCl2得到金属镁。该过程中属于氧化还原反应的化学方程式为
您最近一年使用:0次
2021-01-27更新
|
922次组卷
|
6卷引用:第4章 化学与自然资源的开发利用(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)
(已下线)第4章 化学与自然资源的开发利用(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题(已下线)专题11 自然资源的开发利用【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)福建省福州第二中学2021-2022学年高一上学期12月月考化学试题福建省福州第一中学2021-2022学年高一上学期期末考试化学试题四川省甘孜州2021-2022学年高一下学期学业质量统一监测期末统考化学试题
5 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)可用于制作计算机芯片和太阳能电池的是______ (填化学式,下同),光导纤维的主要成分是_____ 。
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为_______ 。
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:_______ 。
(4)高纯度单晶硅可以按下列方法制备:SiO2 Si(粗)
Si(粗) SiHCl3
SiHCl3  Si(纯)
Si(纯)
写出步骤①的化学方程式:______ 。
步骤②的产物中, 大约占85%,还有
大约占85%,还有 、
、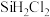 、
、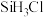 等,有关物质的沸点数据如下表,提纯
等,有关物质的沸点数据如下表,提纯 的主要工艺操作依次是沉降、冷凝和
的主要工艺操作依次是沉降、冷凝和________ 。
(1)可用于制作计算机芯片和太阳能电池的是
(2)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(3)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(4)高纯度单晶硅可以按下列方法制备:SiO2
 Si(粗)
Si(粗) SiHCl3
SiHCl3  Si(纯)
Si(纯)写出步骤①的化学方程式:
步骤②的产物中,
 大约占85%,还有
大约占85%,还有 、
、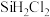 、
、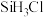 等,有关物质的沸点数据如下表,提纯
等,有关物质的沸点数据如下表,提纯 的主要工艺操作依次是沉降、冷凝和
的主要工艺操作依次是沉降、冷凝和物质 | Si |
|
|
|
| HCl |
|
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
您最近一年使用:0次
2020-10-03更新
|
1167次组卷
|
5卷引用:必修第二册RJ高效学习手册-第五章
必修第二册RJ高效学习手册-第五章(已下线)第四章 非金属及其化合物(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)4.1.2 硅酸盐和硅单质(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)山西省晋中市新一双语学校2020-2021学年高一下学期3月月考化学试题湖南省祁东县育贤中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
6 . 现有 NaCl、Na2SO4和 NaNO3 的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。

(1)写出实验流程中下列物质的化学式:试剂 X___________ ,沉淀 A_________ 。
(2)上述实验流程中①②③步均要进行的实验操作是______________ (填操作名称),该过程中玻璃棒的作用是___________ 。
(3)上述实验流程中加入过量 Na2CO3 溶液的目的是_____________ 。
(4)按此实验方案得到的溶液3中肯定含有_________________ (填化学式)杂质。为了解决这个问题,可以向溶液3中加入适量的_________________ (填化学式)。

(1)写出实验流程中下列物质的化学式:试剂 X
(2)上述实验流程中①②③步均要进行的实验操作是
(3)上述实验流程中加入过量 Na2CO3 溶液的目的是
(4)按此实验方案得到的溶液3中肯定含有
您最近一年使用:0次
2020-06-12更新
|
1360次组卷
|
8卷引用:第二章 化学物质及其变化(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)
(已下线)第二章 化学物质及其变化(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)(已下线)第一章 物质及其变化(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)江苏省江都中学2019-2020学年度高一期中考试化学试题安徽省六安市新安中学2022届高三上学期第二次月考化学试题(已下线)【苏州新东方】13 吴江区 高级中学江苏省宿迁市泗阳县实验高级中学2022-2023学年高一上学期第一次调研测试化学试题(已下线)第一章 化学物质及其变化 第3练 离子反应的应用河北省沧州市盐山中学2023-2024学年高一下学期开学化学试题
名校
7 . 制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol•L-1硫酸铝酸性溶液,经检验,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5(温室下,0.1 mol•L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_______ 。
(2)往溶液中加入H2O2的作用是_______ (用离子方程式表示)。
(3)加入的X试剂(填选项编号)是_______ 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是_______ 。
(1)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为
(2)往溶液中加入H2O2的作用是
(3)加入的X试剂(填选项编号)是
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
您最近一年使用:0次
名校
8 . 某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是______ ,操作②的名称是_________ 。
(2)试剂a是________ (填化学式,下同),试剂b是_______ ,固体B是________ 。
(3)加入试剂a所发生反应的化学方程式为_______ 。加入试剂b所发生反应的离子方程式为______ 。
(4)该方案能否达到实验目的:_____ (填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)___ 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____ 的质量。

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是
(2)试剂a是
(3)加入试剂a所发生反应的化学方程式为
(4)该方案能否达到实验目的:
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是
您最近一年使用:0次
2020-06-10更新
|
668次组卷
|
24卷引用:2018-2019学年高一人教版化学必修1:第一章从实验学化学练习题
2018-2019学年高一人教版化学必修1:第一章从实验学化学练习题(已下线)【走进新高考】(人教版必修一)第一章 从实验学化学 单元练习02人教版高中化学必修1第一章《从实验学化学》测试卷5人教版高中化学必修1第一章《从实验学化学》测试卷6(已下线)第一章 从实验学化学(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版必修1)2015-2016学年广西柳州铁路第一中学高一上段考化学试卷湖南省长沙市第一中学2017-2018学年高一上学期期中考试化学试题湖北省武汉市钢城四中2018-2019学年高一上学期10月月考化学试题云南省楚雄州南华县第一中学2018-2019学年高一上学期期中考试化学试题【校级联考】安徽省滁州市定远县西片区2018-2019学年高一上学期期中考试化学试题云南省昭通市盐津县水田新区中学2018-2019学年高一上学期11月份考试化学试题贵州省黄平县且兰高级中学2018-2019学年高一上学期12月份考试化学试题安徽省阜阳市第三中学2019-2020学年高一上学期第一次调研考试化学试题云南省昭通市巧家县二中2019-2020学年高一10月月考化学试题贵州省贵阳一中2019—2020学年度高一上学期第一次月考化学试题云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高一10月月考化学试题云南省施甸县第一中学2019-2020学年高一12月月考化学试题云南省永善县第二中学2019—2020学年高一上学期期末考试化学试题广西贺州市富川县民族中学2019-2020学年高一上学期期末考试化学试题四川省攀枝花市第十五中学2019-2020学年高一上学期期中考试化学试题河南省南阳市第一中学2020-2021学年高一上学期第一次月考化学试题四川省冕宁中学2020-2021学年高一上学期期中考试化学试题河北省承德第一中学2020-2021学年高一下学期第二次月考化学试题
名校
9 . 用一种试剂除去下列各物质中的杂质(括号内的物质)。写出所用试剂及离子方程式。
(1)NaCl(Na2CO3):试剂______ ,离子方程式_____ 。
(2)FeSO4溶液(CuSO4):试剂_____ ,离子方程式____ 。
(3)Na2SO4溶液(CuSO4):试剂____ ,离子方程式_____ 。
(1)NaCl(Na2CO3):试剂
(2)FeSO4溶液(CuSO4):试剂
(3)Na2SO4溶液(CuSO4):试剂
您最近一年使用:0次
2020-09-27更新
|
652次组卷
|
3卷引用:沪科版高二化学拓展性课程9《化学实验探究》测试题
名校
解题方法
10 . 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C三种试剂,按图中的实验步骤进行操作:

(1)B的化学式_________ 。
(2)加过量A的原因是________ ,有关反应的化学方程式为__________ ;____________ 。
(3)加过量B的原因是____________ ,有关反应的化学方程式为________ ;_______ 。

(1)B的化学式
(2)加过量A的原因是
(3)加过量B的原因是
您最近一年使用:0次
2020-06-11更新
|
536次组卷
|
3卷引用:第一章 从实验学化学(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)
(已下线)第一章 从实验学化学(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版必修1)陕西省咸阳市实验中学2019-2020学年高一上学期第一次月考化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期第一次月考化学试题




