真题
解题方法
1 . (1)已知3种原子晶体的熔点数据如下表:
金刚石熔点比晶体硅熔点高的原因是_______ 。
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是_______ 。
| 金刚石 | 碳化硅 | 晶体硅 | |
| 熔点/℃ | >3550 | 2600 | 1415 |
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是
您最近一年使用:0次
2021-06-15更新
|
3651次组卷
|
9卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点08 分子间作用力 氢键-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间作用力-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题08.微粒间相互作用力-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题26-31(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密05 物质结构 元素周期律(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点08 微粒间相互作用力-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点08 微粒间相互作用力(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
2 . Ⅰ、我国规定生活用水中镉排放的最大允许浓度为0.005mg/L。处理含镉废水可采用化学沉淀法。试回答下列问题:
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=______ 。
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用______ (填“Na2CO3”或“Na2S”)
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为______ mol·L-1(已知:Ksp(CdS)=7.9×10-27,Cd的相对原子质量为112);此时是否符合水源标准?______ (填“是”或“否”)。
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:
(4)加入H2O2溶液的作用是______ 。
(5)流程图中,调节pH时,加入的试剂X可以是______ (填序号)
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到______ 。再将生成的氢氧化铁沉淀除去。
(1)磷酸镉[Cd3(PO4)2]沉淀溶解平衡常数的表达式Ksp=
(2)一定温度下,CdCO3的Ksp=4.0×10-12,CdS的Ksp=7.9×10-27,欲将某含镉废水中的Cd2+沉淀下来,最好选用
(3)若往某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,水体中Cd2+浓度为
Ⅱ、炼锌烟尘(主要成分为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。制取氯化锌主要工艺如下:

| 金属离子 | Fe3+ | Zn2+ | Fe2+ |
| 开始沉淀的pH | 1.1 | 5.2 | 5.8 |
| 沉淀完全的pH | 3.2 | 6.4 | 8.8 |
(4)加入H2O2溶液的作用是
(5)流程图中,调节pH时,加入的试剂X可以是
A、ZnO B、NaOH C、Zn2(OH)2CO3 D、ZnSO4
pH应调整到
您最近一年使用:0次
2023-11-10更新
|
818次组卷
|
3卷引用:广东省茂名市信宜市2023-2024学年高二上学期11月期中考试化学试题
解题方法
3 . 按要求填空
(1)向CuCl2溶液中滴加NaOH溶液,现象:_________ ,离子方程式:_____ ,
(2)向NaHCO3溶液中滴加稀硫酸,现象:_____ ,离子方程式:_______ ;
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂_____ ,离子方程式;_____ 。
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂________ ,离子方程式__________ 。
(1)向CuCl2溶液中滴加NaOH溶液,现象:
(2)向NaHCO3溶液中滴加稀硫酸,现象:
(3)铜粉(铁粉):除杂,括号内为杂质,所加试剂
(4)FeSO4 (CuSO4):除杂,括号内为杂质,所加试剂
您最近一年使用:0次
2021-01-09更新
|
1978次组卷
|
5卷引用:贵州省安顺市大洋实验学校2020-2021学年高一上学期期中考试化学试题
4 . 氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为NiO,杂质为 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。

已知几种金属离子沉淀的pH如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣1的主要成分是_______ (填化学式)。
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式_______ 。
(4)“除铁”在40~50°C下进行,加入 的作用是
的作用是_______ , 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是_______ ,NaOH用于调节溶液的pH,应调节pH的范围是_______ 。
(5)NiOOH中Ni的化合价为_______ 。“氧化”中会有 生成,反应的离子方程式为
生成,反应的离子方程式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为_______ %(保留两位有效数字)。
 、CaO、CuO)制备NiOOH的工艺流程如图。
、CaO、CuO)制备NiOOH的工艺流程如图。
已知几种金属离子沉淀的pH如表:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(3)“除铜”中发生两个反应,写出其中生成CuS的化学方程式
(4)“除铁”在40~50°C下进行,加入
 的作用是
的作用是 的实际消耗量比理论值高的原因是
的实际消耗量比理论值高的原因是(5)NiOOH中Ni的化合价为
 生成,反应的离子方程式为
生成,反应的离子方程式为(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为
您最近一年使用:0次
名校
解题方法
5 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ ,通过计算即可确定上述方案是否可行。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
2021-08-24更新
|
1677次组卷
|
9卷引用:河南省洛阳市2020-2021学年高二上学期期中考试化学试题
河南省洛阳市2020-2021学年高二上学期期中考试化学试题(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)山东省莱西市第一中学2020-2021学年高二上学期12月月考化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后
6 . 黏土钒矿中,钒以+3价、+4价、+5价的化合物存在,还包括SiO2、Fe2O3和铝硅酸盐(Al2O3•SiO2)等。采用以下流程可由黏土钒矿制备V2O5、Fe2O3和硫酸铝铵。

已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org) MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)
ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有_______ 。
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:_______ 。
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:_______ 。
(4)KClO3和VO2+(反应生成VO 和Cl-的离子方程式是
和Cl-的离子方程式是_______ 。
(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg/mol)。
(6)从无机层获得Fe(OH)3的离子方程式是_______ 。
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、_______ 、洗涤、干燥。


已知:i.有机酸性萃取剂HR的萃取原理为:Mn+(aq)+nHR(org)
 MR(org)+nH+(aq)(org表示有机溶液)
MR(org)+nH+(aq)(org表示有机溶液)ii.酸性溶液中,HR对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
iii.HR能萃取Fe3+而不能萃取Fe2+。
(1)从黏土钒矿到浸出液的流程中,加快浸出速率的措施有
(2)浸出液中钒以+4价、+5价的形式存在,简述加入铁粉的原因:
(3)从平衡移动原理解释加入20%H2SO4溶液的作用:
(4)KClO3和VO2+(反应生成VO
 和Cl-的离子方程式是
和Cl-的离子方程式是(5)测定V2O5产品的纯度
称取V2O5产品ag,先加入硫酸将V2O5转化为VO
 ,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO
,加入指示剂后,cmol/L(NH4)2Fe(SO4)2溶液滴定将VO 转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是
转化为VO2+至终点,消耗(NH4)2Fe(SO4)2溶液的体积为VmL。假设杂质不参与反应,则V2O5产品中V2O5的质量分数是(6)从无机层获得Fe(OH)3的离子方程式是
(7)硫酸铝铵固体中含有少量硫酸铵杂质,根据如图的溶解度曲线,进一步提纯硫酸铝铵的操作是加热溶解、

您最近一年使用:0次
2023-10-22更新
|
642次组卷
|
2卷引用:北京市清华大学附属中学2023-2024学年高三上学期10月月考化学试题
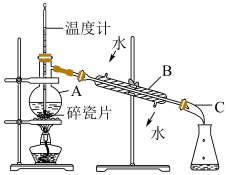
7 . 请回答实验室石油分馏的有关问题:________ ;B_____ 。
(2)图中有______ 处错误。
(3)实验室石油分馏的正确操作顺序是E→ F→____→A→______→_____→G,________ 。
A.连接接液管 B.装入碎瓷片和石油,塞上带温度计的塞子 C.检查装置气密性 D.连接B仪器及进出水管 E.在铁架台上放酒精灯,固定好铁圈,放上石棉网 F.固定好A仪器 G.加热
(4)分馏石油得到的各个馏分都是___________ (填“混合物”或“纯净物”),在A中注入原油后,加几片碎瓷片的目的是___________ 。
(2)图中有
(3)实验室石油分馏的正确操作顺序是E→ F→____→A→______→_____→G,
A.连接接液管 B.装入碎瓷片和石油,塞上带温度计的塞子 C.检查装置气密性 D.连接B仪器及进出水管 E.在铁架台上放酒精灯,固定好铁圈,放上石棉网 F.固定好A仪器 G.加热
(4)分馏石油得到的各个馏分都是
您最近一年使用:0次
8 . 从铜氨废液含[Cu(NH3)3·CO]+、[Cu(NH3)2]2+、[Cu(NH3)4]2+、NH3、CH3COO−、 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图:
(1)步骤(Ⅰ)中被氧化的元素是_____________ ,由步骤(Ⅱ)可确定NH3与H+的结合能力比与Cu2+的_____________ (填“强”或“弱”)。
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为_______________________ ,利用Na2S溶液而不选用NaOH溶液“沉铜”的优点是_______________________ 。
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为_____________ 。
(4)该流程中可以循环利用的物质是__________________________ (填化学式)。
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为__________________________ 。
 等中回收铜的工艺流程如图:
等中回收铜的工艺流程如图: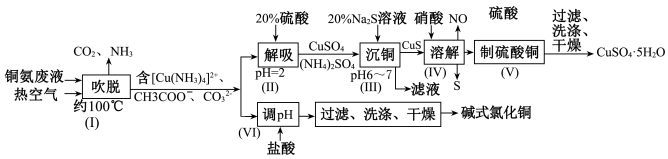
(1)步骤(Ⅰ)中被氧化的元素是
(2)步骤(Ⅲ)“沉铜”时,发生的主要反应的离子方程式为
(3)步骤(Ⅳ)反应中,氧化剂与还原剂的物质的量之比为
(4)该流程中可以循环利用的物质是
(5)碱式氯化铜在400℃时能完全分解为CuO、H2O和HCl。为测定碱式氯化铜的组成进行如下实验:准确称取42.9g碱式氯化铜,加热到400℃使其完全分解,剩余固体32.0g,将生成的气体通过浓硫酸的洗气瓶,浓硫酸增重3.6g。碱式氯化铜的化学式为
您最近一年使用:0次
2021-01-06更新
|
1936次组卷
|
4卷引用:山东省潍坊市临朐县实验中学2021届高三上学期12月阶段性学情检测化学试题
山东省潍坊市临朐县实验中学2021届高三上学期12月阶段性学情检测化学试题(已下线)2021年高考全国甲卷化学试题变式题(已下线)模拟卷01-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)2024届广西桂林市高三下学期4月月考化学试卷
名校
解题方法
9 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
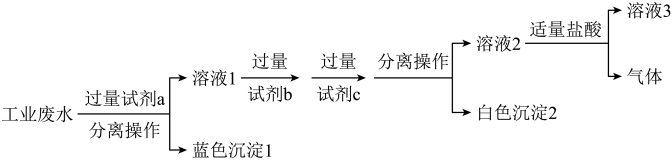
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
527次组卷
|
8卷引用:山东省青岛市黄岛区2020-2021学年高一上学期期中考试化学试题
名校
解题方法
10 . 除去下列物质中含有的少量杂质,写出除杂所用试剂的化学式和反应的离子方程式:
(1) 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:________ 、________ ;
(2) 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:________ 、________ ;
(3) 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:________ 、________ 。
(1)
 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:(2)
 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:(3)
 溶液中含有少量的
溶液中含有少量的 杂质:
杂质:
您最近一年使用:0次
2021-12-01更新
|
1340次组卷
|
2卷引用:人教2019版必修第一册第三章第一节 铁及其化合物课后习题



