名校
1 . 除去下列物质中所含的杂质,选用的试剂正确的是
| 选项 | A | B | C | D |
| 物质(杂质) | NO2(NO) | SO2(HCl) | FeCl2溶液(FeCl3) | NaCl固体(NH4Cl) |
| 试剂 | O2 | 饱和NaHSO3溶液 | Cu | NaOH溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列由实验得出的结论正确的是
| 实验 | 结论 | |
| A | 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 | 生成的有机物具有酸性 |
| B | 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 | 生成的 1,2-二溴乙烷无色、可溶于四氯化碳 |
| C | 乙烷中混有杂质乙烯,可将混合气体通入溴水溶液中,除去杂质乙烯 | 乙烯被溴水氧化 |
| D | 乙醇和水都可与金属钠反应产生可燃性气体 | 乙醇分子中的氢与水分子中的氢具有相同的活性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 下列除去杂质的方法中,正确的是
| 选项 | 物质(括号内为杂质) | 去除杂质的方法 |
| A | 粗盐( ) ) | 加入适量的KOH溶液、过滤 |
| B |  | 饱和 溶液、洗气 溶液、洗气 |
| C | 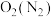 | 通过灼热的铜网 |
| D | NaCl固体( ) ) | 加热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . I.氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
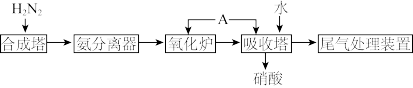
(1)写出氧化炉中的化学反应方程式_______ 。
(2)向吸收塔中通入A的作用_______ 。
(3)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用_______ (填化学式)溶液吸收。
II.为除去KCl溶液中少量的Mg2+、 ,可选用Ba(OH)2、HCl和K2CO3三种溶液按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种溶液按如下步骤操作:
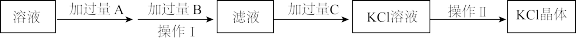
(4)上述试剂中,A是_______ ,C是_______ 。(填化学式)
(5)操作I的名称是_______ 。
(6)加过量A时发生有关反应的离子方程式为_______ 、_______ 。
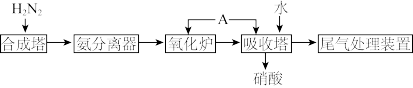
(1)写出氧化炉中的化学反应方程式
(2)向吸收塔中通入A的作用
(3)工业制硝酸的尾气是酸性气体,实验室模拟该流程时,为防止环境污染,最好选用
II.为除去KCl溶液中少量的Mg2+、
 ,可选用Ba(OH)2、HCl和K2CO3三种溶液按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种溶液按如下步骤操作: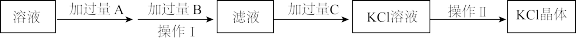
(4)上述试剂中,A是
(5)操作I的名称是
(6)加过量A时发生有关反应的离子方程式为
您最近一年使用:0次
名校
5 . 除去氯化钠溶液中混有的Ca2+、Mg2+、SO 等杂质离子,通常采用以下四种试剂:①Na2CO3 ②NaOH ③BaCl2 ④盐酸,加入试剂顺序合理的是
等杂质离子,通常采用以下四种试剂:①Na2CO3 ②NaOH ③BaCl2 ④盐酸,加入试剂顺序合理的是
 等杂质离子,通常采用以下四种试剂:①Na2CO3 ②NaOH ③BaCl2 ④盐酸,加入试剂顺序合理的是
等杂质离子,通常采用以下四种试剂:①Na2CO3 ②NaOH ③BaCl2 ④盐酸,加入试剂顺序合理的是| A.③②①④ | B.①③②④ | C.④②①③ | D.①②③④ |
您最近一年使用:0次
2022-04-07更新
|
115次组卷
|
2卷引用:重庆市长寿中学校2021-2022学年高一下学期阶段性考试(一)化学试题
名校
6 . 某工业废水中存在大盘的Na+、 、Cu2+、
、Cu2+、 ,欲除去其中的Cu2+、
,欲除去其中的Cu2+、 ,设计的工艺流程如图所示:
,设计的工艺流程如图所示:

(1)加入NaOH溶液时反应的离子方程式:_______ 。
(2)试剂a为_______ ,试剂b为_______ 。
(3)流程图中操作X为_______ 。
(4)检验废水中的 已沉淀完全的方法为
已沉淀完全的方法为_______ 。
 、Cu2+、
、Cu2+、 ,欲除去其中的Cu2+、
,欲除去其中的Cu2+、 ,设计的工艺流程如图所示:
,设计的工艺流程如图所示:
(1)加入NaOH溶液时反应的离子方程式:
(2)试剂a为
(3)流程图中操作X为
(4)检验废水中的
 已沉淀完全的方法为
已沉淀完全的方法为
您最近一年使用:0次
名校
解题方法
7 . 为除去括号内的杂质,下列各选项中所选用的试剂或方法不正确的是
A. 溶液( 溶液( ):选用适量的 ):选用适量的 溶液 溶液 |
B. 溶液( 溶液( ):通入过量的 ):通入过量的 气体 气体 |
C. 粉末( 粉末( ):将混合物在 ):将混合物在 中加热 中加热 |
D. 溶液( 溶液( ):加入适量的 ):加入适量的 溶液,过滤 溶液,过滤 |
您最近一年使用:0次
2022-08-16更新
|
267次组卷
|
3卷引用:重庆市黔江中学校2021-2022年度高一上11月考试化学试题
重庆市黔江中学校2021-2022年度高一上11月考试化学试题黑龙江省哈尔滨市第七十三中学校2020-2021学年高二下学期期中考试化学试题(已下线)专题04 钠及其化合物【考题猜想】(12大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)
名校
8 . I.已知 和
和 两支试管所盛的溶液中共含有
两支试管所盛的溶液中共含有 、
、 、
、 、
、 、
、 、
、 六种离子,向试管
六种离子,向试管 的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管 的溶液中所含的上述离子有
的溶液中所含的上述离子有___________ 。
(2)若将试管 和试管
和试管 中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为___________ 、___________ 。(不考虑氢氧化银的存在)
(3)若向由试管 溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量
溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量 溶液,则发生反应的离子方程式为
溶液,则发生反应的离子方程式为___________ 。
II.为除去粗盐中的 、
、 、
、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
称取粗盐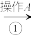
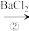
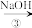
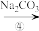
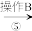 滤液
滤液
 精盐
精盐
(4)第①步中,操作 是
是___________ ,第⑤步中,操作
___________ ;
(5)第④步中,写出相应的离子方程式(设粗盐溶液中 的主要存在形式为CaCl2)
的主要存在形式为CaCl2)___________ ,___________ ;
(6)若先用盐酸调 再过滤,将对实验结果产生影响,其原因是
再过滤,将对实验结果产生影响,其原因是___________ 。
 和
和 两支试管所盛的溶液中共含有
两支试管所盛的溶液中共含有 、
、 、
、 、
、 、
、 、
、 六种离子,向试管
六种离子,向试管 的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
的溶液中滴入酚酞试液呈粉红色。请回答下列问题:(1)试管
 的溶液中所含的上述离子有
的溶液中所含的上述离子有(2)若将试管
 和试管
和试管 中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为
中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为(3)若向由试管
 溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量
溶液中的阳离子组成的碳酸氢盐溶液中,滴入少量 溶液,则发生反应的离子方程式为
溶液,则发生反应的离子方程式为II.为除去粗盐中的
 、
、 、
、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):称取粗盐
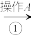
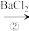
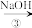
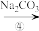
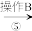 滤液
滤液
 精盐
精盐(4)第①步中,操作
 是
是
(5)第④步中,写出相应的离子方程式(设粗盐溶液中
 的主要存在形式为CaCl2)
的主要存在形式为CaCl2)(6)若先用盐酸调
 再过滤,将对实验结果产生影响,其原因是
再过滤,将对实验结果产生影响,其原因是
您最近一年使用:0次
2022-03-27更新
|
210次组卷
|
2卷引用:重庆市第七中学校2021-2022学年高一下学期3月月考化学试题
名校
9 . 已知硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O,其摩尔质量为392g·mol-1]可用作净水剂、颜料、媒染剂、鞣革、防腐剂等,它在空气中不及硫酸亚铁容易被氧化,易溶于水,不溶于乙醇。回答下列问题:
I.制备过程
步骤1:制备硫酸亚铁溶液:将5.6g铁粉和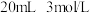 硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是___________ ;由于加入的铁粉不纯,反应过程中会产生少量H2S,可以用CuSO4溶液进行吸收处理,发生的反应化学方程式为:___________ 。
(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是___________ (用离子方程式表示),过滤后的硫酸亚铁铵晶体最好用___________ 洗涤;
II.定量分析——氧化还原滴定法
称取20.00g制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成100mL溶液,取25.00mL于锥形瓶中,然后用 的酸性高锰酸钾溶液进行滴定。
的酸性高锰酸钾溶液进行滴定。
(3)滴定过程中高锰酸钾溶液应装在___________ 仪器中(填“A”或“B”);
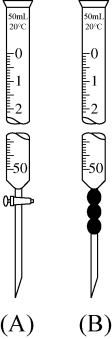
(4)滴定终点的现象是___________ ;
(5)若进行平行滴定三次,消耗 溶液的体积如下表所示:
溶液的体积如下表所示:
则制得的硫酸亚铁铵晶体纯度(质量分数)为___________ (用百分数表示,保留小数点后两位);
(6)上表中第一次的数据明显大于后两次的数据,其原因可能是___________;
I.制备过程
步骤1:制备硫酸亚铁溶液:将5.6g铁粉和
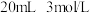 硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。
硫酸置于锥形瓶中,水浴加热至几乎不产生气泡,趁热过滤掉残余的少量铁粉。步骤2:获得硫酸亚铁铵晶体:向滤液中加入一定量的硫酸铵溶液,然后蒸发浓缩、冷却结晶、过滤、洗涤、晾干。
(1)步骤1中,加入过量铁粉的目的是
(2)步骤2中,所用到的硫酸铵溶液呈酸性,原因是
II.定量分析——氧化还原滴定法
称取20.00g制得的硫酸亚铁铵晶体溶于稀硫酸,加水配制成100mL溶液,取25.00mL于锥形瓶中,然后用
 的酸性高锰酸钾溶液进行滴定。
的酸性高锰酸钾溶液进行滴定。(3)滴定过程中高锰酸钾溶液应装在

(4)滴定终点的现象是
(5)若进行平行滴定三次,消耗
 溶液的体积如下表所示:
溶液的体积如下表所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
消耗 溶液的体积/ 溶液的体积/ | 24.54 | 24.01 | 23.99 |
(6)上表中第一次的数据明显大于后两次的数据,其原因可能是___________;
| A.第一次滴定用的锥形瓶用待测液润洗过 |
| B.第一次滴定过程中高锰酸钾溶液滴出锥形瓶外 |
| C.第一次滴定前滴定管尖嘴无气泡,滴定后有气泡 |
| D.第一次滴定结束时,俯视读取酸性高锰酸钾溶液的体积 |
您最近一年使用:0次
2022-03-25更新
|
111次组卷
|
2卷引用:重庆市主城区六校2021-2022学年高二上学期期末联考化学试题
2022·全国·模拟预测
名校
10 . 一定量的甲苯和 溶液在100℃下发生反应,一段时间后停止反应,按如图所示流程分离出苯甲酸和回收未反应的甲苯(已知:苯甲酸的熔点为122.13℃)。
溶液在100℃下发生反应,一段时间后停止反应,按如图所示流程分离出苯甲酸和回收未反应的甲苯(已知:苯甲酸的熔点为122.13℃)。
 溶液在100℃下发生反应,一段时间后停止反应,按如图所示流程分离出苯甲酸和回收未反应的甲苯(已知:苯甲酸的熔点为122.13℃)。
溶液在100℃下发生反应,一段时间后停止反应,按如图所示流程分离出苯甲酸和回收未反应的甲苯(已知:苯甲酸的熔点为122.13℃)。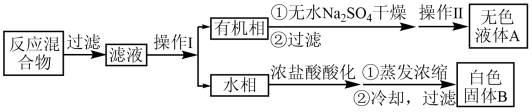
| A.操作I是分液,操作II是蒸馏 |
| B.定性检验无色液体A的试剂可以是酸性高锰酸钾溶液 |
| C.在实验室中,蒸发浓缩操作中所用到的仪器主要有坩埚,泥三角,三脚架,酒精灯 |
| D.可通过测定熔点验证白色固体B是否为纯净物 |
您最近一年使用:0次
2022-03-24更新
|
766次组卷
|
8卷引用:重庆市西南大学附属中学2022-2023学年高二下学期期中考试化学试题
重庆市西南大学附属中学2022-2023学年高二下学期期中考试化学试题(已下线)高考化学预测卷(三)广东省汕头市潮阳林百欣中学2021-2022学年高二下学期期中考试化学试题安徽省怀宁中学2021-2022学年高二下学期期中考试化学试题天津市重点校2022-2023学年高二下学期期末联考化学试题云南省宣威市第六中学2023-2024学年高二上学期10月月考化学试题广东省广州市越秀区广东实验中学2023-2024学年高二下学期5月期中考试化学试题(已下线)题型05 有机实验分析-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(天津专用)



