名校
1 . 青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如下图所示:

各步骤所需选用的实验仪器如下:

请回答下列问题:
(1)采用乙醚浸取法的原因①是利用___________ 的化学原理,②乙醚___________ ,能避免青蒿素在高温下分解。
(2)操作Ⅰ需要的主要玻璃仪器有___________ (填序号),操作Ⅱ的名称是___________ 。
(3)操作Ⅲ的主要过程可能是___________ (填字母)。
A.加水溶解,蒸发浓缩、冷却结
B.加入乙醚进行萃取分液
C.加95%的乙醇,浓缩、结晶、过滤
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是___________ (填字母,下同),装置F中盛放的物质是___________ 。
a.浓硫酸 b.无水CaCl2 c.胆矾 d.碱石灰
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是___________ 。
③用合理改进后的装置进行实验,称得:
则测得青蒿素的最简式是___________ 。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与___________(填字母)具有相同的性质。

各步骤所需选用的实验仪器如下:

请回答下列问题:
(1)采用乙醚浸取法的原因①是利用
(2)操作Ⅰ需要的主要玻璃仪器有
(3)操作Ⅲ的主要过程可能是
A.加水溶解,蒸发浓缩、冷却结
B.加入乙醚进行萃取分液
C.加95%的乙醇,浓缩、结晶、过滤
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2 g青蒿素样品放在硬质玻璃管中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是
a.浓硫酸 b.无水CaCl2 c.胆矾 d.碱石灰
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是
③用合理改进后的装置进行实验,称得:
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与___________(填字母)具有相同的性质。
| A.乙酸乙酯 | B.乙酸 | C.乙醇 | D.葡萄糖 |
您最近一年使用:0次
名校
解题方法
2 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
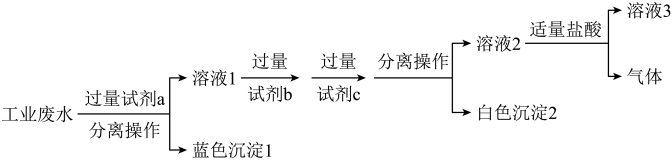
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
531次组卷
|
8卷引用:第一章 物质及其变化
名校
解题方法
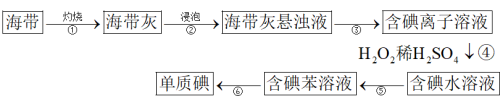
3 . 从海带中提取碘单质,成熟的工艺流程如下。下列关于海带制碘的说法,不正确的是
干海带 海带灰
海带灰 悬浊液
悬浊液 滤液
滤液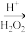 碘水
碘水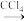 I2的CCl4溶液
I2的CCl4溶液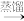 I2
I2
干海带
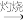 海带灰
海带灰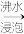 悬浊液
悬浊液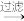 滤液
滤液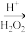 碘水
碘水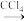 I2的CCl4溶液
I2的CCl4溶液 I2
I2| A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 |
| B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应 |
| C.在碘水中加入几滴淀粉溶液,溶液变蓝色 |
| D.向碘水中加入CCl4得到I2的CCl4溶液,该操作为“分液” |
您最近一年使用:0次
2022-08-27更新
|
481次组卷
|
3卷引用:【知识图鉴】单元讲练测必修第二册第八单元01讲核心
解题方法
4 . 2-甲基-2-氯丙烷是重要的化工原料,实验室中可由叔丁醇与浓盐酸反应制备,路线如图:

下列有关由叔丁醇制备2-甲基-2-氯丙烷的实验的说法中,错误的是

下列有关由叔丁醇制备2-甲基-2-氯丙烷的实验的说法中,错误的是
| A.由叔丁醇制备2-甲基-2-氯丙烷的反应类型为取代反应 |
B.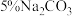 溶液的作用主要是除去产物中余留的酸,因此也可换为 溶液的作用主要是除去产物中余留的酸,因此也可换为 溶液 溶液 |
C.无水 的作用是除去有机相中残存的少量水 的作用是除去有机相中残存的少量水 |
| D.蒸馏除去残余反应物叔丁醇时,产物2-甲基-2-氯丙烷先被蒸馏出体系 |
您最近一年使用:0次
解题方法
5 . I.回答下列问题
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
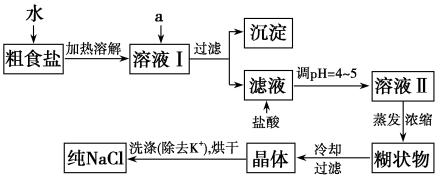
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO ,选出a所代表的试剂,按滴加顺序依次为
,选出a所代表的试剂,按滴加顺序依次为___________ (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为___________ 。
Ⅱ.工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如图:
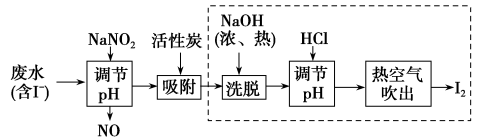
(2)向废水中加入NaNO2并调节pH<4,写出此反应的离子方程式:___________ 。
(3)写出该流程加入HCl调节pH发生的反应的离子方程式:___________ 。
(4)工业上虚线框内流程还可用下图操作代替,试评价图中替代流程的优点:___________ (写出一条即可)。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO
 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO
 ,选出a所代表的试剂,按滴加顺序依次为
,选出a所代表的试剂,按滴加顺序依次为②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为
Ⅱ.工业上用活性炭吸附海带提碘后废水中的I-制取I2,其流程如图:

(2)向废水中加入NaNO2并调节pH<4,写出此反应的离子方程式:
(3)写出该流程加入HCl调节pH发生的反应的离子方程式:
(4)工业上虚线框内流程还可用下图操作代替,试评价图中替代流程的优点:

您最近一年使用:0次
名校
解题方法
6 . 工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再蒸发结晶可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______ ,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______ ,然后加入适量的_______ ,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为___________ ,Fe3+完全沉淀时溶液的pH为___________ ,通过计算即可确定上述方案是否可行。
(1)为除去溶液中的Fe2+,可先加入
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp = 1×10-38,Cu(OH)2的溶度积Ksp=3×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol•L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3mol•L-1,则Cu(OH)2开始沉淀时溶液的pH为
您最近一年使用:0次
2021-08-24更新
|
1679次组卷
|
9卷引用:第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)
(已下线)第三章 水溶液中的离子反应与平衡(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)河南省洛阳市2020-2021学年高二上学期期中考试化学试题山东省莱西市第一中学2020-2021学年高二上学期12月月考化学试题课选择性必修1 专题3 第四单元 课时2 Ksp相关计算及其图像分析吉林省延边第二中学2020-2021学年高二上学期第二次考试月考化学试题(已下线)第三章第四节 难溶电解的溶解平衡(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)吉林省汪清县第六中学2021-2022学年高二12月月考化学试题吉林省延边第二中学2022-2023学年高二上学期期末考试化学试题3.4.2沉淀溶解平衡原理的应用 课后
名校
解题方法
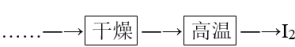
7 . 海带中含有碘元素。从海带中提取碘的实验过程如下图所示,下列说法正确的是

| A.步骤①主要在蒸发皿中进行 |
B.步骤④的离子方程式为 |
| C.步骤⑤中,先从分液漏斗下口放出水,再从下口放出含碘苯溶液 |
| D.步骤⑥的操作为蒸馏 |
您最近一年使用:0次
2021-05-06更新
|
460次组卷
|
7卷引用:第八章 化学与可持续发展(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
(已下线)第八章 化学与可持续发展(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试A卷】江苏省南通市启东市、通州区2020-2021学年高一下学期期中联考化学试题(已下线)专题11 自然资源的开发利用【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)江苏省盐城市伍佑中学2021-2022学年高一下学期期中考试化学(选修)试题(已下线)8.1.1 金属矿物和海水资源的开发利用-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
名校
8 . 海洋化学资源的综合利用对人类的发展意义重大。
(1)以海水为原料获得的粗盐中含有CaCl2、MgCl2、Na2SO4和难溶性杂质。
①除去难溶性杂质,实验室常用的分离操作是___________ 。
②除去可溶性杂质,所选试剂及加入的顺序依次是NaOH、___________ 、___________ 、稀盐酸。
(2)从海带中提取碘的工业生产过程如下:
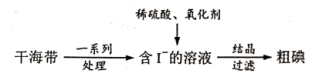
①氧化剂将 。下列氧化剂中,最好选用
。下列氧化剂中,最好选用___________ (填字母)。
a.酸性KMnO4 b. H2O2 c.浓硫酸
②实验室中常用CCl4从氧化后的溶液中萃取I2,其原理是___________ 。
(3)从海水中提取镁的过程是将海水中的Mg2+转变为无水MgCl2,电解熔融MgCl2得到金属镁。该过程中属于氧化还原反应的化学方程式为___________ 。
(1)以海水为原料获得的粗盐中含有CaCl2、MgCl2、Na2SO4和难溶性杂质。
①除去难溶性杂质,实验室常用的分离操作是
②除去可溶性杂质,所选试剂及加入的顺序依次是NaOH、
(2)从海带中提取碘的工业生产过程如下:

①氧化剂将
 。下列氧化剂中,最好选用
。下列氧化剂中,最好选用a.酸性KMnO4 b. H2O2 c.浓硫酸
②实验室中常用CCl4从氧化后的溶液中萃取I2,其原理是
(3)从海水中提取镁的过程是将海水中的Mg2+转变为无水MgCl2,电解熔融MgCl2得到金属镁。该过程中属于氧化还原反应的化学方程式为
您最近一年使用:0次
2021-01-27更新
|
922次组卷
|
6卷引用:第4章 化学与自然资源的开发利用(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)
(已下线)第4章 化学与自然资源的开发利用(培优提升卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)江苏省连云港市2020-2021学年高一上学期期末调研考试化学试题(已下线)专题11 自然资源的开发利用【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)福建省福州第二中学2021-2022学年高一上学期12月月考化学试题福建省福州第一中学2021-2022学年高一上学期期末考试化学试题四川省甘孜州2021-2022学年高一下学期学业质量统一监测期末统考化学试题
解题方法
9 . 下列有关海水提镁的说法不正确的是( )
A.贝壳在海水提镁的工业流程中主要经历了 的过程 的过程 |
B.利用 将 将 转化为 转化为 沉淀,然后电解 沉淀,然后电解 制备纯镁 制备纯镁 |
C.工业生产中是利用电解熔融的 制备镁 制备镁 |
D.在海水提镁的工业流程中,氯气可以循环利用,用于制备盐酸,再溶解 |
您最近一年使用:0次
19-20高一·全国·单元测试
10 . 为了除去粗盐中的Ca2+、Mg2+、SO 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是_____________
(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
 及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是
及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是(1)过滤;(2)加过量的NaOH溶液;(3)加适量HCl;(4)加过量的Na2CO3溶液;(5)加过量的BaCl2溶液
您最近一年使用:0次



