名校
解题方法
1 . 现有含有少NaCl、 、
、 等杂质的
等杂质的 溶液,选择适当的试剂除去杂质,得到纯净的
溶液,选择适当的试剂除去杂质,得到纯净的 固体,实验流程如下图所示。
固体,实验流程如下图所示。

(1)沉淀A的主要成分是___________ (填化学式)。
(2)③加入过量的Y的目的是___________ 。
(3)溶液3中肯定含有的杂质是___________ ,为除去杂质可向溶液3中加入过量的___________ 。
 、
、 等杂质的
等杂质的 溶液,选择适当的试剂除去杂质,得到纯净的
溶液,选择适当的试剂除去杂质,得到纯净的 固体,实验流程如下图所示。
固体,实验流程如下图所示。 
(1)沉淀A的主要成分是
(2)③加入过量的Y的目的是
(3)溶液3中肯定含有的杂质是
您最近一年使用:0次
2 . 某废旧金属材料中主要含Fe、Cu、Al、 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去_______ 。
(2)“碱浸”时发生反应的化学方程式为_______ 。
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是_______ 。
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为_______ 。
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为_______ 。
①设计实验检验滤液Ⅱ中是否含有上述离子:_______ 。
②若要定量测定所得绿矾纯度,可通过如下方法:称取 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为_______ 。(写出计算过程,结果保留三位有效数字)已知: (未配平)
(未配平)
 、
、 、
、 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收Al、Cu、绿矾等。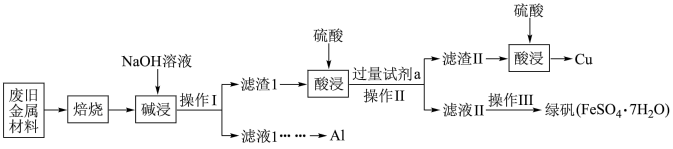
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的化学方程式为
(3)操作Ⅰ、Ⅱ中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为
(5)滤液Ⅱ中可能含有因氧气的作用而产生的少量杂质离子,该反应的离子方程式为
①设计实验检验滤液Ⅱ中是否含有上述离子:
②若要定量测定所得绿矾纯度,可通过如下方法:称取
 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性
的酸性 溶液,恰好完全反应时,消耗酸性
溶液,恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为 ,则
,则 的纯度为
的纯度为 (未配平)
(未配平)
您最近一年使用:0次
2023-07-28更新
|
446次组卷
|
2卷引用:内蒙古自治区乌海市第一中学2023-2024学年高一下学期4月第一次月考化学试题
名校
解题方法
3 . 某磁铁矿石A的主要成分是磁性氧化铁(Fe3O4),还含少量的Al2O3、Cu2O。某工厂利用此矿石进行有关物质的回收利用,工艺流程如图:(已知Cu2O不溶于水和碱,但溶于酸:Cu2O+2H+=Cu+Cu2++H2O)。根据流程回答下列问题:
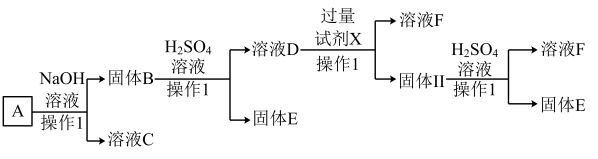
(1)溶液C的主要成分是_______ 。
(2)在溶液F中滴加NaOH溶液的现象是_______ ;发生的化学反应方程式为_______ 。
(3)检验溶液F中金属离子的方法是:_______ (请写出实验操作和现象、结论)

(1)溶液C的主要成分是
(2)在溶液F中滴加NaOH溶液的现象是
(3)检验溶液F中金属离子的方法是:
您最近一年使用:0次
名校
解题方法
4 . 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如图:
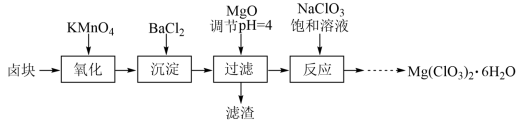
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T )变化曲线如图所示:

(1)过滤所需要的玻璃仪器有______ 。
(2)如图是某学生的过滤操作示意图,其操作不规范的是______ (填标号)。
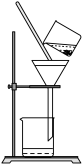
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀全?______
(4)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,请利用该反应,结合图象,制取Mg(ClO3)2·6H2O的实验步骤依次为:①取样,加入NaClO3饱和溶液充分反应,②______ ;③______ ;④______ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T )变化曲线如图所示:

(1)过滤所需要的玻璃仪器有
(2)如图是某学生的过滤操作示意图,其操作不规范的是

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(3)加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀全?
(4)加入NaClO3饱和溶液会发生如下反应:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓,请利用该反应,结合图象,制取Mg(ClO3)2·6H2O的实验步骤依次为:①取样,加入NaClO3饱和溶液充分反应,②
您最近一年使用:0次
2020-02-16更新
|
269次组卷
|
2卷引用:内蒙古赤峰二中人教版高中化学必修1同步练习:第一章第1节第一课时 化学实验安全
解题方法
5 . 已知某粗盐样品中含有Na2SO4、MgCl2、CaCl2等杂质.实验室提纯流程如下:

(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是__________ 。
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是__________________________
(3)第④步操作发生反应的化学方程式是_______________________
(4)第⑤步操作的目的是___________________________
(5)第⑥步操作a的名称是________ ,此步操作中,玻璃棒的末端要轻轻地斜靠在 _____________ 的一边。
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是_____________ ,此步操作中产生气泡的化学方程式是___________________ 。
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是_______________________

(1)用托盘天平称量粗盐时,若砝码和粗盐位置放颠倒,天平平衡时,读数为5.4g,实际称得粗盐的质量是
A.5.4g B.4.6g C.6.0g D.5.0g
(2)第③步操作发生反应的化学方程式是
(3)第④步操作发生反应的化学方程式是
(4)第⑤步操作的目的是
(5)第⑥步操作a的名称是
(6)第⑦步操作中,向滤液中滴加足量盐酸的目的是
(7)在第⑧步操作时,要用玻璃棒不断搅拌,目的是
您最近一年使用:0次
2020-01-17更新
|
134次组卷
|
2卷引用:内蒙古自治区赤峰四中2021-2022学年高一上学期第一次月考化学试题
6 . 从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的工艺流程如下:

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为_________________________ 。
(2)灼烧用的仪器_________________ 填名称)。
(3)沉淀A的成分是______________ (填化学式)。
(4)冶炼铝的化学方程式__________________________________ 。

请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为
(2)灼烧用的仪器
(3)沉淀A的成分是
(4)冶炼铝的化学方程式
您最近一年使用:0次
解题方法
7 . 经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
(1)c(H+)=________ mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).
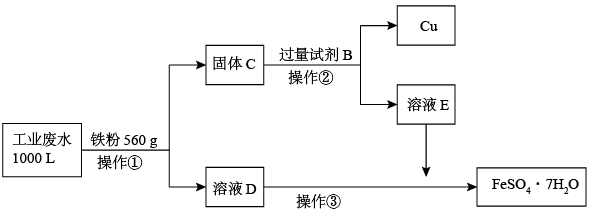
① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、________________ 、_________________ 。
②试剂B是__________ 。
③ 操作③是_____________ 、_____________ 、过滤,最后用少量冷水洗涤晶体,在低温下干燥。
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是__________________ 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是___________________________ 。若将所得FeSO4·7H2O配成溶液,向溶液中滴加NaOH溶液的现象是_________________________________________________________________ 。
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是_________ mol。
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(1)c(H+)=
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O).

① 工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+ =Fe2++Cu、
②试剂B是
③ 操作③是
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是
⑤ 获得的FeSO4·7H2O需密闭保存,原因是
⑥上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是
您最近一年使用:0次
2019高三·全国·专题练习
名校
解题方法
8 . 除去粗盐中的杂质MgCl2、CaCl2和Na2SO4,过程如下: 不正确 的是
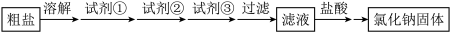
| A.试剂①、②、③分别是NaOH、Na2CO3、BaCl2 |
| B.除去Ca2+的主要反应:Ca2+ + CO32-=CaCO3↓ |
| C.检验SO42-是否除净的方法:取适量滤液,加稀盐酸酸化,再加BaCl2溶液 |
| D.加稀盐酸调节pH后,采用蒸发结晶的方法得到NaCl固体 |
您最近一年使用:0次
2019-01-24更新
|
827次组卷
|
9卷引用:内蒙古赤峰市宁城县2018-2019学年高一上学期期末考试化学试题
(已下线)内蒙古赤峰市宁城县2018-2019学年高一上学期期末考试化学试题(已下线)【南昌新东方】南昌三中2019-2020 高一(上)期末广西壮族自治区桂林市七星区桂林市第十八中学2020-2021学年高一上学期期中考试化学试题广东省广州市白云中学2022-2023学年高一下学期期中考试化学试题天津市2022-2023学年高一下学期学业水平合格考模拟化学试题北京师范大学附属中学2022-2023学年高一下学期期中考试化学试题天津市武清区黄花店中学2023-2024学年高一下学期第一次月考化学试题(文科)(已下线)考点20 化学基础实验——《备战2020年高考精选考点专项突破题集》2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
名校
解题方法
9 . ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
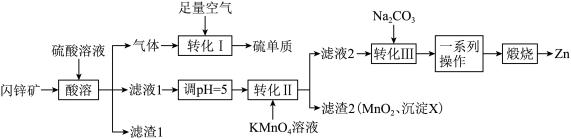
请回答下列问题:
(1)滤渣1的化学式为_______ ,
(2)沉淀X的化学式为______________ 。
(3)“转化Ⅱ”中主要反应的离子方程式为___________________________ 。
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为__________________ 。

请回答下列问题:
(1)滤渣1的化学式为
(2)沉淀X的化学式为
(3)“转化Ⅱ”中主要反应的离子方程式为
(4)“一系列操作”包括过滤、洗涤、干燥。洗涤沉淀的操作为
您最近一年使用:0次
名校
10 . 如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钠溶液中得到氯化钠固体,选择装置________ (填代表装置图的字母,下同);
(2)从碘水中分离出I2,选择装置________ ,该分离方法的名称为(两个)_______ 。
(3)装置A中①的名称是________ 。
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:


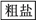

 ―→
―→
粗盐中含Ca2+、Mg2+、Fe3+、SO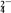 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液
④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是________ (填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦

(1)从氯化钠溶液中得到氯化钠固体,选择装置
(2)从碘水中分离出I2,选择装置
(3)装置A中①的名称是
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如下流程的实验:



 ―→
―→
粗盐中含Ca2+、Mg2+、Fe3+、SO
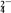 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液
④加入适量盐酸 ⑤溶解 ⑥过滤 ⑦蒸发
正确的操作顺序是
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
您最近一年使用:0次



