名校
1 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
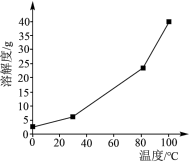
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
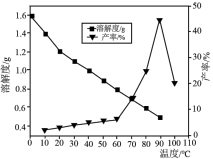
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近一年使用:0次
名校
2 . 下列事实中,可以用胶体性质解释的是
| A.利用醋酸除去水垢 |
B.向 溶液中滴加 溶液中滴加 溶液产生白色沉淀 溶液产生白色沉淀 |
| C.可以用过滤的方法除去粗食盐水中的难溶杂质 |
| D.黑暗的电影院中,放映口发出的光会在影院中形成光柱 |
您最近一年使用:0次
2024-03-12更新
|
110次组卷
|
2卷引用:黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题
名校
3 . 连二亚硫酸钠( )俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种(
)俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种( )的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法错误的是
)的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法错误的是
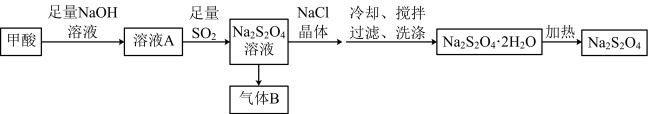
 )俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种(
)俗称保险粉,是一种强还原剂,广泛用于纺织工业。某种( )的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法错误的是
)的生产工艺流程如图所示,若在实验室模拟该工艺流程,下列说法错误的是
| A.可用银氨溶液鉴别甲醇中是否含有甲酸 |
B.NaCl溶解度大于 的溶解度 的溶解度 |
| C.过滤操作中需要用的玻璃仪器有漏斗、烧杯、玻璃棒 |
D.由溶液A制备 溶液过程中,氧化剂与还原剂的质量之比为2:1 溶液过程中,氧化剂与还原剂的质量之比为2:1 |
您最近一年使用:0次
名校
解题方法
4 . 实验室由安息香制备二苯乙二酮的反应式如下:
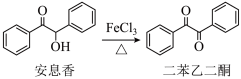
相关信息列表如下:
装置示意图如下图所示,实验步骤为:
①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g FeCl3∙6H2O,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。

回答下列问题:
(1)仪器A中应加入___________ (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是___________ ;冷却水应从___________ (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是___________ 。
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为___________ ;某同学尝试改进本实验:采用催化量的FeCl3并通入空气制备二苯乙二酮。该方案是否可行?简述判断理由___________ 。
(5)若粗品中混有少量未氧化的安息香,可用少量___________ 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(6)本实验的产率最接近于___________ (填标号)。
a.85% b.80% c.75% d.70%

相关信息列表如下:
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 安息香 | 白色固体 | 133 | 344 | 难溶于冷水 溶于热水、乙醇、乙酸 |
| 二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水 溶于乙醇、苯、乙酸 |
| 冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |
①在圆底烧瓶中加入10mL冰乙酸、5mL水及9.0g FeCl3∙6H2O,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。

回答下列问题:
(1)仪器A中应加入
(2)仪器B的名称是
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是
(4)在本实验中,FeCl3为氧化剂且过量,其还原产物为
(5)若粗品中混有少量未氧化的安息香,可用少量
a.热水 b.乙酸 c.冷水 d.乙醇
(6)本实验的产率最接近于
a.85% b.80% c.75% d.70%
您最近一年使用:0次
2023-12-28更新
|
167次组卷
|
2卷引用:黑龙江省大庆市肇州县第二中学2023-2024学年高三上学期12月月考化学试题
5 . 从海带中提取碘的实验过程中,涉及下列操作,其中正确的是


| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
您最近一年使用:0次
2023-08-03更新
|
830次组卷
|
90卷引用:黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题
黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题黑龙江省大庆市铁人中学2020-2021学年高二上学期期末考试化学试题(已下线)2010年上海市虹口区高三第二次模拟考试化学试题(已下线)09~10年泰州中学高一下学期期末考试化学卷(已下线)2011届上海市卢湾区高三上学期期末考试化学试卷(已下线)2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)(已下线)2013届湖北省黄冈中学高三10月月考化学试卷(已下线)2013届广东省珠海市高三5月综合测试(二)理综化学试卷(已下线)2013届四川省乐山市高三“一调”考试理综化学试卷(已下线)2013届上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(已下线)2014届湖北省襄阳市襄州一中等四校高三上学期期中联考化学试卷(已下线)2013-2014学年江苏省南京市高淳区高一上学期期末考试化学试卷(已下线)2013-2014上海市静安区第二学期高二学业水平测试化学试卷(已下线)2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(已下线)2014届浙江省杭州外国语学校高二第二学期期中考试化学试卷 2014-2015河北省唐山一中高一上学期第二次月考化学试卷2015-2016学年山东省淄博市淄川一中高一上学期期中测试化学试卷2016届陕西省西北农林科技大学附属中学高三上学期期中化学试卷2015-2016学年山东省淄博五中高一下开学收心考试化学试卷2015-2016学年浙江省杭州市西湖高中高二5月月考化学试卷2015-2016学年湖南常德一中高一下期末化学试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2017届新疆哈密地区第二中学高三上月考二化学卷2016-2017学年黑龙江双鸭山一中高一上期中考试化学试卷2016-2017学年广西桂林中学高一上学期段考化学卷(已下线)同步君 必修2 第4章 第1节 海水资源的开发利用2016-2017学年河北省承德一中高一上学期月考二化学试卷 2016-2017学年广东省肇庆市高一上学期期末化学试卷福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题甘肃省武威市第六中学2016-2017学年高一下学期期末考试化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题甘肃省会宁县第四中学2018届高三上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(B)高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用浙江省诸暨中学2017-2018学年高二上学期第二阶段考试化学试题(已下线)2018年5月23日 海带提碘——《每日一题》2017-2018学年高一化学人教必修2云南省景东县第一中学2017-2018学年高一下学期6月份考试化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二下学期10月月考化学试题河南省驻马店经济开发区高级中学2018-2019学年高一上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高一上学期期中考试化学试题云南省普洱市景东一中2018-2019学年高一上学期期末考试化学试题江西省南昌市第十中学2018-2019学年高一下学期期末考试化学试题内蒙古开来中学2018-2019学年高一下学期期末考试化学试题(已下线)2019年8月18日 《每日一题》 (一轮复习) 每周一测海南省海口第四中学2018-2019学年高一下学期期末(选考)化学试题上海市浦东新区2016-2017学年高一上学期期末考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高一上学期期中考试化学试题湖南省麓山国际学校人教版高中化学必修2检测第四章单元检测2020届高三化学二轮微专题突破训练:物质的检验、分离与提纯(已下线)上海市静安区2012-2013学年高二下学期期中教学质量检测化学试题(已下线)上海卢湾区2011届高三一模化学试题(已下线)上海市奉贤区2012届高三上学期期末调研测试化学试题(已下线)上海市闸北区2010届高三第二次模拟考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第三次月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题甘肃省武威市民勤县第一中学2019-2020学年高一下学期期末考试(理)化学试题重庆市主城区七校2019-2020学年高一下学期期末考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期中考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期末考试化学试题黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题河北省张家口市第一中学2019-2020学年高二上学期开学考试化学试题(实验班)山东省临沂市2019-2020学年高一下学期期末考试化学试题湖南省长沙市雨花区2017-2018学年高一下学期期末考试化学试题云南省曲靖市第二中学学联体2019-2020学年高二下学期联合考试(第四次)化学试题河南省南阳市第一中学2020-2021学年高一上学期第一次月考化学试题内蒙古包头市第一中学2020-2021学年高一上学期10月月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题上海市杨浦高级中学2019-2020学年高一上学期期末考化学试题(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用江苏省南京市高淳高级中学2021届高三10月阶段性检测化学试题上海市黄浦区向明中学2020-2021学年高一上学期期末化学试题山东省枣庄市第八中学2020-2021学年高一4月月考化学试题山东省济南市第一中学2020-2021学年高一下学期期中考试化学试题(等级考)(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市第二十中学2020-2021学年高一下学期期末考试化学试题贵州省遵义市2021 2022学年高二上学期第一次月考化学试题四川省成都外国语学校2021-2022学年高一上学期期中化学试题山东省东营市广饶县第一中学2021-2022学年高一3月线上检测化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)河北省张家口市张北县第一中学2021-2022学年高一下学期6月月考化学试题四川省安岳县兴隆中学2020-2021学年高一上学期9月月考化学试题(已下线)第八章 化学与可持续发展(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)陕西省宝鸡市金台区2022-2023学年高一下学期期末考试化学试题河北省唐县第一中学2023-2024学年高一上学期10月月考化学试题广东省佛山市第四中学2023-2024学年上学期高二开学考试化学试题第1课时 金属矿物、海水资源的开发利用1(已下线)第八章 化学与可持续发展【单元测试B卷】
6 . 杯酚(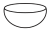 )能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
)能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
 )能够分离提纯C60与C70,其原理如图所示。下列说法错误的是
)能够分离提纯C60与C70,其原理如图所示。下列说法错误的是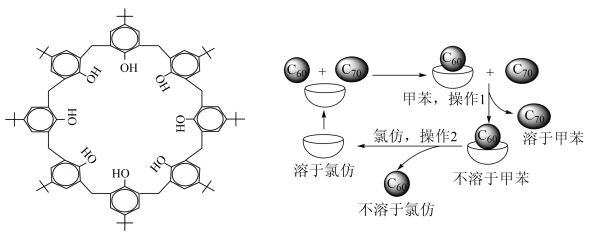
| A.操作1用到的主要玻璃仪器有普通漏斗、烧杯、玻璃棒 |
| B.杯酚与C60分子之间靠共价键结合形成超分子 |
| C.杯酚可溶于氯仿循环使用 |
| D.杯酚晶体属于分子晶体 |
您最近一年使用:0次
2023-05-25更新
|
522次组卷
|
6卷引用:黑龙江省大庆铁人中学2023-2024学年高二下学期开学考试化学试题
黑龙江省大庆铁人中学2023-2024学年高二下学期开学考试化学试题山西省晋中市2023届高三下学期5月普通高等学校招生模拟(三模)理科综合化学试题(A卷)(已下线)考点巩固卷06 物质结构与性质(4大考点55题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)第15讲物质的检验、分离和提纯河南省商丘名校联考2022-2023学年高二下学期7月期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二下学期4月月考化学试题
名校
7 . 某学习小组用含有少量杂质(主要为 )的粗盐制取较纯净的
)的粗盐制取较纯净的 ,实验前他们设计了如图所示的实验方案。
,实验前他们设计了如图所示的实验方案。
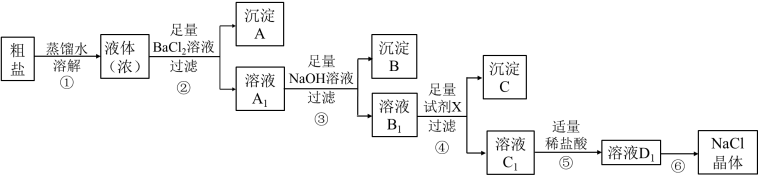
请回答:
(1)步骤②中除去的杂质离子是_______ 。
(2)试剂X是_______ ;用离子方程式表示其作用_______ 、_______ 。
(3)写出步骤⑤中发生反应的离子方程式_______ 、_______ 。
(4)步骤⑥的操作是_______ 。
 )的粗盐制取较纯净的
)的粗盐制取较纯净的 ,实验前他们设计了如图所示的实验方案。
,实验前他们设计了如图所示的实验方案。
请回答:
(1)步骤②中除去的杂质离子是
(2)试剂X是
(3)写出步骤⑤中发生反应的离子方程式
(4)步骤⑥的操作是
您最近一年使用:0次
2022-10-28更新
|
153次组卷
|
2卷引用:黑龙江省大庆铁人中学2022-2023学年高一上学期第一次月考化学试题
8 . 下列实验装置正确且能达到实验目的的是
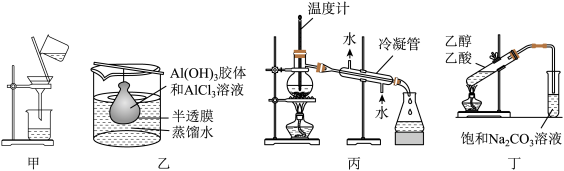

| A.用甲装置除去食盐水中混有的不溶杂质 |
| B.用乙装置提纯Al(OH)3胶体 |
| C.用丙装置分离苯和硝基苯的混合物 |
| D.用丁装置进行制备并收集乙酸乙酯 |
您最近一年使用:0次
2022-08-27更新
|
112次组卷
|
3卷引用:黑龙江省大庆铁人中学2021-2022学年高二下学期期末考试化学试题
名校
9 . 检验黑木耳中的铁离子的步骤为:灼烧黑木耳→加酸溶解→过滤→取滤液检验,所选择的装置(夹持装置已略去)及操作正确的是
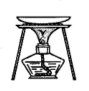 |  | 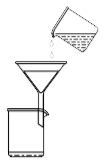 |  |
| A.灼烧木耳 | B.加酸后搅拌溶解 | C.过滤得滤液 | D.检验滤液铁离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-08-04更新
|
836次组卷
|
9卷引用:黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题
黑龙江省大庆市实验中学2021-2022学年高三上学期开学考试化学试题广东省2022届高三8月阶段性质量检测化学试题(已下线)押广东卷化学第7题 实验基础操作-备战2022年高考化学临考题号押题(广东卷)(已下线)考点14 铁及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题05 元素及化合物的性质-备战2023年高考化学母题题源解密(广东卷)山东省临沂市郯城县美澳学校2022-2023学年高一上学期线上期末检测化学试题(已下线)题型31 Fe2+、Fe3+的检验与性质探究(已下线)考点14 铁及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)章末检测卷(三) 物质的性质与转化
10 . 某工厂用六水合氯化镁和粗石灰制取的氢氧化镁含有少量氢氧化铁杂质,通过如下流程进行提纯精制,获得阻燃剂氢氧化镁。下列说法不正确的是
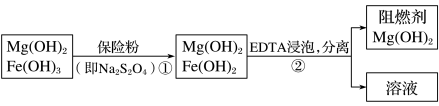

| A.步骤①中保险粉是作还原剂,步骤②中分离操作的名称是过滤 |
B.步骤①中的反应式:3Fe(OH)3+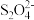 +2OH-=3Fe(OH)2+2 +2OH-=3Fe(OH)2+2 +4H2O +4H2O |
| C.Mg(OH)2可以作阻燃剂是因为它分解需要吸收大量的热 |
| D.从步骤②中可知OH-和EDTA共存时,Fe2+更易和EDTA结合,生成可溶性化合物 |
您最近一年使用:0次
2021-07-31更新
|
872次组卷
|
5卷引用:黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题
黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题(已下线)2022年新高考化学时事热点情境化考题---镁铝及其化合物天津市第一中学2021-2022学年高三上学期第三次月考化学试题(已下线)秘籍10 金属元素及化合物的相互转化与推断-备战2022年高考化学抢分秘籍(全国通用)(已下线)第三章 金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)



