解题方法
1 . 某实验小组设计粗 固体(只含有少量NaCl)的提纯方案如下:
固体(只含有少量NaCl)的提纯方案如下:
 固体(只含有少量NaCl)的提纯方案如下:
固体(只含有少量NaCl)的提纯方案如下: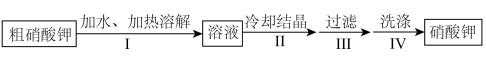
| A.操作Ⅰ中依据硝酸钾的溶解度估算加水量 |
| B.操作Ⅱ缓慢冷却有利于硝酸钾析出大晶体 |
| C.操作Ⅲ常用到的玻璃仪器为玻璃棒、烧杯和漏斗 |
| D.操作Ⅳ用热水洗涤晶体 |
您最近一年使用:0次
2 . 下列实验能达到实验目的的是
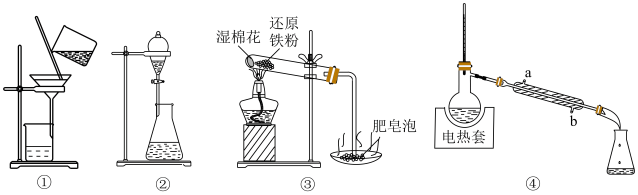
| A.图①操作可除去溴水中的溴单质 |
| B.图②操作用于分离饱和碳酸钠溶液和乙酸乙酯,将分层的液体依次从下口放出 |
| C.图③装置进行铁与水蒸气的反应,点燃肥皂泡检验氢气 |
| D.图④装置用于蒸馏、收集低沸点成分,冷凝水应该从 a口进b口出 |
您最近一年使用:0次
2023-11-09更新
|
470次组卷
|
3卷引用:浙江省杭州市2023-2024学年高三上学期11月期中考试(一模)化学试题
浙江省杭州市2023-2024学年高三上学期11月期中考试(一模)化学试题(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省部分学校2024届高三下学期模拟考试化学试卷
3 . 通过海水晾晒可以得到粗盐,粗盐除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,下图是粗盐提纯的实验流程(每次所加的试剂均过量)。
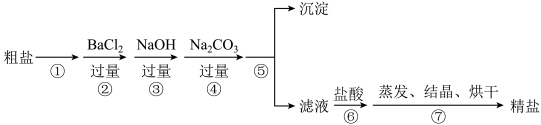
下列说法不正确的是

下列说法不正确的是
| A.步骤①和⑤的操作分别是溶解、过滤 |
| B.步骤③中试剂NaOH不能换成KOH |
| C.步骤④可以与步骤②互换顺序 |
| D.步骤⑥加盐酸时需用pH试纸测定溶液呈中性或微酸性 |
您最近一年使用:0次
4 . 下列图示与操作名称对应错误 的是
| A | B | C | D |
| 常压蒸馏 | 萃取分液 | 常压过滤 | 加热升华 |
 | 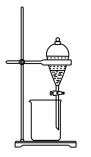 |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 从海带中提取碘的实验过程中,涉及下列操作,其中正确的是


| A.将海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
您最近一年使用:0次
2023-08-03更新
|
828次组卷
|
90卷引用:2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)
(已下线)2011-2012学年浙江省余姚中学高一上学期期中化学(理)试卷(化学实验班)(已下线)2014届浙江省杭州外国语学校高二第二学期期中考试化学试卷 2015-2016学年浙江省杭州市西湖高中高二5月月考化学试卷浙江省诸暨中学2017-2018学年高二上学期第二阶段考试化学试题(已下线)2010年上海市虹口区高三第二次模拟考试化学试题(已下线)09~10年泰州中学高一下学期期末考试化学卷(已下线)2011届上海市卢湾区高三上学期期末考试化学试卷(已下线)2013届湖北省黄冈中学高三10月月考化学试卷(已下线)2013届广东省珠海市高三5月综合测试(二)理综化学试卷(已下线)2013届四川省乐山市高三“一调”考试理综化学试卷(已下线)2013届上海市四区(杨浦、青浦、宝山、静安)高三下学期二模化学试卷(已下线)2014届湖北省襄阳市襄州一中等四校高三上学期期中联考化学试卷(已下线)2013-2014学年江苏省南京市高淳区高一上学期期末考试化学试卷(已下线)2013-2014上海市静安区第二学期高二学业水平测试化学试卷(已下线)2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷2014-2015河北省唐山一中高一上学期第二次月考化学试卷2015-2016学年山东省淄博市淄川一中高一上学期期中测试化学试卷2016届陕西省西北农林科技大学附属中学高三上学期期中化学试卷2015-2016学年山东省淄博五中高一下开学收心考试化学试卷2015-2016学年湖南常德一中高一下期末化学试卷2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷2017届湖南省岳阳市华容县四校高三联考二化学试卷2017届新疆哈密地区第二中学高三上月考二化学卷2016-2017学年黑龙江双鸭山一中高一上期中考试化学试卷2016-2017学年广西桂林中学高一上学期段考化学卷(已下线)同步君 必修2 第4章 第1节 海水资源的开发利用2016-2017学年河北省承德一中高一上学期月考二化学试卷 2016-2017学年广东省肇庆市高一上学期期末化学试卷福建省三明市第一中学2016-2017学年高二下学期第二次月考化学试题甘肃省武威市第六中学2016-2017学年高一下学期期末考试化学试题黑龙江省大庆市第一中学2017-2018学年高一第一次阶段考试化学试题四川省乐山沫若中学2017-2018学年高一上学期第一次月考化学试题甘肃省会宁县第四中学2018届高三上学期期中考试化学试题内蒙古巴彦淖尔市第一中学2017-2018学年高一上学期期中考试化学试题(B)高中化学人教版 必修2 第四章 化学与自然资源的开发利用 第一节 开发利用金属矿物和海水资源 海水资源的开发利用(已下线)2018年5月23日 海带提碘——《每日一题》2017-2018学年高一化学人教必修2云南省景东县第一中学2017-2018学年高一下学期6月份考试化学试题【全国百强校】四川省南充市阆中中学2018-2019学年高二下学期10月月考化学试题河南省驻马店经济开发区高级中学2018-2019学年高一上学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高一上学期期中考试化学试题云南省普洱市景东一中2018-2019学年高一上学期期末考试化学试题江西省南昌市第十中学2018-2019学年高一下学期期末考试化学试题内蒙古开来中学2018-2019学年高一下学期期末考试化学试题(已下线)2019年8月18日 《每日一题》 (一轮复习) 每周一测海南省海口第四中学2018-2019学年高一下学期期末(选考)化学试题上海市浦东新区2016-2017学年高一上学期期末考试化学试题辽宁省沈阳市城郊市重点联合体2019-2020学年高一上学期期中考试化学试题湖南省麓山国际学校人教版高中化学必修2检测第四章单元检测2020届高三化学二轮微专题突破训练:物质的检验、分离与提纯(已下线)上海市静安区2012-2013学年高二下学期期中教学质量检测化学试题(已下线)上海卢湾区2011届高三一模化学试题(已下线)上海市奉贤区2012届高三上学期期末调研测试化学试题(已下线)上海市闸北区2010届高三第二次模拟考试化学试题新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高一上学期第三次月考化学试题辽宁省营口市部分重点高中2017-2018学年高二下学期期末考试化学试题甘肃省武威市民勤县第一中学2019-2020学年高一下学期期末考试(理)化学试题重庆市主城区七校2019-2020学年高一下学期期末考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期中考试化学试题海南省海口市海南枫叶国际学校2019-2020学年高一下学期期末考试化学试题黑龙江省牡丹江市第一高级中学2020-2021学年高二上学期8月开学考试化学试题河北省张家口市第一中学2019-2020学年高二上学期开学考试化学试题(实验班)山东省临沂市2019-2020学年高一下学期期末考试化学试题湖南省长沙市雨花区2017-2018学年高一下学期期末考试化学试题云南省曲靖市第二中学学联体2019-2020学年高二下学期联合考试(第四次)化学试题河南省南阳市第一中学2020-2021学年高一上学期第一次月考化学试题内蒙古包头市第一中学2020-2021学年高一上学期10月月考化学试题甘肃省临夏中学2020-2021学年高一上学期期中考试化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题上海市杨浦高级中学2019-2020学年高一上学期期末考化学试题(鲁科版2019)必修第二册 第1章 原子结构 元素周期律 微项目 海带提碘与海水提溴——体验元素性质递变规律的实际应用江苏省南京市高淳高级中学2021届高三10月阶段性检测化学试题上海市黄浦区向明中学2020-2021学年高一上学期期末化学试题黑龙江省大庆市铁人中学2020-2021学年高二上学期期末考试化学试题山东省枣庄市第八中学2020-2021学年高一4月月考化学试题山东省济南市第一中学2020-2021学年高一下学期期中考试化学试题(等级考)(已下线)8.1.2 海水资源的开发利用(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市第二十中学2020-2021学年高一下学期期末考试化学试题贵州省遵义市2021 2022学年高二上学期第一次月考化学试题四川省成都外国语学校2021-2022学年高一上学期期中化学试题山东省东营市广饶县第一中学2021-2022学年高一3月线上检测化学试题(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)河北省张家口市张北县第一中学2021-2022学年高一下学期6月月考化学试题四川省安岳县兴隆中学2020-2021学年高一上学期9月月考化学试题(已下线)第八章 化学与可持续发展(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)陕西省宝鸡市金台区2022-2023学年高一下学期期末考试化学试题河北省唐县第一中学2023-2024学年高一上学期10月月考化学试题广东省佛山市第四中学2023-2024学年上学期高二开学考试化学试题第1课时 金属矿物、海水资源的开发利用1(已下线)第八章 化学与可持续发展【单元测试B卷】
6 . 实验室可用如图流程制备苯甲醇和苯甲酸,已知苯甲醇易溶于水,苯甲酸微溶于水,且两者均易溶于乙醚等有机溶剂。下列说法不正确 的是
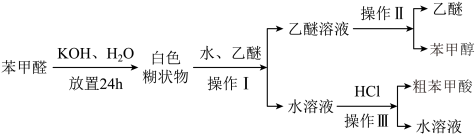

| A.操作I用到的主要仪器有烧杯、分液漏斗 |
| B.操作II利用乙醚和苯甲醇溶解性差异进行分离 |
| C.操作III是过滤 |
| D.粗苯甲酸能通过重结晶法提纯 |
您最近一年使用:0次
7 . 海带中有碘元素,从海带中提取碘的实验过程如图所示:
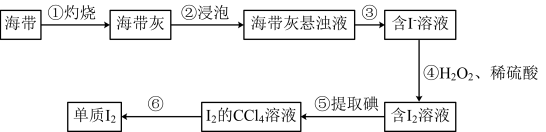
下列说法正确的是

下列说法正确的是
| A.实验步骤①需用到酒精灯、坩埚、泥三角、石棉网、三脚架等实验仪器 |
| B.步骤③的操作名称是过滤 |
| C.步骤④中反应的离子方程式为2I-+H2O2=I2+O2↑+2H+ |
| D.海带灰中含有的硫酸盐、碳酸盐等杂质是在步骤⑥中除去的 |
您最近一年使用:0次
8 . 为提纯含少量正丁醛杂质的1-丁醇粗品,某研究小组设计如下路线:

已知:①R-CHO + NaHSO3(饱和)→ RCH(OH)SO3Na↓
②乙醚沸点为34 ℃,密度为0.714 g/cm3;1-丁醇沸点为118 ℃
下列说法正确的是

已知:①R-CHO + NaHSO3(饱和)→ RCH(OH)SO3Na↓
②乙醚沸点为34 ℃,密度为0.714 g/cm3;1-丁醇沸点为118 ℃
下列说法正确的是
| A.操作1用到的玻璃仪器有烧杯、漏斗和玻璃棒 |
| B.操作2中,乙醚可以用乙醇代替 |
| C.操作2分液时,有机层从分液漏斗下口放出 |
| D.操作3是蒸馏,蒸馏温度要求略高于118 ℃ |
您最近一年使用:0次
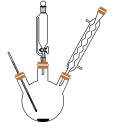
9 . 硫代硫酸钠(Na2S2O3∙5H2O)俗称大苏打,主要用作照相业定影剂。实验室中用工业硫化钠、纯碱、二氧化硫等物质制备硫代硫酸钠晶体的流程如下:

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


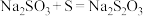
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和___________ ;回流适用的加热方式是___________ 。
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是___________ 。
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:
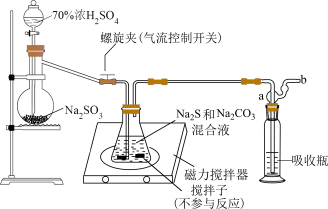
①锥形瓶中发生总反应的化学方程式为___________ ;反应中Na2CO3固体的用量不宜过少,理由是___________ 。
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是___________ 。
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:________
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出

已知:
①工业硫化钠含有重金属硫化物、煤粉等杂质而呈红褐色或棕黑色。硫化钠易溶于水,微溶于乙醇,能溶于热的乙醇。
②用硫化钠制备硫代硫酸钠的反应大致可分为三步进行:


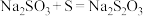
③Na2S2O3∙5H2O易溶于水,难溶于乙醇,50℃开始失去结晶水
请回答:
(1)步骤Ⅰ回流用到的主要玻璃仪器有圆底烧瓶和
A.水浴加热 B.油浴加热 C.酒精灯直接加热 D.电热套温和加热
(2)步骤Ⅱ趁热过滤的目的是
(3)步骤Ⅳ、Ⅴ制备Na2S2O3∙5H2O的装置如图所示:

①锥形瓶中发生总反应的化学方程式为
②步骤Ⅴ,当锥形瓶中溶液pH≈7时应停止通入SO2,若继续通入SO2,将导致产率降低,理由是
(4)步骤Ⅵ,选出获取Na2S2O3∙5H2O晶体过程中合理的操作并排序:
过滤,取滤液→___________→___________→___________→___________→___________→40℃下干燥40~60分钟→产品。
a.蒸发浓缩至产生细密的气泡且溶液表面出现晶膜
b.蒸发浓缩至大量晶体析出
c.停止加热,自然冷却
d.加乙醇洗涤晶体2~3次
e.过滤
f.加入乙醇,促使晶体快速析出
您最近一年使用:0次
解题方法
10 . 高纯硫酸锰作为合成镍钴锰三元聚合物锂电池的正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下图所示:
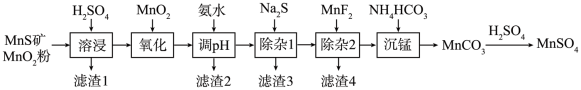
相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答:
(1)“溶浸”步骤中,可加快溶浸速率的措施有___________ (写两条)。
(2)下列有关该工艺流程的叙述正确的是___________。
(3)“除杂2”步骤的目的是生成MgF2沉淀从而除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,请从平衡移动的角度解释其原因___________ 。
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。______
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
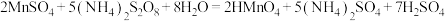
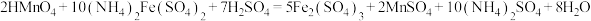 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
用___________ 称量 MnSO4样品0.250g→用100mL容量瓶将MnSO4样品配成100mL溶液→用___________ 取待测液25.00mL于锥形瓶中→加入适量硫磷混合酸和硝酸银,再加入足量过硫酸铵充分反应→加热煮沸除去多余的过硫酸铵→用酸式滴定管盛装0.1000mol/L(NH4)2Fe(SO4)2标准溶液,滴定3次,分别消耗20.04mL、19.30mL、19.96mL。
②根据以上数据计算样品中MnSO4的质量分数___________ 。

相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”步骤中,可加快溶浸速率的措施有
(2)下列有关该工艺流程的叙述正确的是___________。
| A.“溶浸”步骤中的“滤渣1”的主要成分是S和SiO2(或不溶性硅酸盐) |
| B.“氧化”步骤中添加的MnO2的作用是催化剂 |
| C.“调pH”步骤中,溶液的pH范围应调节为4.7~6 |
D.“沉锰”步骤的离子方程式为 |
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
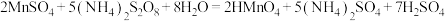
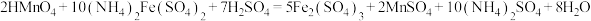 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:用
②根据以上数据计算样品中MnSO4的质量分数
您最近一年使用:0次



