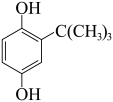
1 . 市售食用油中常添加叔丁基对苯二酚(TBHQ)作抗氧化剂。实验室制备TBHQ的原理:
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
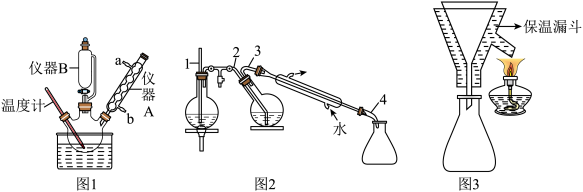
③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
回答下列问题:
(1)仪器B的名称是______ ,三颈烧瓶宜选择的规格是______ (填标号)。
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是______ ,步骤②中分批加入叔丁醇的目的是____________ 。
(3)步骤③中用水蒸气蒸馏的目的是____________ ,蒸馏终点的现象是____________ 。
(4)步骤③趁热过滤的目的是____________ 。
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是____ 。步骤④“在氮气中干燥”的优点是____ 。
(6)TBHQ的产率为______ (保留3位有效数字)%。
 +(CH3)3COH
+(CH3)3COH
 +H2O
+H2O
①在下图1装置的三颈烧瓶中依次加入1.1 g对苯二酚、8 mL 85%磷酸和10 mL甲苯。
②用热水浴加热使反应瓶中混合物升温至90℃,用滴管向反应瓶中分批滴加1 mL叔丁醇(密度为0.775 g·cm
 ),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。
),控制温度在90~95℃搅拌20 min,直至混合物中的固体全部溶解。③趁热将反应物转入分液漏斗中,分出磷酸层,向有机层加入10 mL水,进行水蒸气蒸馏,如下图2。蒸馏完毕,将剩余物趁热过滤,弃去不溶物,如下图3所示。滤液转入烧杯中,若剩余液体体积不足10 mL,应补加热水,使产物被热水所提取。
④将滤液在冰浴中冷却,析出白色晶体,抽滤,并用少量冷水洗涤两次,在氮气中干燥。得到1 g产品。
| 物质 | 甲苯 | 对苯二酚 | 2—叔丁基对苯二酚 | 磷酸 | 甲苯—水共沸物 |
| 熔点/℃ | -94 | 175.5 | 128 | 42.35 | |
| 沸点/℃ | 110.63 | 286 | 295 | 213 | 84.1 |
(1)仪器B的名称是
A.50mL B.100mL C.200mL D.500mL
(2)本实验中甲苯的作用是
(3)步骤③中用水蒸气蒸馏的目的是
(4)步骤③趁热过滤的目的是
(5)如果上图3锥形瓶内壁有白色晶体析出,需采取的措施是
(6)TBHQ的产率为
您最近一年使用:0次
2024-04-10更新
|
778次组卷
|
3卷引用:2024届辽宁省抚顺市六校协作体高三下学期第三次模拟化学试卷
名校
解题方法
2 . 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,制备少粉量Mg(ClO3)2•6H2O的流程如图所示:
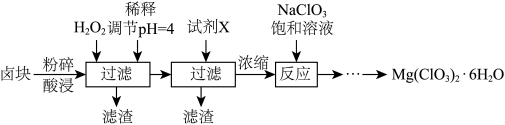
已知:
①卤块主要成分为Mg(ClO3)2•6H2O,含有较多的MgSO4、MgCO3、FeCl2等杂质。
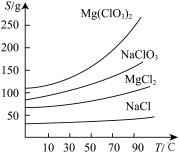
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。
(1)过滤的主要玻璃仪器是_______ 。
(2)加H2O2调节pH后过滤所得滤渣的主要成分为_______ 。
(3)试剂X的滴加顺序为_______ (填字母)。
a.BaCl2溶液,Na2CO3溶液,过滤后加适量盐酸
b.Na2CO3溶液,BaCl2溶液,过滤后加适量盐酸
c.以上两种顺序都可
(4)加入NaClO3饱和溶液后发生反应的化学方程式为_______ ,该反应能发生的原因是_______ ,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为①蒸发结晶;②_______ ;③冷却结晶;④过滤、洗涤。
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量4.40g产品配成100mL溶液;
步骤2:取10.00mL于锥形瓶中,加入30.00mL0.200mol•L-1Na2S2O3溶液;
步骤3:用0.100mol•L-1的碘液滴定剩余的Na2S2O3,此过程中反应的离子方程式为2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
步骤4:将步骤2、3重复两次,平均消耗标准碘液20.00mL。
①步骤2中,硫元素被氧化至最高价态,氯元素被还原到最低价,试写出该反应的离子方程式:_______ 。
②产品中Mg(ClO3)2•6H2O的质量分数为_______ (保留两位有效数字)。

已知:
①卤块主要成分为Mg(ClO3)2•6H2O,含有较多的MgSO4、MgCO3、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化的曲线如图所示。

(1)过滤的主要玻璃仪器是
(2)加H2O2调节pH后过滤所得滤渣的主要成分为
(3)试剂X的滴加顺序为
a.BaCl2溶液,Na2CO3溶液,过滤后加适量盐酸
b.Na2CO3溶液,BaCl2溶液,过滤后加适量盐酸
c.以上两种顺序都可
(4)加入NaClO3饱和溶液后发生反应的化学方程式为
(5)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量4.40g产品配成100mL溶液;
步骤2:取10.00mL于锥形瓶中,加入30.00mL0.200mol•L-1Na2S2O3溶液;
步骤3:用0.100mol•L-1的碘液滴定剩余的Na2S2O3,此过程中反应的离子方程式为2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;步骤4:将步骤2、3重复两次,平均消耗标准碘液20.00mL。
①步骤2中,硫元素被氧化至最高价态,氯元素被还原到最低价,试写出该反应的离子方程式:
②产品中Mg(ClO3)2•6H2O的质量分数为
您最近一年使用:0次
解题方法
3 . 二氯异氰尿酸钠的化学式为C3N3O3Cl2Na(简写为DCCNa,摩尔质量为220g/mol)。常温下DCCNa易溶于水难溶于乙醇。实验室可用氰尿酸(C3H3N3O3)与足量Cl2制备DCCNa:2Cl2+C3H3N3O3+3NaOH=C3N3O3Cl2Na+3H2O+2NaCl,实验装置如图所示(夹持装置和加热装置省略):
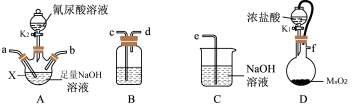
回答下列问题:
(1)仪器X的名称为___________ ;装置D发生的离子反应方程式为___________ 。
(2)B中试剂为___________ (填字母标号);
A.饱和NaCl溶液 B.CCl4 C.浓硫酸 D.NaOH溶液
完成上述产品的制备,装置连接的顺序为___________ 。
f→___________→___________→___________→___________→___________(填小写字母)。
(3)实验员认为可将插入NaOH溶液的导管下端加装多孔的球泡(如图),其目的是______ 。
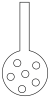
(4)反应结束后,关闭K1、K2,向X中加入乙醇,静置、减压过滤得粗品;
①乙醇的作用是___________ ;
②减压过滤的优点是___________ ;
③进一步提纯DCCNa的方法是___________ 。
(5)已知实验过程中消耗cmol/L氰尿酸V1mL,最终得到DCCNa的质量为xg,则本次实验的产率为___________ %(用含c、V1、x的代数式表示)。

回答下列问题:
(1)仪器X的名称为
(2)B中试剂为
A.饱和NaCl溶液 B.CCl4 C.浓硫酸 D.NaOH溶液
完成上述产品的制备,装置连接的顺序为
f→___________→___________→___________→___________→___________(填小写字母)。
(3)实验员认为可将插入NaOH溶液的导管下端加装多孔的球泡(如图),其目的是

(4)反应结束后,关闭K1、K2,向X中加入乙醇,静置、减压过滤得粗品;
①乙醇的作用是
②减压过滤的优点是
③进一步提纯DCCNa的方法是
(5)已知实验过程中消耗cmol/L氰尿酸V1mL,最终得到DCCNa的质量为xg,则本次实验的产率为
您最近一年使用:0次
解题方法
4 . 我国科学家发现“杯酚”能与C60形成超分子,从而识别C60和C70,下列说法错误的是
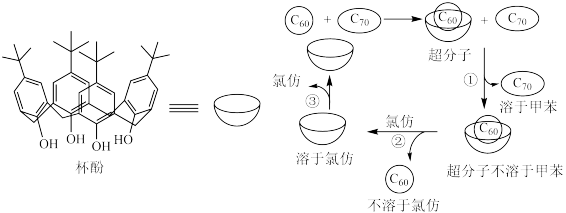

| A.“杯酚”能与C60形成分子间作用力 |
| B.操作①是过滤;操作③是蒸馏 |
| C.上述方法能实现C60与C70分离 |
| D.溶剂甲苯属于极性分子,而氯仿属于非极性分子 |
您最近一年使用:0次
解题方法
5 . 次磷酸钠(NaH2PO2)在食品工业中用作防腐剂、抗氧化剂,也是一种很好的化学镀剂。
(1)NaH2PO2中P的化合价为_____ 。
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中H2PO 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式_____ 。
(3)次磷酸钠的制备将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:
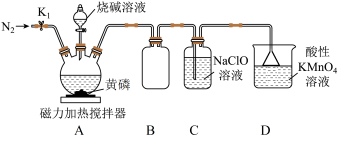
①装置A中盛放烧碱溶液的仪器名称为_____ 。
②装置B的作用为_____ 。
③装置C中发生反应的化学方程式为_____ 。
④已知相关物质的溶解度如表:
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后_____ (填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I—,2S2O
+2H++2I—,2S2O +I2=S4O
+I2=S4O +2I-,则产品纯度为
+2I-,则产品纯度为_____ (NaH2PO2式量88)。
(1)NaH2PO2中P的化合价为
(2)将待镀零件浸泡在NiSO4和NaH2PO2的混合溶液中,可达到化学镀镍的目的,该过程中H2PO
 被氧化为二元弱酸H3PO3,写出该反应的离子方程式
被氧化为二元弱酸H3PO3,写出该反应的离子方程式(3)次磷酸钠的制备将黄磷(P4)和过量烧碱溶液混合加热,生成NaH2PO2和PH3(气体),PH3与NaClO溶液反应可生成次磷酸(H3PO2),实验装置如图:

①装置A中盛放烧碱溶液的仪器名称为
②装置B的作用为
③装置C中发生反应的化学方程式为
④已知相关物质的溶解度如表:
| 溶解度/g 物质 | 25℃ | 100℃ |
| NaCl | 37 | 39 |
| NaH2PO2 | 100 | 667 |
(4)产品纯度的计算
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO
 +H2O+I2=H2PO
+H2O+I2=H2PO +2H++2I—,2S2O
+2H++2I—,2S2O +I2=S4O
+I2=S4O +2I-,则产品纯度为
+2I-,则产品纯度为
您最近一年使用:0次
6 . 锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。回答下列问题:

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

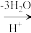
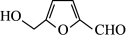

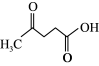 +HCOOH
+HCOOH
(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为____ 。
(2)“还原酸浸”过程中主要反应的离子方程式为____ 。
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是____ ,为提高葡萄糖的有效利用率,除充分搅拌外还可采取的措施为____ 。
(4)整个流程中可循环利用的物质是____ 。获得MnSO4∙H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是____ 。
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为____ mol·L–1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由____ 。[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6]

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:

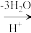


 +HCOOH
+HCOOH(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
(2)“还原酸浸”过程中主要反应的离子方程式为
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(4)整个流程中可循环利用的物质是
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为
您最近一年使用:0次
2022-03-12更新
|
1158次组卷
|
5卷引用:山东省烟台市、德州市2021-2022学年下学期高三一模化学试题
解题方法
7 . 天然气是绿色、优质的能源。开采的天然气中通常会含有杂质H2S和CO2。实验室利用如下装置除去杂质并测定H2S的含量。

已知: FeS 难溶于水可溶于稀硫酸,CuS 既不溶于水又不溶于稀硫酸。
可供选择的试剂有: FeSO4溶液、CuSO4溶液、NaOH溶液、NaCl溶液。
回答下列问题:
(1)A中的试剂是___________ 。
(2)为测量H2S的含量,停止通气后,对洗气瓶中混合物应进行的操作是___________ 、______ 、干燥、称量。其中第一步操作用到的玻璃仪器有玻璃棒、烧杯、___________ 。
(3)若通入22.4L标准状况下的气体,测得生成3.84g沉淀, 则此天然气中H2S的体积分数为___________ %。
(4)室温下,氢硫酸(H2S)和碳酸的电离平衡常数如下表所示:
H2S与碳酸钠溶液反应的化学方程式是________ ,是否能用碳酸钠溶液替代A中的试剂?___________ (填“是”或“否”)。原因是________ 。
(5)工业上也可使用醇胺吸收H2S, 反应原理为(HOCH2CH2)2NH+H2S=(HOCH2CH2)2NH2HS,上述反应说明(HOCH2CH2)2NH中,___________ (填基团结构简式)具有碱性。

已知: FeS 难溶于水可溶于稀硫酸,CuS 既不溶于水又不溶于稀硫酸。
可供选择的试剂有: FeSO4溶液、CuSO4溶液、NaOH溶液、NaCl溶液。
回答下列问题:
(1)A中的试剂是
(2)为测量H2S的含量,停止通气后,对洗气瓶中混合物应进行的操作是
(3)若通入22.4L标准状况下的气体,测得生成3.84g沉淀, 则此天然气中H2S的体积分数为
(4)室温下,氢硫酸(H2S)和碳酸的电离平衡常数如下表所示:
| Kal | Ka2 | |
| H2S | 1.1×10-7 | 1.3×10-13 |
| H2CO3 | 4.5×107 | 4.7×10-11 |
(5)工业上也可使用醇胺吸收H2S, 反应原理为(HOCH2CH2)2NH+H2S=(HOCH2CH2)2NH2HS,上述反应说明(HOCH2CH2)2NH中,
您最近一年使用:0次
解题方法
8 . 过氧化钙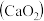 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。
Ⅰ.制备
利用反应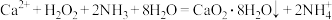 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1) 的电子式为
的电子式为_______ 。
(2)写出甲装置中反应的化学方程式_______ 。
(3)仪器A的名称为_______ ;仪器B的作用是_______ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高 的产率和
的产率和_______ 。
(5)反应结束后,分离提纯 的过程中,洗涤的操作为
的过程中,洗涤的操作为_______ 。
Ⅱ.制得产品并定量检测
(6) 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有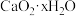 和
和 ,已知
,已知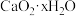 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取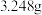 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀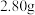 ,则该产品中
,则该产品中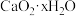 的x值为
的x值为_______ 。
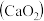 是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备
是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备 过程如下。
过程如下。Ⅰ.制备

利用反应
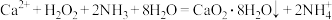 ,在碱性环境下制取
,在碱性环境下制取 的装置如图:
的装置如图:
(1)
 的电子式为
的电子式为(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高
 的产率和
的产率和(5)反应结束后,分离提纯
 的过程中,洗涤的操作为
的过程中,洗涤的操作为Ⅱ.制得产品并定量检测
(6)
 脱水干燥即得
脱水干燥即得 产品。经检测知某
产品。经检测知某 产品中含有
产品中含有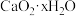 和
和 ,已知
,已知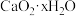 受热分解有
受热分解有 、
、 和
和 生成。①称取
生成。①称取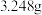 产品,加热,在标准状况下生成
产品,加热,在标准状况下生成 气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的
气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的 溶液得到沉淀
溶液得到沉淀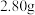 ,则该产品中
,则该产品中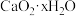 的x值为
的x值为
您最近一年使用:0次
名校
9 . MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:
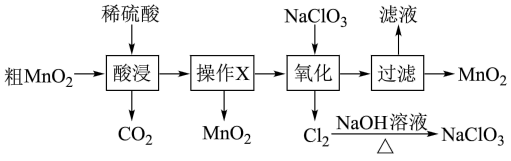
下列说法错误的是

下列说法错误的是
| A.酸浸过程中可以用浓盐酸代替稀硫酸 |
| B.操作X的名称是过滤 |
C.氧化过程发生反应的离子方程式为:5Mn2++2ClO +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 |
您最近一年使用:0次
2020-08-24更新
|
1491次组卷
|
9卷引用:广东省惠州市2021届高三上学期第一次调研考试化学试题
广东省惠州市2021届高三上学期第一次调研考试化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅱ卷)湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题 湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题
名校
解题方法
10 . 目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成分为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式___ 。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___ 。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___ 。
(4)写出反应④生成沉淀X的离子方程式___ 。
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___ 。
(6)生成Li2CO3的化学反应方程式为___ 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___ 。

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求
(4)写出反应④生成沉淀X的离子方程式
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
(6)生成Li2CO3的化学反应方程式为
您最近一年使用:0次



