解题方法
1 . 氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4―nCln]。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:

回答下列问题:
(1)步骤①中得到的氧化产物是_______________ ,溶解温度应控制在60~70度,温度不宜过高的原因是_______________ 。
(2)步骤③中Cu+的沉淀率与加入的NH4Cl的量关系如图所示。写出步骤③中主要反应的离子方程式_______________ 。提高处于C点状态的混合物中Cu+沉淀率的措施可以是_______________ 。

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是_______________ (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是_______________ 。
(5)CuCl可用于捕捉CO气体,其反应为CuCl(s)+xCO(g) CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有_______________ (填标号)。
A.降低温度B.增大压强
C.延长反应时间D.把CuCl分散到疏松多孔的分子筛中

回答下列问题:
(1)步骤①中得到的氧化产物是
(2)步骤③中Cu+的沉淀率与加入的NH4Cl的量关系如图所示。写出步骤③中主要反应的离子方程式

(3)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥不能省略,理由是
(5)CuCl可用于捕捉CO气体,其反应为CuCl(s)+xCO(g)
 CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有
CuCl∙xCO(s)△H<0,为提高CO的平衡转化率,可采取的措施有A.降低温度B.增大压强
C.延长反应时间D.把CuCl分散到疏松多孔的分子筛中
您最近一年使用:0次
名校
2 . MnO2在电池、玻璃、有机合成等工业生产中应用广泛。利用粗MnO2(含有杂质MnO和MnCO3)制取纯MnO2的流程如图:
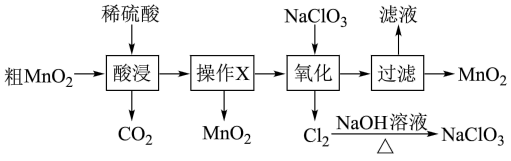
下列说法错误的是

下列说法错误的是
| A.酸浸过程中可以用浓盐酸代替稀硫酸 |
| B.操作X的名称是过滤 |
C.氧化过程发生反应的离子方程式为:5Mn2++2ClO +4H2O=5MnO2↓+Cl2↑+8H+ +4H2O=5MnO2↓+Cl2↑+8H+ |
| D.Cl2与NaOH溶液加热反应得到的NaClO3可以循环使用 |
您最近一年使用:0次
2020-08-24更新
|
1492次组卷
|
9卷引用:广东省惠州市2021届高三上学期第一次调研考试化学试题
广东省惠州市2021届高三上学期第一次调研考试化学试题湖南省长沙市雅礼中学2021届高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021届高三上学期第二次月考化学试题(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅲ卷)(已下线)学科网2020年高三11月大联考考后强化卷(新课标Ⅱ卷)甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题湖北省仙桃中学、天门中学(A班)2021-2022学年高二上学期期中考试化学试题新疆第二师八一中学2022-2023学年高三上学期第一次月考化学试题
3 . 己二酸在化工生产中有重要作用。某兴趣小组用50%的硝酸作氧化剂.钒酸铵作催化剂,氧化环己醇制备己二酸,其反应原理为3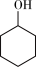 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
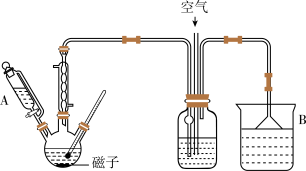
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为____________ ,仪器B中所盛装的试剂为____________ 。
(2)实验过程中,最适宜的加热方法为____________ ;该加热方法的优点是____________ 。
(3)本实验中称量钒酸铵的仪器应选用____________ (填“托盘天平”或“电子天平”)。
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:____________ 。
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是____________ (填标号)。
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
 +8HNO3
+8HNO3 3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
3HOOC(CH2)4COOH+8NO↑+7H2O,实验装置如图所示。
实验步骤:在装有回流冷凝管、温度计的50mL三颈烧瓶中,加入50%HNO3溶液(含0.12molHNO3)及少量钒酸铵(0.01g),缓慢滴加5~6滴环己醇.有红棕色气体二氧化氮产生,将剩余的环己醇滴加完毕,总量为2mL(约0.02mol)。在温度为80~90℃时,反应至无红棕色气体逸出。将反应液倒入50mL的烧杯中,冷却后。析出己二酸。减压过滤,用15mL冷水洗涤,干燥后得到粗产品mg。
回答以下问题.
(1)仪器A的名称为
(2)实验过程中,最适宜的加热方法为
(3)本实验中称量钒酸铵的仪器应选用
(4)减压过滤后的晶体用冷水洗涤,简述洗涤的操作过程:
(5)为测定粗产品中己二酸的含量,将得到的粗产品配成溶液,并用0.100mol•L-1的NaOH标准溶液进行滴定,下列操作可能使实际消耗NaOH标准溶液的体积偏大的是
A使用甲基橙作指示剂
B.滴定前俯视读数,滴定后仰视读数
C.实验用的碱滴定管、锥形瓶水洗后均未润洗
您最近一年使用:0次
名校
解题方法
4 . 硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。
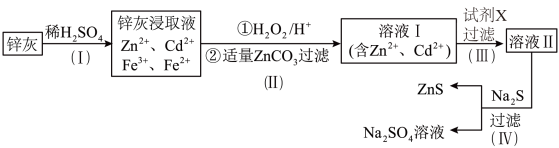
请回答下列问题:
(1)为提高锌灰的浸取率,除了适当升温外,还可采用的方法有______________________ (请写出两种方法)。
(2)步骤II先加入H2O2的目的是________________________________ (用离子方程式表示),再加入适量ZnCO3,过滤,所得滤渣为红褐色的不溶物,写出该反应的化学方程式________________________________________ 。
(3)步骤III中可得Cd单质,为避免引入新的杂质,试剂X应为____________ 。
(4)步骤IV过滤后需对所得ZnS固体进行洗涤、干燥,在实验室中进行过滤操作时,用到的主要玻璃仪器有_____________________________________ 。
(5)若步骤II中加入的ZnCO3为bmol,步骤III所得Cd单质为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液,则理论上所用锌灰中锌元素的质量为_____________ 。

请回答下列问题:
(1)为提高锌灰的浸取率,除了适当升温外,还可采用的方法有
(2)步骤II先加入H2O2的目的是
(3)步骤III中可得Cd单质,为避免引入新的杂质,试剂X应为
(4)步骤IV过滤后需对所得ZnS固体进行洗涤、干燥,在实验室中进行过滤操作时,用到的主要玻璃仪器有
(5)若步骤II中加入的ZnCO3为bmol,步骤III所得Cd单质为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液,则理论上所用锌灰中锌元素的质量为
您最近一年使用:0次
2020-08-04更新
|
151次组卷
|
2卷引用:黑龙江省大庆市第四中学2020届高三上学期第一次检测化学试题
5 . 溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备 的步骤如下:
的步骤如下:
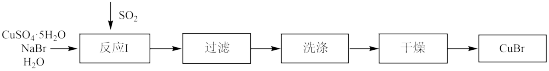
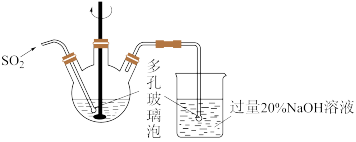
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________ (写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成 的离子方程式为
的离子方程式为________ ;烧杯中发生反应的化学方程式为________ 。
(3)过滤步骤中,需要在避光的条件下进行,原因是________ 。
(4)洗涤步骤中,依次用溶有少量 的水、溶有少量
的水、溶有少量 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有 ”的原因是
”的原因是________ 。
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水 晶体。
晶体。
(水溶液中 、
、 、
、 随
随 的分布,
的分布, 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。
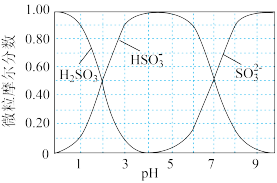

请补充完整实验方案[须用到  (贮存在钢瓶中)、
(贮存在钢瓶中)、 计]:
计]:
①________ ;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________ ;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
 的步骤如下:
的步骤如下:

(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的
(2)反应Ⅰ中:三颈烧瓶中反应生成
 的离子方程式为
的离子方程式为(3)过滤步骤中,需要在避光的条件下进行,原因是
(4)洗涤步骤中,依次用溶有少量
 的水、溶有少量
的水、溶有少量 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有 ”的原因是
”的原因是(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水
 晶体。
晶体。(水溶液中
 、
、 、
、 随
随 的分布,
的分布, 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。

请补充完整实验方案[
 (贮存在钢瓶中)、
(贮存在钢瓶中)、 计]:
计]:①
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
您最近一年使用:0次
名校
解题方法
6 . 目前世界锂离子电池总产量超过30亿只,锂电池消耗量巨大,黄石一重点中学化学研究小组对某废旧锂离子电池正极材料(图中简称废料,成分为LiMn2O4、石墨粉和铝箔)进行回收研究,工艺流程如图:

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式___ 。
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是___ 。
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求___ 。
(4)写出反应④生成沉淀X的离子方程式___ 。
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:___ 。
(6)生成Li2CO3的化学反应方程式为___ 。已知Li2CO3在水中的溶解度随着温度升高而减小,最后一步过滤时应___ 。

已知:Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g。
(1)写出氢氧化钠的电子式
(2)废料在用NaOH溶液浸取之前需要进行粉碎操作,其目的是
(3)废旧电池可能由于放电不完全而残留有锂单质,为了安全对拆解环境的要求
(4)写出反应④生成沉淀X的离子方程式
(5)已知LiMn2O4中Mn的化合价为+3和+4价,写出反应②的离子反应方程式:
(6)生成Li2CO3的化学反应方程式为
您最近一年使用:0次
7 . 铜矾(主要成分 CuSO4·5H2O)是一种可用于食品添加的铜强化剂。现以某硫铁矿渣(含有 CuSO4、CuSO3、Cu2O及少量难溶于酸的Cu2S、CuS)制备铜矾的工艺过程如下:

(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是_________ ;
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为________ ;“废渣1”中只含有S单质,则“反应1”中Cu2S与Fe2(SO4)3反应的物质的量之比为_______ 。
(3)“反应2”中通入空气的目的是_______ ;结合离子方程式,说明“反应3”加入石灰石的作用________ 。
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是_____ ;分析下列溶解度信息,最适宜的结晶方式为_________ 。
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为____ 。

(1)“1%硫酸酸浸”时,固液质量比为1:3并进行4~6次浸取,其目的是
(2)“滤饼”中含有Cu,其中Cu在“反应1”中溶解的离子方程式为
(3)“反应2”中通入空气的目的是
(4)为了提高硫铁矿渣的利用率和产品的产率,在“浓缩”前进行的必要操作是
| t/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 |
| CuSO4·5H2O/(g/100g H2O) | 23.1 | 27.5 | 32.0 | 37.8 | 44.6 | 61.8 | 83.8 |
(5)将铜矾、生石灰、水按质量比依次为1.0:0.56:100混合配制无机铜杀菌剂波尔多液,其有效成分为CuSO4·xCu(OH)2·yCa(OH)2。当x=1时,试确定y的值为
您最近一年使用:0次
解题方法
8 . 对硝基苯甲酸(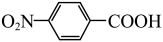 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
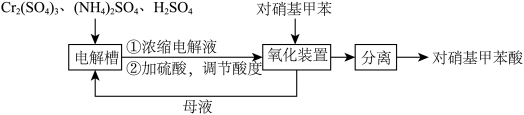
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(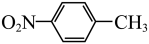 )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为__ (填“A”或“B”),反应II的离子方程式为_______ 。
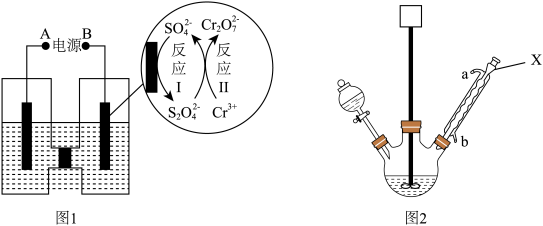
(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是_____ ,冷却水应从___ 口进入(填“a”或“b”)。
②步骤2中,抽滤所得固体的主要成分是_____ 。
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是______ 。
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用_____ 法完成。
⑤该合成技术的优点是实现了____ (填化学式)的循环利用,绿色环保。
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为_____ 。
 )是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯(
)是一种广泛用于医药、染料、感光材料等的重要精细化工中间体。工业上以对硝基甲苯( )、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
)、Cr(SO)3等物质为主要原料,通过间接电合成法制备对硝基苯甲酸,生产工艺流程如下:
已知:①对硝基甲苯:黄色晶体,熔点为51.7℃,沸点为238.5℃,不溶于水,易溶于乙醇、乙醚、氯仿和苯。②对硝基苯甲酸:黄色晶体,熔点为242℃,沸点为359℃,微溶于水,溶于乙醇,能升华。
回答下列问题:
(1)电解制备Cr2O72-:用H型隔膜电解槽电解制备Cr2O72-,装置如下图1所示。外接电源的负极为

(2)氧化制备对硝基苯甲酸:用上图2所示装置制备对硝基苯甲酸,具体过程如下:
步骤1:向250 mL三颈烧瓶中依次加入一定量含Cr2O72-的电解液、对硝基甲苯,搅拌、水浴升温到设定温度,恒温下进行反应,直至反应液由棕红色变为墨绿色时为止。
步骤2:待反应混合物冷却至室温后,与适量冰水充分混合,抽滤。滤液返回电解槽中重新电解。
步骤3:把步骤2中抽滤所得固体溶于5%的热NaOH溶液中(约60℃),待温度降到50℃时,抽滤,向滤液中加入过量2 mol/L H2SO4,析出黄色沉淀,再抽滤,并用冷水洗涤,然后在低于80℃的条件下烘干,可得粗产品。
①仪器X的名称是
②步骤2中,抽滤所得固体的主要成分是
③步骤3中,用NaOH溶液处理后,需待温度降到50℃时进行抽滤的原因是
④制得的粗产品需要进一步纯化,根据对硝基苯甲酸的有关性质可知,对其进行纯化还可以采用
⑤该合成技术的优点是实现了
(3)测定对硝基苯甲酸的纯度:称取1.670 g粗产品,配成100 mL溶液,取25.00 mL溶液,用0.1000 mol·L-1 KOH溶液滴定,重复滴定四次,每次消耗KOH溶液的体积如下表所示。已知:对硝基苯甲酸的摩尔质量为167.0 g·mol-1,则对硝基苯甲酸的纯度为
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积( mL) | 23.00 | 23.10 | 21.40 | 22.90 |
您最近一年使用:0次
名校
解题方法
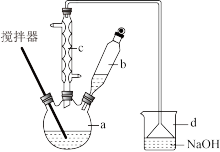
9 . 碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图:

物质的摩尔质量如下表:
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___ 。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___ 。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___ (填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___ 。
(5)步骤⑥的操作名称为___ 。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___ 。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。


物质的摩尔质量如下表:
| 物质 | I2 | KClO3 | Ca(IO3)2 |
| 摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为
(2)步骤②与“直接加热”相比,“水浴加热”的优点为
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度
(4)步骤⑤冰水浴冷却的目的为
(5)步骤⑥的操作名称为
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为
(7)最终得到2..60g碘酸钙产品,则产率为
您最近一年使用:0次
解题方法
10 . 碱式碳酸镁 是重要的无机化工产品。一种由白云石
是重要的无机化工产品。一种由白云石 主要成分为
主要成分为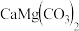 ,还含少量
,还含少量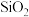 、
、 等
等 为原料制备碱式碳酸镁
为原料制备碱式碳酸镁 国家标准中CaO 的质量分数
国家标准中CaO 的质量分数
 的实验流程如下:
的实验流程如下:
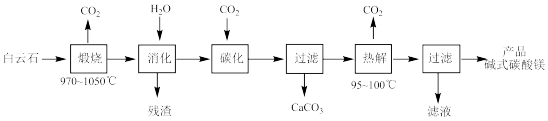
 “煅烧”时发生主要反应的化学方程式为
“煅烧”时发生主要反应的化学方程式为________________ 。
 常温常压下“碳化”可使镁元素转化为
常温常压下“碳化”可使镁元素转化为 ,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
图1 CaO含量与碳化终点pH的关系
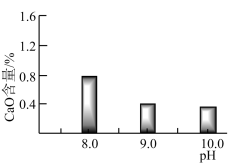
图2碱式碳酸镁产率与碳化终点pH的关系

 应控制“碳化”终点PH 约为
应控制“碳化”终点PH 约为__________ 。
 图
图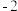 中,当
中,当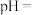
 时,镁元素的主要存在形式是
时,镁元素的主要存在形式是__________________  写化学式
写化学式 。
。
 “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、__________________ 。
 一种测定碱式碳酸镁
一种测定碱式碳酸镁 组成的方法如下:
组成的方法如下:
 称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体 标准状况
标准状况 ;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体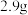 。
。
 另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率 固体样品的剩余质量
固体样品的剩余质量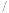 固体样品的起始质量
固体样品的起始质量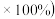 随温度的变化如下图所示
随温度的变化如下图所示 样品在
样品在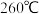 时完全失去结晶水
时完全失去结晶水 。
。
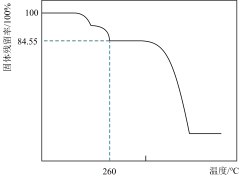
根据以上实验数据计算确定碱式碳酸镁晶体的化学式 写出计算过程
写出计算过程
_________ 。
 是重要的无机化工产品。一种由白云石
是重要的无机化工产品。一种由白云石 主要成分为
主要成分为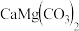 ,还含少量
,还含少量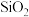 、
、 等
等 为原料制备碱式碳酸镁
为原料制备碱式碳酸镁 国家标准中CaO 的质量分数
国家标准中CaO 的质量分数
 的实验流程如下:
的实验流程如下: 
 “煅烧”时发生主要反应的化学方程式为
“煅烧”时发生主要反应的化学方程式为 常温常压下“碳化”可使镁元素转化为
常温常压下“碳化”可使镁元素转化为 ,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。图1 CaO含量与碳化终点pH的关系

图2碱式碳酸镁产率与碳化终点pH的关系

 应控制“碳化”终点PH 约为
应控制“碳化”终点PH 约为 图
图 中,当
中,当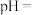
 时,镁元素的主要存在形式是
时,镁元素的主要存在形式是 写化学式
写化学式 。
。 “过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、
“过滤”时须用到的玻璃仪器有:烧杯、玻璃棒、 一种测定碱式碳酸镁
一种测定碱式碳酸镁 组成的方法如下:
组成的方法如下: 称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体
称取一定量的碱式碳酸镁晶体溶于足量的盐酸,收集到气体 标准状况
标准状况 ;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体
;往所得溶液中加入足量的NaOH溶液,过滤,将所得沉淀洗涤、干燥,称量得固体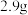 。
。 另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率
另取一定量的碱式碳酸镁晶体在空气中加热,固体残留率 固体样品的剩余质量
固体样品的剩余质量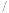 固体样品的起始质量
固体样品的起始质量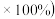 随温度的变化如下图所示
随温度的变化如下图所示 样品在
样品在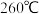 时完全失去结晶水
时完全失去结晶水 。
。
根据以上实验数据计算确定碱式碳酸镁晶体的化学式
 写出计算过程
写出计算过程
您最近一年使用:0次



