名校
1 . 某无色气体X,可能含有CO2、SO2、HCl、HBr中的一种或几种.将X通过适量的氯水时,X恰好完全被吸收,没有任何气体剩余.将所得的无色溶液分装于两支试管后,分别加入酸化的AgNO3与BaCl2溶液,结果均产生白色沉淀。下列推论不正确的是( )
| A.X中可能含有HCl | B.X中一定有SO2 |
| C.X中可能含有HBr | D.产生的沉淀分别是AgCl与BaSO4 |
您最近一年使用:0次
2019-10-27更新
|
276次组卷
|
2卷引用:上海市南洋模范中学2016-2017学年高一下学期期末考试化学试题
2 . 某无色溶液只可能溶有NH4+、K+、A13+、Mg2+、HCO3-、Cl-、I-、MnO4-、SO42-等离子中的几种离子,为分析其组成,现进行如下实验:
①取10 mL 该溶液,滴加足量酸化的Ba(NO3)2溶液,过滤得到0.03 mol 白色沉淀甲
②向上述反应后的滤液中,加入AgNO3溶液未见沉淀产生
③另取10 mL该溶液,滴加NaOH溶液产生白色沉淀乙,当加入NaOH 的物质的量为0.03 mol 时,沉淀的量达到最大;继续滴加NaOH溶液并加热,产生的气体丙在标准状况下为0.224 L (假设丙全部逸出),最后沉淀完全溶解
下列推断正确的是
①取10 mL 该溶液,滴加足量酸化的Ba(NO3)2溶液,过滤得到0.03 mol 白色沉淀甲
②向上述反应后的滤液中,加入AgNO3溶液未见沉淀产生
③另取10 mL该溶液,滴加NaOH溶液产生白色沉淀乙,当加入NaOH 的物质的量为0.03 mol 时,沉淀的量达到最大;继续滴加NaOH溶液并加热,产生的气体丙在标准状况下为0.224 L (假设丙全部逸出),最后沉淀完全溶解
下列推断正确的是
| A.肯定有Na+、Mg2+、A13+、Cl- | B.肯定有A13+、SO42- 、NH4+ |
| C.肯定没有K+、HCO3-、MnO4- | D.肯定没有K+、NH4+、Cl- |
您最近一年使用:0次
3 . 摩尔盐在工业上有重要的用途。已知其由一种阴离子,两种阳离子组成的晶体,某学习小组按如下实验测定摩尔盐样品的组成。步骤如下:
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:

滴定实验结果记录如下:
完成下列填空:
(1)步骤①中需要的定量仪器为________________ 、__________________ 。
(2)步骤②的目的是_____________________________________________________ 。产生红褐色沉淀的离子方程式_____________________________________ 。
(3)步骤④中操作X为_________________________________ (按操作顺序填写)。
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,_______ (填“能”或“不能”),请说明理由__________________________________________________ 。
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将__________ 。(选填“ 偏大”、“偏小”或“不变”)。
(6)通过上述实验测定结果,推断摩尔盐化学式为______________________________ 。
①称取3.920g摩尔盐样品配制250mL溶液。
②取少量配制溶液,加入KSCN溶液,无明显现象。
③另取少量配制溶液,加入过量浓氢氧化钠溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体和红褐色沉淀。
④定量测定如下:

滴定实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 10.32 | 10.02 | 9.98 |
(1)步骤①中需要的定量仪器为
(2)步骤②的目的是
(3)步骤④中操作X为
(4)步骤④中酸性高锰酸钾溶液能否用碘的酒精溶液代替,
(5)步骤④若在滴定过程中,待测液久置,消耗高锰酸钾溶液的体积将
(6)通过上述实验测定结果,推断摩尔盐化学式为
您最近一年使用:0次
4 . 对下列实验过程的评价,正确的是
| A.某无色溶液滴入紫色石蕊试液显蓝色,该溶液一定是含有大量的H+ |
| B.某溶液中滴加BaCl2溶液,生成不溶于稀HNO3的白色沉淀,证明一定含有SO42﹣ |
| C.某溶液中加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,证明该溶液含有NH4+ |
| D.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 |
您最近一年使用:0次
2019-10-20更新
|
370次组卷
|
4卷引用:上海市曹杨第二中学2020-2021学年高一下学期期末检测化学试题
名校
5 . 要证明某溶液中不含Fe3+而含有Fe2+,以下操作选择及排序正确的是( )
①加入少量氯水 ②加入少量KI溶液 ③加入少量KSCN溶液
①加入少量氯水 ②加入少量KI溶液 ③加入少量KSCN溶液
| A.③① | B.①③ | C.②③ | D.③② |
您最近一年使用:0次
2019-08-19更新
|
559次组卷
|
3卷引用:上海市青浦区2019届高三高三第二次学业质量调研(二模)化学试题
名校
6 . 检验某晶体是铵盐时,将待测物取出少量放在试管中后
| A.加烧碱溶液,加热,用湿润红色石蕊试纸在管口检验 |
| B.直接加热,用湿润红色石蕊试纸在管口检验 |
| C.加烧碱溶液,加热,向试管中滴加紫色石蕊试液 |
| D.加水溶解,滴加无色酚酞试液,观察是否变红 |
您最近一年使用:0次
2019-07-01更新
|
269次组卷
|
5卷引用:上海市嘉定区封浜高中2018-2019学年高一第二学期期终考试化学试题
名校
7 . 如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。

试回答下列问题:
(1)实验1中,溶液颜色由______ 色变为______ 色,写出溶液变色的化学反应方程式____________ 。
(2)实验2甲针筒内发生的化学反应方程式:_______________ 。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入________ 溶液中。
(3)实验3中,甲中最后剩余的无色气体是_____ ,写出NO2与H2O反应的化学反应方程式_____________ 。
(4)实验4中能看见有白烟产生并生成一种气体(空气主要成分之一),该化学反应方程式______________ ,写出检验所得白色固体中阳离子的操作方法:___________ 。

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 |
| 1 | 溴水 | SO2 |
| 2 | H2S | SO2 |
| 3 | NO2(主要) | H2O(l) |
| 4 | 15mLCl2 | 40mLNH3 |
(1)实验1中,溶液颜色由
(2)实验2甲针筒内发生的化学反应方程式:
(3)实验3中,甲中最后剩余的无色气体是
(4)实验4中能看见有白烟产生并生成一种气体(空气主要成分之一),该化学反应方程式
您最近一年使用:0次
8 . (NH4)2Fe(SO4)2·6H2O(M=392g/mol)又称摩尔盐,简称FAS,它是浅蓝色绿色晶体,可溶于水,难溶于水乙醇。某小组利用工业废铁屑进行下列实验。请按要求回答下列问题:
Ⅰ. FAS的制取。流程如下:
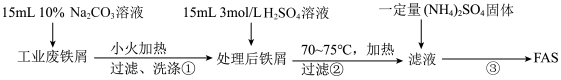
(1)步骤①加热的目的是_________________________ 。
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):______________ 。
Ⅱ.NH4+含量的测定。装置如图所示:
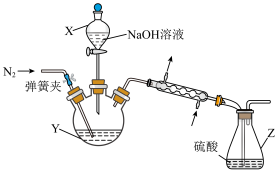
实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称______________ ;N2的电子式为______________ 。
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是__________________ ;NH4+质量百分含量为(用代数式表示)__________________ 。
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)_________ 。滴定中反应的离子方程式为____________________ 。
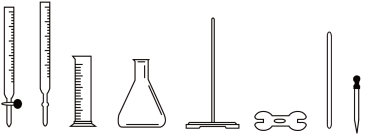
① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液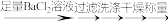 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)_____________________________ 。
(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是_______________ ;为验证该猜测正确,设计后续实验操作为_________________ ,现象为______________ 。
Ⅰ. FAS的制取。流程如下:

(1)步骤①加热的目的是
(2)步骤②必须在剩余少量铁屑时进行过滤,其原因是(用离子方程式表示):
Ⅱ.NH4+含量的测定。装置如图所示:

实验步骤:①称取FAS样品a g,加水溶解后,将溶液注入Y中
②量取b mL c1 mol/LH2SO4溶液于Z中
③向Y加入足量NaOH浓溶液,充分反应后通入气体N2,加热(假设氨完全蒸出),蒸氨结束后取下Z。
④用c2mol/LNaOH标准溶液滴定Z中过量的硫酸,滴定终点时消耗d mLNaOH标准溶液。
(3)仪器X的名称
(4)步骤③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行处理的操作是
Ⅲ. FAS纯度的测定。称取FAS m g样品配制成500 mL待测溶液。分别取20.00mL待测溶液,进行如下方案实验:
(5)方案一:用0.01000mol/L的酸性KMnO4溶液进行滴定。滴定过程中需用到的仪器中(填图中序号)

① ② ③ ④ ⑤ ⑥ ⑦ ⑧
(6)方案二: 待测液
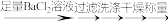 固体n g ;则FAS的质量百分含量为(用代数式表示)
固体n g ;则FAS的质量百分含量为(用代数式表示)(7)方案一、二实验操作均正确,却发现方案一测定结果总是小于方案二的,其可能的原因是
您最近一年使用:0次
2019-04-28更新
|
289次组卷
|
2卷引用:上海市南汇第一中学2021-2022学年高三下学期模拟化学试题
名校
解题方法
9 . 不能鉴别Fe2+和Fe3+的是
| A.氯水 | B.盐酸 | C.氢氧化钠溶液 | D.硫氰化钾溶液 |
您最近一年使用:0次
2018-04-14更新
|
445次组卷
|
5卷引用:上海市闵行区2018届高三下学期质量调研(二模)化学试题
10 . 为确定FeSO4溶液置于空气中是否变质,所选检验试剂能达到目的是
| A.NaOH溶液 | B.KSCN溶液 | C.BaCl2溶液 | D.硝酸钡溶液 |
您最近一年使用:0次



