名校
解题方法
1 . 某校化学兴趣小组学习了“氯气的实验室制法”后,利用如图所示实验装置对 的制备及性质进行探究。回答下列问题:
的制备及性质进行探究。回答下列问题:
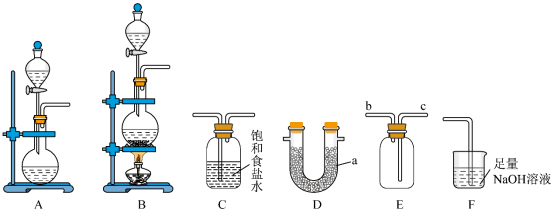
(1)仪器 的名称为
的名称为___________ 。
(2)实验室若选用 固体和浓盐酸在常温条件下制取干燥的
固体和浓盐酸在常温条件下制取干燥的 ,则选用的发生装置为
,则选用的发生装置为___________ (填“A”或“B”);该反应的化学方程式为___________ 。
(3)装置C的主要作用为___________ ;装置 是用于干燥
是用于干燥 ,故装置
,故装置 中的试剂为
中的试剂为___________ (填化学式)。
(4)用装置 收集
收集 ,进气口为
,进气口为___________ (填“b”或“c”)。
(5)装置F中发生反应的离子方程式为___________ 。
(6)工业上一般将 通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
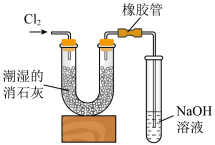
已知:① 与潮湿的消石灰反应是放热反应;
与潮湿的消石灰反应是放热反应;
②温度较高时, 与潮湿
与潮湿 的反应方程式为
的反应方程式为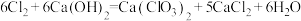 。
。
发现实验所得 产率较低,可能的原因是
产率较低,可能的原因是___________ 。
 的制备及性质进行探究。回答下列问题:
的制备及性质进行探究。回答下列问题:
(1)仪器
 的名称为
的名称为(2)实验室若选用
 固体和浓盐酸在常温条件下制取干燥的
固体和浓盐酸在常温条件下制取干燥的 ,则选用的发生装置为
,则选用的发生装置为(3)装置C的主要作用为
 是用于干燥
是用于干燥 ,故装置
,故装置 中的试剂为
中的试剂为(4)用装置
 收集
收集 ,进气口为
,进气口为(5)装置F中发生反应的离子方程式为
(6)工业上一般将
 通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
通入石灰乳中制取含氯漂白粉,同学们利用如下图装置进行实验。
已知:①
 与潮湿的消石灰反应是放热反应;
与潮湿的消石灰反应是放热反应;②温度较高时,
 与潮湿
与潮湿 的反应方程式为
的反应方程式为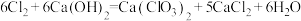 。
。发现实验所得
 产率较低,可能的原因是
产率较低,可能的原因是
您最近一年使用:0次
2024-01-20更新
|
72次组卷
|
2卷引用:四川省泸州市合江县马街中学校2023-2024学年高一上学期1月期末化学试题
名校
2 . 实验室用如下装置制取氯气,并进行性质实验。回答下列问题;
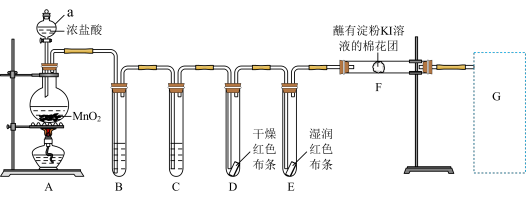
(1)写出A中反应的化学方程式________ 。装置中B盛装________ 装置中C盛装________ 。
(2)能证明氯气无漂白性的现象是________ 。
(3)F处观察到棉花团变蓝色,说明氯气具有________ 性(填“氧化”或“还原”)。
(4)写出G处尾气吸收的离子方程式________ 。
(5)实验室还可用 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;
( )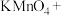 ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( )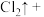 ( )
( ) (未配平)。
(未配平)。
请写出该反应配平后的离子方程式:________ 。若生成等量的 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为________ 。

(1)写出A中反应的化学方程式
(2)能证明氯气无漂白性的现象是
(3)F处观察到棉花团变蓝色,说明氯气具有
(4)写出G处尾气吸收的离子方程式
(5)实验室还可用
 固体与浓盐酸常温下反应制备氯气;
固体与浓盐酸常温下反应制备氯气;( )
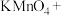 ( )HCl(浓)=( )KCl+( )
( )HCl(浓)=( )KCl+( ) ( )
( )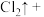 ( )
( ) (未配平)。
(未配平)。请写出该反应配平后的离子方程式:
 ,所需
,所需 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 小组同学进行Na2CO3和NaHCO3性质的探究,实验如下(夹持装置已略去,气密性已检验)。
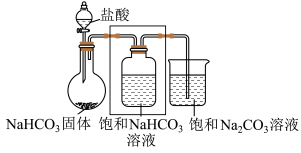
(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是________ 。
(2) NaHCO3与盐酸反应的化学方程式为________ 。
(3)方框中为洗气装置,请将该装置补充完整________ 。
(4)饱和 NaHCO3溶液的作用是________ 。
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:________ 。
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式_______

(1)打开分液漏斗活塞放出盐酸,发现流速越来越慢,可能的原因是
(2) NaHCO3与盐酸反应的化学方程式为
(3)方框中为洗气装置,请将该装置补充完整
(4)饱和 NaHCO3溶液的作用是
(5)反应持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因:
(6)若向饱和NaHCO3溶液加入少量澄清石灰水的离子方程式
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.“84消毒液”有效成分是NaClO。某次实验需要使用900mL0.2mol/L的NaClO溶液,欲用NaClO固体配制该溶液。
(1)计算所需NaClO固体的质量为________ g。
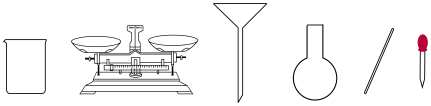
(2)配制溶液时,下图不需要的仪器是________ (写仪器名称)。
(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)________ 。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
Ⅱ.某班同学通过实验探究 、
、 的性质。回答下列问题:
的性质。回答下列问题:
(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是________ 。
(6)甲组同学取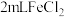 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为________ 。
(7)乙组同学认为甲组的实验不够严谨,该组同学在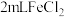 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:________ 。
(8)向 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是________ ;沉淀变色的原因是________ (用化学方程式解释)。
(1)计算所需NaClO固体的质量为
(2)配制溶液时,下图不需要的仪器是

(3)写出配制溶液时的正确操作顺序(用字母表示,每个字母只能用一次)
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)配制过程中,下列操作导致溶液浓度偏小的是________(填序号)。
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.某班同学通过实验探究
 、
、 的性质。回答下列问题:
的性质。回答下列问题:(5)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。刻制印刷电路板时用氯化铁溶液作为“腐蚀液”,发生反应的离子方程式是
(6)甲组同学取
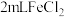 溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明
溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与氯水反应的离子方程式为
溶液与氯水反应的离子方程式为(7)乙组同学认为甲组的实验不够严谨,该组同学在
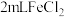 溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:
溶液中先加入0.5mL煤油(不溶于水,密度比水小),再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红。煤油的作用是:(8)向
 溶液中滴加NaOH溶液,现象是
溶液中滴加NaOH溶液,现象是
您最近一年使用:0次
名校
解题方法
5 . Fe2+在空气中易被氧化。某小组探究绿矾(FeSO4•7H2O)和莫尔盐[(NH4)2Fe(SO4)2•6H2O]在空气中的稳定性。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
(1)常温时0.1mol·L-1(NH4)2SO4溶液pH=5.0,则B溶液中水解程度:Fe2+_____ NH (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:_____ 。
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
(3)上述实验说明,相同条件下两种晶体在空气中稳定性更强的是_____ (填名称)。
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是_____ 。
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是_____ 。
②莫尔盐晶体中______ 离子的存在使结晶水不易失去;该离子与H2O分子之间可能存在的作用是_____ 。
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,_____ 。
Ⅰ.探究溶液中的稳定性:配制0.1mol·L-1两种溶液[A:FeSO4,B:(NH4)2Fe(SO4)2],露置于空气中一段时间,并检验其中的Fe3+,结果如表。
| 编号 | 新配制 | 1h后 | 24h后 | |||||
| pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | 酸化后滴等量KSCN(aq) | pH | 性状 | |
| A | 3.9 | 无色溶液 | 几乎无色 | 3.4 | 黄色溶液 | 变红 | 3.3 | 红褐色沉淀 |
| B | 3.9 | 无色溶液 | 几乎无色 | 3.3 | 黄色溶液 | 变红 | 3.2 | 红褐色沉淀 |
 (填“>”或“<”),因此新配制的A、B溶液pH几乎相同。
(填“>”或“<”),因此新配制的A、B溶液pH几乎相同。(2)放置24h后溶液pH均减小,写出该过程中Fe2+被空气氧化的离子方程式:
上述实验说明两种溶液中的Fe2+的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
| 编号 | i | ii | iii | iv | |
| 实验条件 | 露置 | 密闭容器 | 潮湿的密闭容器 | 盛有干燥剂的 密闭容器 | |
| 实验结果 | 绿矾 | 晶体逐渐变白,进而出现土黄色;Fe3+含量很多 | 无明显变化;Fe3+含量非常少 | 晶体结块,颜色不变;Fe3+含量非常少 | 晶体逐渐变白,最终出现淡黄色;Fe3+含量很多 |
| 莫尔盐 | 无明显变化;Fe3+含量非常少 | 无明显变化;Fe3+含量非常少 | 晶体略结块,颜色不变;Fe3+含量非常少 | 无明显变化;Fe3+含量很少 | |
(4)甲同学推测绿矾在ii中的结果与i不同可能是容器中O2不足造成的。乙同学经过对比,分析该推测不成立,其理由是
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是
②莫尔盐晶体中
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,
您最近一年使用:0次
2024-01-14更新
|
157次组卷
|
3卷引用:四川省宜宾市叙州区第二中学校2023-2024学年高二上学期1月期末化学试题
名校
6 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、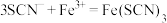 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
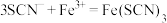 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为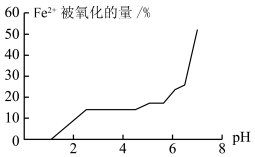
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取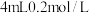 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴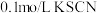 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴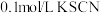 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
165次组卷
|
4卷引用:四川省德阳市外国语学校1-10班2023-2024学年高一下学期入学考试化学试题
名校
解题方法
7 . 李华同学想利用如图装置在实验室制备二氧化碳并验证过氧化钠可作呼吸面具中的供氧剂。下列有关说法正确的是
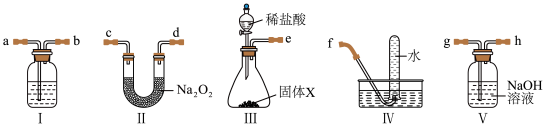

| A.装置的连接顺序为eghabcdf | B.装置Ⅰ中盛放浓硫酸 |
| C.装置Ⅲ中固体是生石灰 | D.装置Ⅳ中收集的气体可使带火星的木条复燃 |
您最近一年使用:0次
8 . 某化学兴趣小组设计了如图装置,该装置能制取 ,并进行相关性质实验,且可利用装置
,并进行相关性质实验,且可利用装置 储存多余的氯气。
储存多余的氯气。
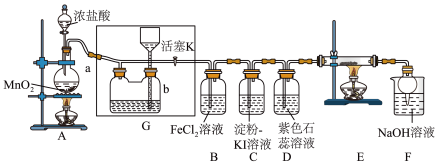
(1)A中发生反应的化学方程式为___________ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。
回答下列问题:
①在装置D中能看到的实验现象是___________ 。
②由C中出现的现象___________ 。
③在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为___________ 。
(3)储气瓶b内盛放的试剂是___________ 。
(4)装置B中 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(5)F烧杯中发生反应的离子方程式为___________ 。
 ,并进行相关性质实验,且可利用装置
,并进行相关性质实验,且可利用装置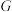 储存多余的氯气。
储存多余的氯气。
(1)A中发生反应的化学方程式为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。
回答下列问题:
①在装置D中能看到的实验现象是
②由C中出现的现象
③在装置E的硬质玻璃管内盛有炭粉,发生氧化还原反应,产物为
 和
和 ,则E中发生反应的化学方程式为
,则E中发生反应的化学方程式为(3)储气瓶b内盛放的试剂是
(4)装置B中
 被
被 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)F烧杯中发生反应的离子方程式为
您最近一年使用:0次
9 . 无水 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
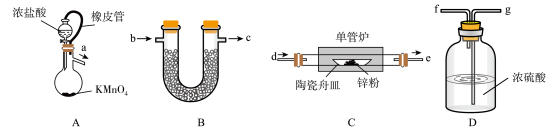
(1)装置A中反应的离子方程式为___________ ;装置A中橡皮管的作用为___________ 。
(2)按气流从左到右的方向,装置合理的连接顺序为___________
 (填接口小写字母)。
(填接口小写字母)。
(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因___________ 。
(4)装置B中药品的作用为___________ 。
(5)氯化锌纯度的测定:将ag试样配成 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用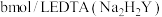 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为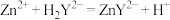 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。
①配制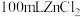 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、___________ 。
②该氯化锌试样中氯化锌的质量分数为___________ (用含a.b的代数式表示)。
 常用作有机合成的脱水剂、缩合剂和催化剂。无水
常用作有机合成的脱水剂、缩合剂和催化剂。无水 易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水
易吸水潮解。某化学兴趣小组的同学设计如下实验方案制备无水 ,并测定其纯度,实验装置如图所示:
,并测定其纯度,实验装置如图所示:
(1)装置A中反应的离子方程式为
(2)按气流从左到右的方向,装置合理的连接顺序为
 (填接口小写字母)。
(填接口小写字母)。(3)若省略装置D,经检验产物中含有氧化锌,利用所学知识解释原因
(4)装置B中药品的作用为
(5)氯化锌纯度的测定:将ag试样配成
 溶液。取
溶液。取 ,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用
,加入磷酸三钠消除干扰离子后,滴入两滴半二甲酚橙作指示剂,用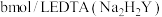 标准溶液滴定
标准溶液滴定 ,反应的离子方程式为
,反应的离子方程式为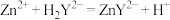 ,达到终点时,消耗EDTA溶液的平均体积为
,达到终点时,消耗EDTA溶液的平均体积为 。
。①配制
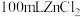 溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、
溶液需用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、②该氯化锌试样中氯化锌的质量分数为
您最近一年使用:0次
名校
10 . 氢化钠是常用的供氢剂,遇水剧烈反应,其制备原理是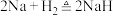 ,某小组设计实验制备氢化钠,装置如图所示。
,某小组设计实验制备氢化钠,装置如图所示。

请回答下列问题:
(1)A装置中反应的离子方程式_____________________ 。
(2)C装置中的试剂是___________ 。
(3)若拆掉B装置,则产品可能含有的杂质是________________ (填化学式)。
(4)实验时先打开活塞K,一段时间后再点燃酒精灯的原因是:_____________________ 。
(5)氢化钠与水反应生成一种碱和一种单质,写出化学方程式:______________________ 。
(6)若D中固体增重4g,则D中反应转移的电子数为_________ 。
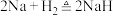 ,某小组设计实验制备氢化钠,装置如图所示。
,某小组设计实验制备氢化钠,装置如图所示。
请回答下列问题:
(1)A装置中反应的离子方程式
(2)C装置中的试剂是
(3)若拆掉B装置,则产品可能含有的杂质是
(4)实验时先打开活塞K,一段时间后再点燃酒精灯的原因是:
(5)氢化钠与水反应生成一种碱和一种单质,写出化学方程式:
(6)若D中固体增重4g,则D中反应转移的电子数为
您最近一年使用:0次
2023-12-14更新
|
55次组卷
|
2卷引用:四川省南充市嘉陵第一中学2023-2024学年高一上学期12月月考化学试题



