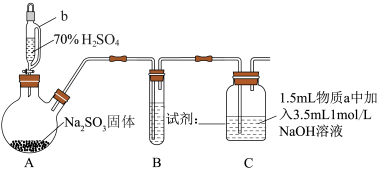
1 . 某小组同学实验室制备 并探究
并探究 与新制
与新制 悬浊液的反应。
悬浊液的反应。
资料:① 为白色固体,难溶于水,能溶于浓盐酸;
为白色固体,难溶于水,能溶于浓盐酸;
②酸性条件下可发生反应:
_______ 。用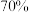 的硫酸和固体
的硫酸和固体 反应制备
反应制备 利用了硫酸的
利用了硫酸的_______ 性。
(2)装置B的作用是控制 气体的流速,则B中试剂可以是
气体的流速,则B中试剂可以是_______ 。(填写序号)
①饱和 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和 溶液 ④浓硫酸
溶液 ④浓硫酸
(3)室温下, 的
的 溶液与
溶液与 的
的 溶液混合后,溶液的
溶液混合后,溶液的 约为
约为_______ 。(不考虑 的溶解)
的溶解)
(4)已知通入 前,实验I、II中产生蓝色絮状沉淀为
前,实验I、II中产生蓝色絮状沉淀为 ,请写出实验I通入
,请写出实验I通入 后产生砖红色沉淀
后产生砖红色沉淀 反应的离子方程式
反应的离子方程式_______ ,分析实验I一段时间后砖红色沉淀消失的可能原因是_______ 。
(5)某同学用一种方法证明了实验II中的白色沉淀为 ,实验方案为:过滤,取样,
,实验方案为:过滤,取样,_____ 。
(6)证明实验II发生了氧化还原反应,除了检验有 生成外,还可通过检验另一种离子得以证实,检验该离子的试剂为
生成外,还可通过检验另一种离子得以证实,检验该离子的试剂为_______ 。
(7)该装置缺少尾气吸收装置,请补充画出装置图并指明吸收试剂_______ 。
 并探究
并探究 与新制
与新制 悬浊液的反应。
悬浊液的反应。| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I |  溶液 溶液 | 产生蓝色絮状沉淀 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| II |  溶液 溶液 | 产生蓝色絮状沉淀 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
 为白色固体,难溶于水,能溶于浓盐酸;
为白色固体,难溶于水,能溶于浓盐酸;②酸性条件下可发生反应:

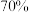 的硫酸和固体
的硫酸和固体 反应制备
反应制备 利用了硫酸的
利用了硫酸的(2)装置B的作用是控制
 气体的流速,则B中试剂可以是
气体的流速,则B中试剂可以是①饱和
 溶液 ②饱和
溶液 ②饱和 溶液 ③饱和
溶液 ③饱和 溶液 ④浓硫酸
溶液 ④浓硫酸(3)室温下,
 的
的 溶液与
溶液与 的
的 溶液混合后,溶液的
溶液混合后,溶液的 约为
约为 的溶解)
的溶解)(4)已知通入
 前,实验I、II中产生蓝色絮状沉淀为
前,实验I、II中产生蓝色絮状沉淀为 ,请写出实验I通入
,请写出实验I通入 后产生砖红色沉淀
后产生砖红色沉淀 反应的离子方程式
反应的离子方程式(5)某同学用一种方法证明了实验II中的白色沉淀为
 ,实验方案为:过滤,取样,
,实验方案为:过滤,取样,(6)证明实验II发生了氧化还原反应,除了检验有
 生成外,还可通过检验另一种离子得以证实,检验该离子的试剂为
生成外,还可通过检验另一种离子得以证实,检验该离子的试剂为(7)该装置缺少尾气吸收装置,请补充画出装置图并指明吸收试剂

您最近一年使用:0次
2 . 氨气( )是一种重要的化工原料,其中约80%用来生产各种氮肥。
)是一种重要的化工原料,其中约80%用来生产各种氮肥。
i氨气的制备
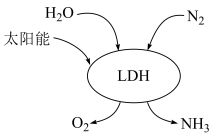
(1)我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为___________ 。___________ 。
(3)实验进行一段时间后,可以观察到硬质玻璃管内黑色的CuO粉末变成___________ 色,盛无水 的干燥管内出现
的干燥管内出现___________ 色,并在最后的出气导管处收集到纯净、干燥的 。根据这些现象,硬质玻璃管中反应的化学方程式为
。根据这些现象,硬质玻璃管中反应的化学方程式为___________ ,这个反应说明氨气具有___________ (填选项字母,下同)。
a.碱性 b.氧化性 c.还原性
(4)在最后出气管口收集干燥、纯净的氮气,收集方法是___________ 。
a.向上排空气法 b.向下排空气法 c.排水法 d.用塑料袋或球胆收集
 )是一种重要的化工原料,其中约80%用来生产各种氮肥。
)是一种重要的化工原料,其中约80%用来生产各种氮肥。i氨气的制备
(1)我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。该反应的化学方程式为
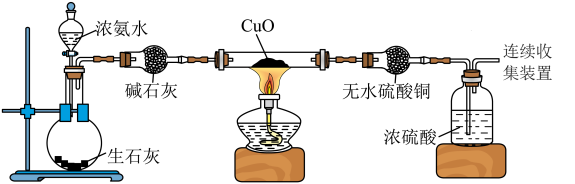
(3)实验进行一段时间后,可以观察到硬质玻璃管内黑色的CuO粉末变成
 的干燥管内出现
的干燥管内出现 。根据这些现象,硬质玻璃管中反应的化学方程式为
。根据这些现象,硬质玻璃管中反应的化学方程式为a.碱性 b.氧化性 c.还原性
(4)在最后出气管口收集干燥、纯净的氮气,收集方法是
a.向上排空气法 b.向下排空气法 c.排水法 d.用塑料袋或球胆收集
您最近一年使用:0次
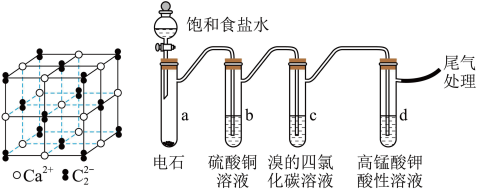
3 . 乙炔是有机合成的重要原料。利用电石可制备乙炔,电石的主要成分为 ,还含有
,还含有 和
和 等少量杂质。
等少量杂质。
I.一种 的晶胞如图所示
的晶胞如图所示
(1) 晶体属于
晶体属于___________ 晶体,(填晶体类型)
(2) 晶体中每个
晶体中每个 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有___________ 个。
Ⅱ.制备乙炔并检验其性质 、
、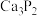 能发生水解反应:ii.
能发生水解反应:ii. 能被
能被 、
、 及酸性
及酸性 溶液氧化。
溶液氧化。
(3)a中生成乙快的化学方程式是___________ 。
(4)实验过程中,b中溶液一直保持蓝色的目的是___________ 。
(5)实验过程中,c、d试管中溶液的颜色均褪去。其中,c验证了乙炔能与 发生加成反应,d则说明乙炔具有
发生加成反应,d则说明乙炔具有___________ 性。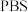 的路线如下。
的路线如下。 和
和 键且A、C互为同分异构体。A的结构简式是
键且A、C互为同分异构体。A的结构简式是___________ 。
(7)B和D生成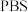 的化学方程式是
的化学方程式是___________ 。
 ,还含有
,还含有 和
和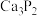 等少量杂质。
等少量杂质。I.一种
 的晶胞如图所示
的晶胞如图所示(1)
 晶体属于
晶体属于(2)
 晶体中每个
晶体中每个 周围紧邻且距离相等的
周围紧邻且距离相等的 共有
共有Ⅱ.制备乙炔并检验其性质
 、
、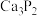 能发生水解反应:ii.
能发生水解反应:ii. 能被
能被 、
、 及酸性
及酸性 溶液氧化。
溶液氧化。(3)a中生成乙快的化学方程式是
(4)实验过程中,b中溶液一直保持蓝色的目的是
(5)实验过程中,c、d试管中溶液的颜色均褪去。其中,c验证了乙炔能与
 发生加成反应,d则说明乙炔具有
发生加成反应,d则说明乙炔具有Ⅲ.由乙炔制备生物可降解塑料 (
(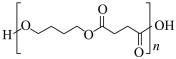 )
)
 的路线如下。
的路线如下。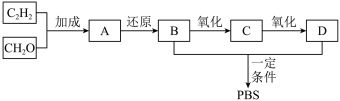
 和
和 键且A、C互为同分异构体。A的结构简式是
键且A、C互为同分异构体。A的结构简式是(7)B和D生成
 的化学方程式是
的化学方程式是
您最近一年使用:0次
解题方法
4 . 物质类别和元素价态,是学习元素及其化合物性质的重要认识视角。下图中X、Y、Z三种物质均含有Na元素。
(1)X的化学式为_______ ,X与水反应生成Z和 ,该反应的氧化剂是
,该反应的氧化剂是________ 。
(2)钠长期置于空气中,最后形成的物质是______ (填化学式),通常将钠保存在______ 中。
(3)钠与水反应的离子方程式为_______ 。
(4)写出淡黄色固体Y与二氧化碳反应的化学方程式:______ 。
(5)纯碱和小苏打都是重要的化工原料,某同学设计如下几组实验方法鉴别纯碱和小苏打。_____ 。
②乙和丙两组实验对比,丙组能更便捷的验证两者的热稳定性,丙组实验中B处盛放的物质应为_____ (填化学式)。
(6)取10g 和
和 固体混合物充分加热,质量减少3.1g,则原混合物中
固体混合物充分加热,质量减少3.1g,则原混合物中 的质量为
的质量为_____ g。
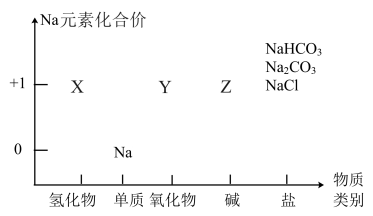
(1)X的化学式为
 ,该反应的氧化剂是
,该反应的氧化剂是(2)钠长期置于空气中,最后形成的物质是
(3)钠与水反应的离子方程式为
(4)写出淡黄色固体Y与二氧化碳反应的化学方程式:
(5)纯碱和小苏打都是重要的化工原料,某同学设计如下几组实验方法鉴别纯碱和小苏打。
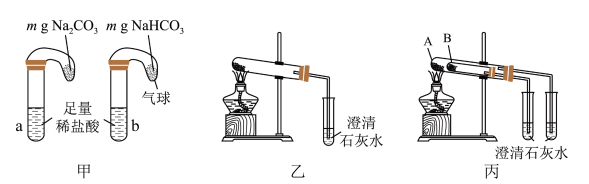
②乙和丙两组实验对比,丙组能更便捷的验证两者的热稳定性,丙组实验中B处盛放的物质应为
(6)取10g
 和
和 固体混合物充分加热,质量减少3.1g,则原混合物中
固体混合物充分加热,质量减少3.1g,则原混合物中 的质量为
的质量为
您最近一年使用:0次
5 . 为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体,下列分析错误的是
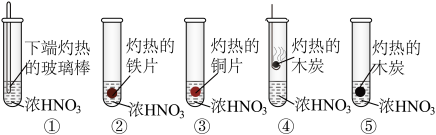
| A.①中产生的NO₂源于硝酸的分解 |
| B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色 |
| C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的 |
| D.五支试管中的红棕色气体均为还原产物 |
您最近一年使用:0次
名校
解题方法
6 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠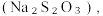 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度:  |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
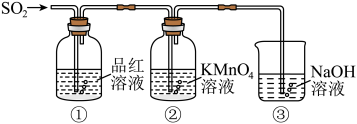
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
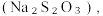 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.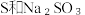 | B. 和浓 和浓 | C. 和 和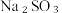 | D.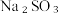 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
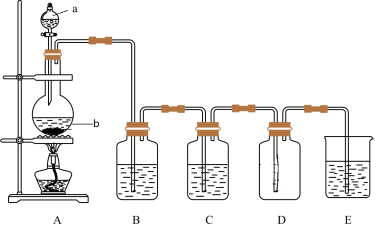
7 . 下图是实验室中制备某种气体或验证某种气体性质的装置图。
(1)仪器a的名称是______ ,仪器b的名称是______ 。
(2)仪器b内发生反应的离子方程式为______ ;
(3)装置B中的溶液为______ 溶液;
(4)烧杯E中溶液的作用为______ 。
Ⅱ.利用图装置,可以证明 具有漂白性、还原性及生成气体中含有
具有漂白性、还原性及生成气体中含有 ;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
(5)证明 具有漂白性的装置是
具有漂白性的装置是______ (填装置图对应大写字母),现象是______ ;
(6)证明 具有还原性的现象是
具有还原性的现象是______ ;
(7)证明生成气体中含有 的现象是
的现象是______ ;
(8)D装置的作用是______ 。
(1)仪器a的名称是
(2)仪器b内发生反应的离子方程式为
(3)装置B中的溶液为
(4)烧杯E中溶液的作用为
Ⅱ.利用图装置,可以证明
 具有漂白性、还原性及生成气体中含有
具有漂白性、还原性及生成气体中含有 ;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
;仪器b内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。(5)证明
 具有漂白性的装置是
具有漂白性的装置是(6)证明
 具有还原性的现象是
具有还原性的现象是(7)证明生成气体中含有
 的现象是
的现象是(8)D装置的作用是
您最近一年使用:0次
8 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。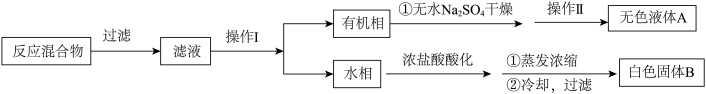
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):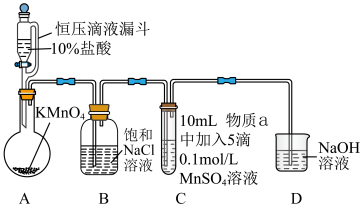
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次
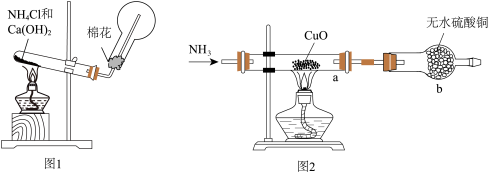
9 . 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,图2装置探究其相关性质。
(1)图1装置中生成 的化学方程式为
的化学方程式为________________ ,
(2)检验圆底烧瓶中已收集满氨气的方法是________________ 。
Ⅱ、探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物
(3)无水硫酸铜的作用是________ ,有同学认为需要在无水硫酸铜的后面再接一个装有无水 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是________________ 。
(4)实验中观察到a中 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为________________ 。
(5)若向a中通入标准状况下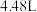 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为________ g。
(1)图1装置中生成
 的化学方程式为
的化学方程式为(2)检验圆底烧瓶中已收集满氨气的方法是
Ⅱ、探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物
(3)无水硫酸铜的作用是
 固体的球形干燥管,这样做的目的是
固体的球形干燥管,这样做的目的是(4)实验中观察到a中
 粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
粉末变红,b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为(5)若向a中通入标准状况下
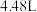 的氨气,最终得到铜的质量为
的氨气,最终得到铜的质量为
您最近一年使用:0次
2024-05-04更新
|
146次组卷
|
2卷引用:天津市第二十一中学2023-2024学年高一下学期第一次月考化学试卷
解题方法
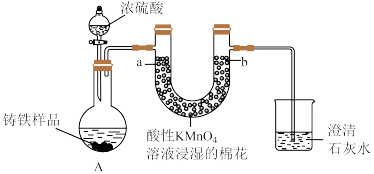
10 . Ⅰ.铸铁的主要成分为Fe和C,用下图所示实验研究铸铁与热的浓硫酸的反应(夹持和加热装置已略去)。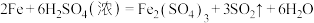 、
、________ 。
(2)实验现象:①________ ,证明确实有SO2生成。
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明________ 。
(3)检测反应后A中所得溶液中含有 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加________ ,现象为________ 证明有 。
。
(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为________ 。
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将 还原为
还原为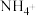 的转化关系如下:
的转化关系如下:

(5)纳米Fe制备原理: ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是________ 。
(6)酸性条件下,纳米Fe和 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是________ 。
(7)检验溶液中 的操作和现象是
的操作和现象是________ 。
(8)溶液初始pH较低有利于 的去除,可能的原因是
的去除,可能的原因是________ (答1条)。
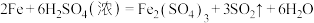 、
、(2)实验现象:①
②U型管b侧棉花的紫红色变化不明显、澄清石灰水中生成白色浑浊物。证明
(3)检测反应后A中所得溶液中含有
 的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加
的实验方法为:取少量待测溶液,将其加入适量水中稀释,滴加 。
。(4)若取上述反应生成的0.56L(标准状况下)混合气体直接通入足量H2O2溶液中,反应完全后,向溶液中加入足量BaCl2溶液生成白色沉淀,分离、干燥后得到固体4.66g。混合气体中SO2的体积分数为
Ⅱ.纳米Fe具有很高的活性,易被氧化使其表面形成氧化层,对制备纳米Fe并对其还原去除水中的硝酸盐污染物进行研究,纳米Fe将
 还原为
还原为 的转化关系如下:
的转化关系如下:
(5)纳米Fe制备原理:
 ,其中电负性H>B,反应中的氧化剂是
,其中电负性H>B,反应中的氧化剂是(6)酸性条件下,纳米Fe和
 反应生成
反应生成 和
和 的离子方程式是
的离子方程式是(7)检验溶液中
 的操作和现象是
的操作和现象是(8)溶液初始pH较低有利于
 的去除,可能的原因是
的去除,可能的原因是
您最近一年使用:0次



