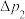1 . Ⅰ.氨的制备
氨在化工生产领域有广泛应用,历史上曾有三位科学家在合成氨领域获得诺贝尔化学奖。

(1)实验室常用铵盐与强碱反应制取氨气,可选择装置___________ (填“A”或“B”),反应的化学方程式为___________ 。
(2)制备干燥的 时,发生、净化、收集和尾气处理装置的接口顺序为
时,发生、净化、收集和尾气处理装置的接口顺序为___________ (按气流方向填写小写字母)
(3)检验某溶液中存在 的操作及现象为
的操作及现象为___________ 。
(4)工业上在一定温度和催化剂条件下,可用 消除
消除 污染,生成两种对环境无害的物质,请写出
污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
Ⅱ.某实验小组研究 与溶液的反应,实验如下:
与溶液的反应,实验如下:
实验中所取镁粉质量均为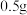 ,分别加入到选取的实验试剂中。
,分别加入到选取的实验试剂中。
资料:a. 溶液呈中性;b.Cl-对该反应几乎无影响。
溶液呈中性;b.Cl-对该反应几乎无影响。
(5)甲同学认为实验2比实验1反应剧烈的原因是 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是___________ 。
(6)为进一步探究实验2反应剧烈的原因,进行实验4:
依据上述实验,可以得出Mg能与 反应生成
反应生成 ,乙同学认为该方案不严谨,需要补充的实验方案是
,乙同学认为该方案不严谨,需要补充的实验方案是___________ 。
实验总结:通过上述实验,该小组同学得出Mg能与 反应生成
反应生成 的结论。
的结论。
氨在化工生产领域有广泛应用,历史上曾有三位科学家在合成氨领域获得诺贝尔化学奖。

(1)实验室常用铵盐与强碱反应制取氨气,可选择装置
(2)制备干燥的
 时,发生、净化、收集和尾气处理装置的接口顺序为
时,发生、净化、收集和尾气处理装置的接口顺序为(3)检验某溶液中存在
 的操作及现象为
的操作及现象为(4)工业上在一定温度和催化剂条件下,可用
 消除
消除 污染,生成两种对环境无害的物质,请写出
污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式
反应的化学方程式Ⅱ.某实验小组研究
 与溶液的反应,实验如下:
与溶液的反应,实验如下:实验中所取镁粉质量均为
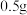 ,分别加入到选取的实验试剂中。
,分别加入到选取的实验试剂中。资料:a.
 溶液呈中性;b.Cl-对该反应几乎无影响。
溶液呈中性;b.Cl-对该反应几乎无影响。| 实验 | 实验试剂 | 实验现象 |
| 1 |  蒸馏水 蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
| 2 | 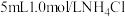 溶液 溶液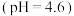 | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
 溶液中
溶液中 大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。
大,与Mg反应快。乙同学通过实验3证明甲同学的说法不合理。| 实验 | 实验装置 | 现象 |
| 3 | 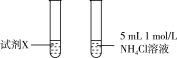 | 两试管反应剧烈程度相当 |
(6)为进一步探究实验2反应剧烈的原因,进行实验4:
| 实验 | 实验试剂 | 实验现象 |
| 4 |  乙醇溶液 乙醇溶液 | 有无色无味气体产生(经检验为 ) ) |
 反应生成
反应生成 ,乙同学认为该方案不严谨,需要补充的实验方案是
,乙同学认为该方案不严谨,需要补充的实验方案是实验总结:通过上述实验,该小组同学得出Mg能与
 反应生成
反应生成 的结论。
的结论。
您最近一年使用:0次
解题方法
2 . 1810年,英国化学家戴维以大量事实为依据,确认一种黄绿色气体是一种新元素组成的单质——氯气。某化学兴趣小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究。

(1)仪器b的名称为_______ 。某同学认为该实验装置存在一处明显的不足,其改进措施为_______ 。
(2)仪器a中发生反应的化学方程式为_______ 。根据氯气的性质D中的收集装置可以选择_______ (填序号)。
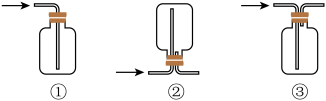
(3)下列有关该实验的说法中不正确的是_______ (填字母)。
A.将b中液体换为稀盐酸,同样可以产生氯气
B.C中试剂是浓硫酸,目的是干燥氯气
C.E中红色布条不褪色,F中红色布条褪色证明氯气具有漂白性
(4)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如下图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:_______ 。

(5)实验室还可用等物质的量的 与
与 的水溶液反应制取
的水溶液反应制取 ,同时生成
,同时生成 和
和 ,反应的化学方程式为
,反应的化学方程式为_______ 。
(6)已知氯气和 溶液在一定温度下能同时发生反应:
溶液在一定温度下能同时发生反应: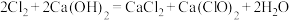 ,
,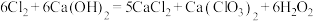 。某温度下,将氯气通入
。某温度下,将氯气通入 溶液中,反应得到
溶液中,反应得到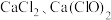 和
和 的混合溶液,该反应中,氧化产物为
的混合溶液,该反应中,氧化产物为_______ (填化学式),经测定 与
与 的个数比为2∶3,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
的个数比为2∶3,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为_______ 。

(1)仪器b的名称为
(2)仪器a中发生反应的化学方程式为

(3)下列有关该实验的说法中不正确的是
A.将b中液体换为稀盐酸,同样可以产生氯气
B.C中试剂是浓硫酸,目的是干燥氯气
C.E中红色布条不褪色,F中红色布条褪色证明氯气具有漂白性
(4)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如下图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:

(5)实验室还可用等物质的量的
 与
与 的水溶液反应制取
的水溶液反应制取 ,同时生成
,同时生成 和
和 ,反应的化学方程式为
,反应的化学方程式为(6)已知氯气和
 溶液在一定温度下能同时发生反应:
溶液在一定温度下能同时发生反应: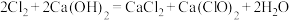 ,
,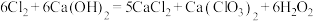 。某温度下,将氯气通入
。某温度下,将氯气通入 溶液中,反应得到
溶液中,反应得到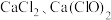 和
和 的混合溶液,该反应中,氧化产物为
的混合溶液,该反应中,氧化产物为 与
与 的个数比为2∶3,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
的个数比为2∶3,则氯气与氢氧化钙反应时,被还原的氯原子和被氧化的氯原子的个数比为
您最近一年使用:0次
2022-11-19更新
|
617次组卷
|
3卷引用:湖南省三湘名校教育联盟2022-2023学年高一上学期期中联考化学试题
名校
解题方法
3 .  在生产生活中有重要的用途。某化学小组尝试制备
在生产生活中有重要的用途。某化学小组尝试制备 并探究
并探究 的某些性质,进行了以下实验:
的某些性质,进行了以下实验:
(1)该小组用 和
和 合成
合成 。
。

①写出用A装置制备 的化学方程式:
的化学方程式:_______ 。
②为使 和
和 在D中充分混合并反应,上述装置的连接顺序为a→
在D中充分混合并反应,上述装置的连接顺序为a→_______ ←b。
③B中圆底烧瓶中放 固体,则分液漏斗中的试剂可以为
固体,则分液漏斗中的试剂可以为_______ 。
A.浓 B.浓
B.浓 C.浓
C.浓 D.冰醋酸
D.冰醋酸
④装置D除了氨气与氯化氢反应生成的氯化铵固体易堵塞导气管外,还有何不足之处:_______ 。
(2)该小组为探究 与
与 溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为5g,分别加入到选取的实验试剂中。
溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为5g,分别加入到选取的实验试剂中。
资料:a. ;b.
;b. 、
、 对该反应几乎无影响。
对该反应几乎无影响。
①经检验实验2中刺激性气味气体有 ;另用排水法收集一小试管产生的气体,经检验小试管中气体为
;另用排水法收集一小试管产生的气体,经检验小试管中气体为 。
。
②已知灰白色固体中含有 、
、 。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加
。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加 溶液后无明显浑浊。取洗涤后固体15.3g,刚好溶于1L0.2mol/L稀
溶液后无明显浑浊。取洗涤后固体15.3g,刚好溶于1L0.2mol/L稀 溶液,再滴加
溶液,再滴加 溶液,出现白色沉淀,过滤洗涤干燥称量得白色沉淀28.7g,则灰白色固体的化学式是
溶液,出现白色沉淀,过滤洗涤干燥称量得白色沉淀28.7g,则灰白色固体的化学式是_______ 。
③甲同学认为实验2比实验1反应剧烈的原因是 溶液中
溶液中 大,与
大,与 反应快。乙同学通过实验3证明甲同学的说法不合理。
反应快。乙同学通过实验3证明甲同学的说法不合理。
试剂X是_______ 。
④为进一步探究实验2反应剧烈的原因,进行实验4、5:
⑤实验总结:通过上述实验,该小组同学得出 能与
能与 反应生成
反应生成 的结论。
的结论。
 在生产生活中有重要的用途。某化学小组尝试制备
在生产生活中有重要的用途。某化学小组尝试制备 并探究
并探究 的某些性质,进行了以下实验:
的某些性质,进行了以下实验:(1)该小组用
 和
和 合成
合成 。
。
①写出用A装置制备
 的化学方程式:
的化学方程式:②为使
 和
和 在D中充分混合并反应,上述装置的连接顺序为a→
在D中充分混合并反应,上述装置的连接顺序为a→③B中圆底烧瓶中放
 固体,则分液漏斗中的试剂可以为
固体,则分液漏斗中的试剂可以为A.浓
 B.浓
B.浓 C.浓
C.浓 D.冰醋酸
D.冰醋酸④装置D除了氨气与氯化氢反应生成的氯化铵固体易堵塞导气管外,还有何不足之处:
(2)该小组为探究
 与
与 溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为5g,分别加入到选取的实验试剂中。
溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为5g,分别加入到选取的实验试剂中。资料:a.
 ;b.
;b. 、
、 对该反应几乎无影响。
对该反应几乎无影响。| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为 ) ) |
| 2 | 5mL1.0mol/L 溶液 溶液 | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
 ;另用排水法收集一小试管产生的气体,经检验小试管中气体为
;另用排水法收集一小试管产生的气体,经检验小试管中气体为 。
。②已知灰白色固体中含有
 、
、 。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加
。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加 溶液后无明显浑浊。取洗涤后固体15.3g,刚好溶于1L0.2mol/L稀
溶液后无明显浑浊。取洗涤后固体15.3g,刚好溶于1L0.2mol/L稀 溶液,再滴加
溶液,再滴加 溶液,出现白色沉淀,过滤洗涤干燥称量得白色沉淀28.7g,则灰白色固体的化学式是
溶液,出现白色沉淀,过滤洗涤干燥称量得白色沉淀28.7g,则灰白色固体的化学式是③甲同学认为实验2比实验1反应剧烈的原因是
 溶液中
溶液中 大,与
大,与 反应快。乙同学通过实验3证明甲同学的说法不合理。
反应快。乙同学通过实验3证明甲同学的说法不合理。| 实验 | 实验装置 | 现象 |
| 3 | 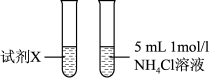 | 两试管反应剧烈程度相当 |
④为进一步探究实验2反应剧烈的原因,进行实验4、5:
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5mL无水乙醇 | 无明显现象 |
| 5 | 5mL 乙醇溶液 乙醇溶液 | 有无色无味气体产生(经检验为 ) ) |
 能与
能与 反应生成
反应生成 的结论。
的结论。
您最近一年使用:0次
名校
4 . 某校化学兴趣小组探究 与
与 溶液的反应。
溶液的反应。
资料:①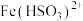 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。
②生成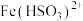 的反应为:
的反应为: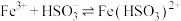 。
。
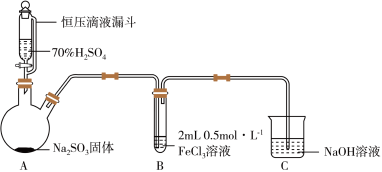
(1)实验室常用 硫酸与亚硫酸钠固体反应制备
硫酸与亚硫酸钠固体反应制备 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。在制备 的过程中,同学们发现,使用
的过程中,同学们发现,使用 的硫酸比用
的硫酸比用 的浓硫酸反应速率快,分析其中的原因是
的浓硫酸反应速率快,分析其中的原因是___________ 。
(2)该小组同学预测 与
与 溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式:
溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式:___________ 。
(3)向试管 中溶液通入
中溶液通入 至饱和,溶液变成红棕色,静置
至饱和,溶液变成红棕色,静置 后,溶液的颜色从红棕色慢慢变回黄色。静置
后,溶液的颜色从红棕色慢慢变回黄色。静置 后,溶液慢慢由黄色变为浅绿色。
后,溶液慢慢由黄色变为浅绿色。
①甲同学认为溶液变红的原因是通入 后,
后, 水解程度增大,形成
水解程度增大,形成 胶体。乙同学根据
胶体。乙同学根据 的性质否定了这一推论,原因是
的性质否定了这一推论,原因是___________ 。
②静置9小时后,溶液变浅绿色的离子反应方程式为___________ 。向反应后的溶液中滴加___________ (填试剂名称),产生蓝色沉淀,证明反应后的溶液中含有 。
。
③为了探究如何缩短溶液由红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为:___________ 。
 与
与 溶液的反应。
溶液的反应。资料:①
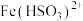 为红棕色,它可以将
为红棕色,它可以将 还原为
还原为 。
。②生成
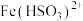 的反应为:
的反应为: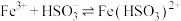 。
。
(1)实验室常用
 硫酸与亚硫酸钠固体反应制备
硫酸与亚硫酸钠固体反应制备 ,写出反应的化学方程式:
,写出反应的化学方程式: 的过程中,同学们发现,使用
的过程中,同学们发现,使用 的硫酸比用
的硫酸比用 的浓硫酸反应速率快,分析其中的原因是
的浓硫酸反应速率快,分析其中的原因是(2)该小组同学预测
 与
与 溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式:
溶液反应的现象为溶液由黄色变成浅绿色,写出相关反应的离子方程式:(3)向试管
 中溶液通入
中溶液通入 至饱和,溶液变成红棕色,静置
至饱和,溶液变成红棕色,静置 后,溶液的颜色从红棕色慢慢变回黄色。静置
后,溶液的颜色从红棕色慢慢变回黄色。静置 后,溶液慢慢由黄色变为浅绿色。
后,溶液慢慢由黄色变为浅绿色。①甲同学认为溶液变红的原因是通入
 后,
后, 水解程度增大,形成
水解程度增大,形成 胶体。乙同学根据
胶体。乙同学根据 的性质否定了这一推论,原因是
的性质否定了这一推论,原因是②静置9小时后,溶液变浅绿色的离子反应方程式为
 。
。③为了探究如何缩短溶液由红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验I | 往 重新配制的 重新配制的 溶液中通入 溶液中通入 气体,溶液立即变为红棕色。微热 气体,溶液立即变为红棕色。微热 ,溶液颜色变为浅绿色。 ,溶液颜色变为浅绿色。 |
| 实验Ⅱ | 往5mL重新配制的 。溶液(用浓盐酸酸化)中通入 。溶液(用浓盐酸酸化)中通入 气体,溶液立即变为红棕色。几分钟后,溶液颜色变成浅绿色。 气体,溶液立即变为红棕色。几分钟后,溶液颜色变成浅绿色。 |
您最近一年使用:0次
5 .  可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。
(1) 的制备
的制备
实验室可用 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:__________________________ 。
(2) 的收集
的收集
为收集纯净的 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→_______ →e。 的性质探究
的性质探究
ⅰ)探究 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: 的变化速率
的变化速率__________  。
。
②ab段变化及溶液的pH减小,表明 与水发生反应,其方程式为
与水发生反应,其方程式为_____________________ ,该反应的产物不稳定,可通过以下实验证明,请补充操作填在表格横线中。
若____________________ ,证明该反应产物不稳定。
ⅱ)探究 使品红溶液褪色的原因
使品红溶液褪色的原因
操作1:将 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。 、
、 、
、____________________ 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是 请完成表格。
请完成表格。
 可用于食品工业、农业、染料业等,以下进行其性质的探究。
可用于食品工业、农业、染料业等,以下进行其性质的探究。(1)
 的制备
的制备实验室可用
 固体和75%硫酸制备
固体和75%硫酸制备 ,其化学方程式为:
,其化学方程式为:(2)
 的收集
的收集为收集纯净的
 可用如图所示装置,则连接顺序为发生装置→
可用如图所示装置,则连接顺序为发生装置→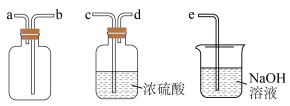
 的性质探究
的性质探究ⅰ)探究
 与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示:
与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如下图所示: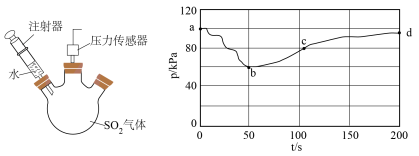
 的变化速率
的变化速率 。
。②ab段变化及溶液的pH减小,表明
 与水发生反应,其方程式为
与水发生反应,其方程式为操作 | 100s内压强变化/kPa |
待烧瓶中压强稳定后,将其置于热水浴中,重新测定压强变化 |
|
|
ⅱ)探究
 使品红溶液褪色的原因
使品红溶液褪色的原因操作1:将
 通入品红溶液中,品红溶液褪色。
通入品红溶液中,品红溶液褪色。
 、
、 、
、已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红褪色的微粒不是
 请完成表格。
请完成表格。操作2 | 现象 |
不褪色 |
您最近一年使用:0次
2024-04-12更新
|
472次组卷
|
2卷引用:湖南省雅礼中学2024届高三下学期热身训练(三模)化学试题
6 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________ 。
②将仪器连接好以后,必须进行的第一步操作是___________ 。
③写出装置C中发生的所有反应的化学方程式___________ 、___________ 。
④D中NaOH溶液的作用___________ 。
⑤实验结束时,读取实验中生成气体的体积时,不合理的是___________ 。
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ 。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的所有反应的化学方程式
④D中NaOH溶液的作用
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
名校
解题方法
7 . 氨是重要的化工原料,回答下列问题:
Ⅰ.制取并收集一瓶干燥氨气___________ →C→F(填大写字母)。
(2)A装置中发生反应的化学方程式为___________ 。
(3)C中盛放的试剂为___________ ,F装置的作用是___________ 。
(4)若把A装置改为B装置,以制备氨气,则分液漏斗中盛放的液体是___________ 。
Ⅱ.检验氨气的性质
(5)装置如图,打开止水夹,用热毛巾将烧瓶捂热,松开后,水上喷形成红色喷泉,说明氨气具有___________ 等性质。
利用下图装置由氨制硝酸,实验时戊中溶液呈淡黄色时关闭分液漏斗活塞。___________ 。
(7)实验尾气氮氧化物 折算成标准状况下的体积为a L,完全吸收时,烧杯中
折算成标准状况下的体积为a L,完全吸收时,烧杯中 至少是
至少是___________  (忽略溶液体积变化)。
(忽略溶液体积变化)。
Ⅰ.制取并收集一瓶干燥氨气
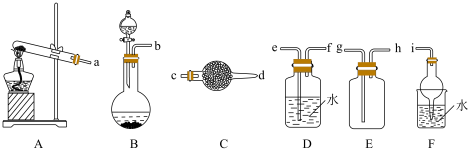
(2)A装置中发生反应的化学方程式为
(3)C中盛放的试剂为
(4)若把A装置改为B装置,以制备氨气,则分液漏斗中盛放的液体是
Ⅱ.检验氨气的性质
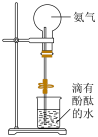
(5)装置如图,打开止水夹,用热毛巾将烧瓶捂热,松开后,水上喷形成红色喷泉,说明氨气具有
利用下图装置由氨制硝酸,实验时戊中溶液呈淡黄色时关闭分液漏斗活塞。
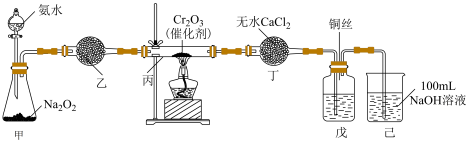
(7)实验尾气氮氧化物
 折算成标准状况下的体积为a L,完全吸收时,烧杯中
折算成标准状况下的体积为a L,完全吸收时,烧杯中 至少是
至少是 (忽略溶液体积变化)。
(忽略溶液体积变化)。
您最近一年使用:0次
名校
解题方法
8 . 某小组实验探究铜与浓硫酸的反应。
资料:i.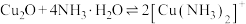 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv. 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定

(1)浓 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是___________ 。
(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是___________ 。
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
(3)经检验阶段一中铜丝表面逐渐变黑的产物为 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是___________ ,发生的主要反应化学方程式是___________ 。
小组同学为探究实验中产生的沉淀,设计如下实验方案。
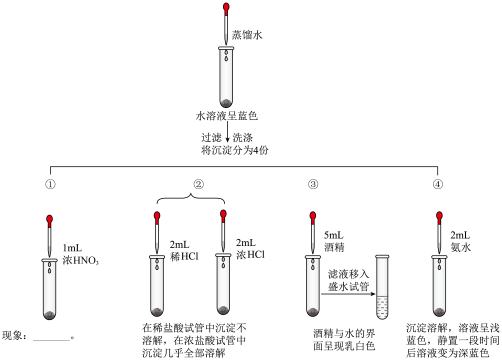
(4)实验①中可观察到的实验现象是___________ 。
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因___________ 。
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有___________ 。
资料:i.
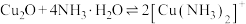 (极浅蓝色)
(极浅蓝色)
ii.硫化铜和硫化亚铜常温下都不溶于稀盐酸,易溶于浓盐酸
iii.单质硫不溶于水,微溶于酒精
iv.
 在干燥环境(浓
在干燥环境(浓 )中较为稳定
)中较为稳定
(1)浓
 与Cu制备
与Cu制备 的化学方程式是
的化学方程式是(2)上述实验中能证明浓硫酸中硫酸分子的氧化性强于氢离子的实验证据是
实验过程中,小组同学按加热时间分为三个阶段,记录实验现象如下:
| 反应阶段 | 阶段一(加热初期) | 阶段二(继续加热) | 阶段三(加热后期) |
| 实验现象 | 铜丝表面逐渐变黑,溶液接近无色,无气体生成 | 大量刺激性气体产生,溶液变为墨绿色,试管底部产生灰白色沉淀 | 试管中出现“白雾”,浊液逐渐变澄清,溶液变为浅蓝,灰白色沉淀增多 |
(3)经检验阶段一中铜丝表面逐渐变黑的产物为
 ,请从物质性质和结构角度解释产生
,请从物质性质和结构角度解释产生 原因是
原因是小组同学为探究实验中产生的沉淀,设计如下实验方案。

(4)实验①中可观察到的实验现象是
(5)请用化学用语描述实验④中溶液由浅蓝色变为深蓝色的原因
(6)通过上述实验验证可知,铜与浓硫酸反应后生成的沉淀主要成分有
您最近一年使用:0次
2023-11-25更新
|
392次组卷
|
2卷引用:湖南省长沙市长郡中学2024届高三上学期月考(5)化学试卷
9 . Ⅰ、某校化学研究性学习小组设计实验验证NH3能还原CuO。请回答下列问题:___________ 。
(2)请将提供的装置按合理顺序连接:g→___________ →___________→a→b→___________→___________→___________。
(3)装置B的作用是___________ 。
(4)证明NH3能还原CuO的实验现象是___________ 。
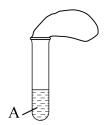
Ⅱ、试管中装有某未知A溶液,装置密闭,操作过程中未见气球中有颜色变化(如下图)
(5)无色A溶液加热后变红,停止加热后溶液又变成无色,则A溶液是___________
(6)红色A溶液加热后变成无色,停止加热后溶液又变红色,则A溶液是___________
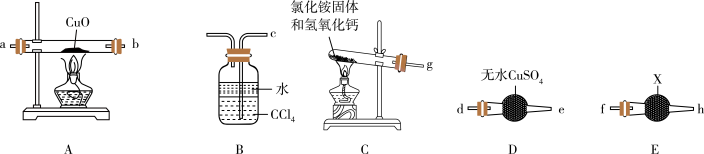
(2)请将提供的装置按合理顺序连接:g→
(3)装置B的作用是
(4)证明NH3能还原CuO的实验现象是
Ⅱ、试管中装有某未知A溶液,装置密闭,操作过程中未见气球中有颜色变化(如下图)
(5)无色A溶液加热后变红,停止加热后溶液又变成无色,则A溶液是
(6)红色A溶液加热后变成无色,停止加热后溶液又变红色,则A溶液是
您最近一年使用:0次
名校
解题方法
10 . 硫酸铜主要用作纺织品媒染剂、农业杀虫剂等,其晶体(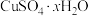 )在不同温度下会逐步失去结晶水甚至分解。周南化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:
)在不同温度下会逐步失去结晶水甚至分解。周南化学社对硫酸铜晶体受热分解的产物成分进行探究,请回答下列问题:
Ⅰ.探究硫酸铜晶体的分解产物
为探究硫酸铜晶体的分解产物,某同学设计了如下实验:
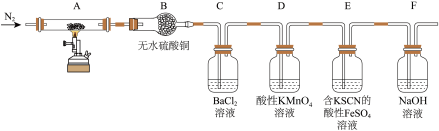
观察到的实验现象有: 中有固体残留;
中有固体残留; 中无水硫酸铜变蓝;
中无水硫酸铜变蓝; 中产生白色沉淀;
中产生白色沉淀; 中溶液颜色变浅、无沉淀产生;
中溶液颜色变浅、无沉淀产生; 中溶液变为红色。
中溶液变为红色。
(1)装有无水硫酸铜的仪器名称为
(2)
 中产生的沉淀的化学式为
中产生的沉淀的化学式为 中现象证明硫酸铜晶体的分解产物中含有
中现象证明硫酸铜晶体的分解产物中含有(3)
 中
中 发生反应的离子方程式为
发生反应的离子方程式为(4)为探究
 中残留固体的成分(假设硫酸铜已完全分解),某同学查阅资料:铜有
中残留固体的成分(假设硫酸铜已完全分解),某同学查阅资料:铜有 、
、 价,且分解产物中不含0价的铜。
价,且分解产物中不含0价的铜。 在酸性条件下不稳定,发生反应:
在酸性条件下不稳定,发生反应: 。验证
。验证 中固体产物中是否有
中固体产物中是否有 的实验方案为
的实验方案为Ⅱ.测定硫酸铜晶体中结晶水含量
实验步骤:
①称取 硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。
硫酸铜晶体,用适量蒸馏水溶解,再滴加几滴盐酸酸化。
②向①所得溶液中滴加足量 溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为
溶液,得到白色沉淀,将所得沉淀过滤、洗涤、干燥,称得其质量为 。
。
(5)步骤②中检验沉淀是否洗涤干净的方法是:
(6)根据实验数据,硫酸铜晶体(
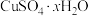 )中
)中
 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次