1 . Ⅰ.按要求回答下列问题:
(1)下列物质中① ;②乙醇;③熔融
;②乙醇;③熔融 ;④
;④ 溶液;⑤固态
溶液;⑤固态 ,其中属于电解质的是
,其中属于电解质的是___________ (只填序号,下同),属于非电解质的是___________ 。所给状态下能导电的是___________ 。
(2)配平方程式,并在方程式上用双线桥表示出电子转移情况。____________ 。

Ⅱ.下图所示装置,可用来制取 和观察
和观察 在空气中被氧化的颜色变化。实验时必须使用铁屑和
在空气中被氧化的颜色变化。实验时必须使用铁屑和 的硫酸,其他试剂任选。
的硫酸,其他试剂任选。
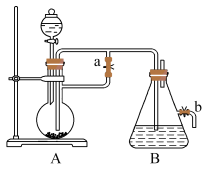
(3)实验开始时应先将活塞a___________ (填“打开”或“关闭”)。
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为___________ 。
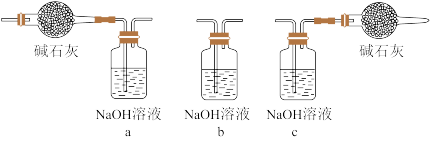
(5)下图中___________ 装置能较长时间看到 白色沉淀(填装置序号)。
白色沉淀(填装置序号)。
(1)下列物质中①
 ;②乙醇;③熔融
;②乙醇;③熔融 ;④
;④ 溶液;⑤固态
溶液;⑤固态 ,其中属于电解质的是
,其中属于电解质的是(2)配平方程式,并在方程式上用双线桥表示出电子转移情况。

Ⅱ.下图所示装置,可用来制取
 和观察
和观察 在空气中被氧化的颜色变化。实验时必须使用铁屑和
在空气中被氧化的颜色变化。实验时必须使用铁屑和 的硫酸,其他试剂任选。
的硫酸,其他试剂任选。
(3)实验开始时应先将活塞a
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为
(5)下图中
 白色沉淀(填装置序号)。
白色沉淀(填装置序号)。
您最近一年使用:0次
解题方法
2 . 在生活中亚硝酸钠(NaNO2)应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长等。某化学兴趣小组查阅资料得知2NO+Na2O2=2NaNO2,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去)。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为___________ ,仪器按气流方向连接顺序为b→___________ (部分装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是___________ 。
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)___________ 。
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式___________ 。

已知:NO能被酸性高锰酸钾氧化成最高价离子,但不能被浓硫酸氧化。回答下列问题:
(1)盛装稀硝酸的仪器名称为
(2)反应开始前打开止水夹a,通入过量氮气的目的是为了排除装置内的空气,反应结束后打开止水夹a,通入过量氮气的目的是
(3)已知:亚硝酸钠在中性或碱性条件中是稳定的,但酸化后能氧化KI,生成I2。若需鉴别亚硝酸钠和食盐,可供选择的物质有:①自来水②淀粉-KI试纸③淀粉④白糖⑤食醋,进行实验时,必须使用的物质有(填序号)
(4)写出NO被酸性高锰酸钾溶液吸收的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 实验室用 还原
还原 (沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
(沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是

 还原
还原 (沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
(沸点:31.85℃)制备高纯硅的装置如图所示(夹持装置和尾气处理装置略去),下列说法正确的是
| A.装置Ⅱ、Ⅲ中依次盛装的是浓硫酸、冰水 |
| B.实验时,应先加热管式炉,再打开活塞K |
| C.为鉴定制得硅中是否含有微量铁单质,需要用到的试剂为盐酸、双氧水、KSCN溶液 |
D.该实验中制备氢气的装置也可用于硫酸与 反应制备 反应制备 |
您最近一年使用:0次
2024-02-10更新
|
432次组卷
|
2卷引用:浙江省杭州学军中学2023-2024学年高一上学期期末模拟考试化学试卷
名校
解题方法
4 . 甘氨酸亚铁[(H2NCH2COO)2Fe,摩尔质量204g/mol]是一种新型的铁营养强化剂,广泛用于缺铁性贫血的预防和治疗。某学习小组模拟其合成方法如下:
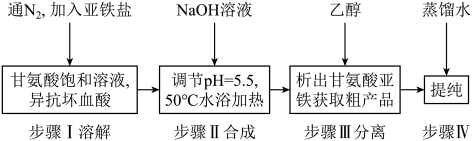
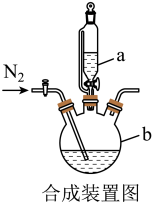
已知:
请回答:
(1)下列说法正确的是___________。
(2)合成过程中,本实验为了防止Fe2+被氧化,采取的措施是___________ 。
(3)合成过程需控制pH=5.5,pH过大或过小都对实验有影响,试说明理由___________ 。
(4)步骤Ⅲ加入无水乙醇的目的是___________ 。
(5)若甘氨酸的投料量为300kg,得到纯品306kg,则产品的产率为___________ 。


已知:
| 甘氨酸H2NCH2COOH | 异抗坏血酸 | 甘氨酸亚铁 | FeSO4·7H2O | FeCl2·4H2O |
| 易溶于水微溶于乙醇 | 易溶于水和乙醇有弱酸性和强环原性 | 易溶于水难溶于乙醇 | 易溶于水难溶于乙醇 | 易溶于水易溶于乙醇 |
(1)下列说法正确的是___________。
| A.滴入液体前,应先打开滴液漏斗a的上口玻璃塞 |
| B.根据题中所给信息,亚铁盐应选用FeSO4·7H2O |
| C.步骤Ⅲ中的分离方法是过滤 |
| D.步骤Ⅳ,提纯操作中的干燥过程最好选用真空干燥 |
(3)合成过程需控制pH=5.5,pH过大或过小都对实验有影响,试说明理由
(4)步骤Ⅲ加入无水乙醇的目的是
(5)若甘氨酸的投料量为300kg,得到纯品306kg,则产品的产率为
您最近一年使用:0次
5 . 某兴趣小组在实验室用下图装置(夹持仪器已省略)制备无水FeCl3。

已知:FeCl3易潮解,300℃左右升华。
请回答:
(1)①仪器a的名称___________ ;
②上述制备Cl2的化学方程式___________ ;
③装置B的作用___________ 。
(2)①通入Cl2一段时间后,再点燃装置D中的酒精灯,目的是___________ ;装置E为了更好的收集FeCl3,应采用___________ 水浴(填“热”或“冷”)。

②将上图组装完整,上图虚框F中应选用___________ 。
③反应结束后,硬质玻璃管有固体残留,某同学设计了以下实验探究其成分,你认为正确的是___________ 。
A.取少量固体溶于水,若不能溶解,则说明有铁残留
B.取少量固体溶于水,若全部溶解,则说明无铁残留
C.取少量固体溶于足量的盐酸,先滴加3滴KSCN溶液,若溶液呈血红色,则说明只有氯化铁残留

已知:FeCl3易潮解,300℃左右升华。
请回答:
(1)①仪器a的名称
②上述制备Cl2的化学方程式
③装置B的作用
(2)①通入Cl2一段时间后,再点燃装置D中的酒精灯,目的是

②将上图组装完整,上图虚框F中应选用
③反应结束后,硬质玻璃管有固体残留,某同学设计了以下实验探究其成分,你认为正确的是
A.取少量固体溶于水,若不能溶解,则说明有铁残留
B.取少量固体溶于水,若全部溶解,则说明无铁残留
C.取少量固体溶于足量的盐酸,先滴加3滴KSCN溶液,若溶液呈血红色,则说明只有氯化铁残留
您最近一年使用:0次
解题方法
6 . 某兴趣小组在实验室用下图装置(夹持仪器已省略)制备无水 。
。

已知: 易潮解,300℃左右时升华。请回答:
易潮解,300℃左右时升华。请回答:
(1)仪器Ⅰ的名称_______ :为了更好地收集 ,装置E应采用
,装置E应采用_______ 水浴(填“热”或“冷”)。
(2)本实验合理的操作步骤:按上图连接仪器→_______ 。(按操作顺序选择序号)。
①添加药品 ②检查装置气密性 ③点燃A处酒精灯 ④点燃D处酒精灯 ⑤使D中硬质玻璃管内充满黄绿色气体
(3)将上图中装置组装完整,虚框F应选用_______ 。
(4)为了保证仪器Ⅰ中液体顺利流下,应采用的操作是_______ 。
(5)反应结束后,在硬质玻璃管中有固体残留,同学们进行如下实验探究,你认为正确的是_______。
 。
。
已知:
 易潮解,300℃左右时升华。请回答:
易潮解,300℃左右时升华。请回答:(1)仪器Ⅰ的名称
 ,装置E应采用
,装置E应采用(2)本实验合理的操作步骤:按上图连接仪器→
①添加药品 ②检查装置气密性 ③点燃A处酒精灯 ④点燃D处酒精灯 ⑤使D中硬质玻璃管内充满黄绿色气体
(3)将上图中装置组装完整,虚框F应选用

(4)为了保证仪器Ⅰ中液体顺利流下,应采用的操作是
(5)反应结束后,在硬质玻璃管中有固体残留,同学们进行如下实验探究,你认为正确的是_______。
| A.取少量固体加水溶解,若不能溶解,则说明有铁残留 |
| B.取少量固体加水溶解,若全部溶解,则说明无铁残留 |
| C.取少量固体溶于足量的盐酸,先滴加3滴KSCN溶液,若溶液呈血红色,则说明只有氯化铁残留 |
| D.取少量固体溶于水中,先滴加3滴KSCN溶液无明显现象,再滴加少量新制氯水溶液呈血红色,则说明铁、氯化铁都有残留 |
您最近一年使用:0次
22-23高一上·浙江·期末
7 . 醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂。将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_______ 。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3,此时c 中有气体产生,该气体的作用是_______ 。
(3)打开K3,关闭K1和K2,c中亮蓝色溶液流入d,其原因是_______ ;d中析出砖红色沉淀。
(4)指出装置d可能存在的缺点_______ 。

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3,此时c 中有气体产生,该气体的作用是
(3)打开K3,关闭K1和K2,c中亮蓝色溶液流入d,其原因是
(4)指出装置d可能存在的缺点
您最近一年使用:0次
8 . 回答下列问题:
Ⅰ.醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,实验时,将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。

(1)要将 c中溶液流入d,操作的方法是___________ ;
(2)d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是___________ 。
Ⅱ.某学习小组探究用Cu(NO3)2·3H2O晶体制备少量无水Cu(NO3)2的实验装置示意图(夹持及控温装置省略,如下图)如下:

已知:Cu(NO3)2·3H2O Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 CuO,SOCl2的熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
CuO,SOCl2的熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(3)虚线框中整个装置的作用是___________ 。
(4)装置A中发生反应的化学方程式是___________ 。
(5)上述设计的实验装置中有一处不合理,请提出改进方案并说明理由___________ 。
Ⅰ.醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,实验时,将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。

(1)要将 c中溶液流入d,操作的方法是
(2)d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是
Ⅱ.某学习小组探究用Cu(NO3)2·3H2O晶体制备少量无水Cu(NO3)2的实验装置示意图(夹持及控温装置省略,如下图)如下:

已知:Cu(NO3)2·3H2O
 Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 CuO,SOCl2的熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
CuO,SOCl2的熔点-105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。请回答:
(3)虚线框中整个装置的作用是
(4)装置A中发生反应的化学方程式是
(5)上述设计的实验装置中有一处不合理,请提出改进方案并说明理由
您最近一年使用:0次
解题方法
9 . 高温下普通铁粉和水蒸气反应生成四氧化三铁,四氧化三铁被氢气还原生成颗粒很细、活性很高的铁粉,俗称“引火铁”。现用普通铁粉、稀盐酸、金属锌和水等试剂制备“引火铁”,装置如下:

请填写下列空白:
(1)由四氧化三铁制取“引火铁”选用装置_______ 。(填“图1”或“图2”)
(2)为了安全,在试管E中的反应发生前,导管F出口处的气体必须_______ 。
(3)试管A中发生反应的化学方程式_______ 。
(4)实验中需要加热的仪器有_______ (填该仪器对应的字母)
(5)烧瓶C的作用_______ ;实验时,U形管G中应加入的试剂_______ 。

请填写下列空白:
(1)由四氧化三铁制取“引火铁”选用装置
(2)为了安全,在试管E中的反应发生前,导管F出口处的气体必须
(3)试管A中发生反应的化学方程式
(4)实验中需要加热的仪器有
(5)烧瓶C的作用
您最近一年使用:0次
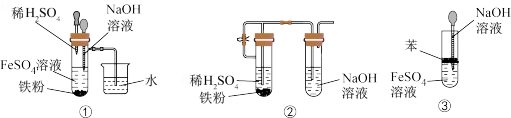
10 . 下列说法正确的是


| A.利用装置①可证明碳酸氢钠的不稳定性 |
| B.利用装置②可以制备氢气、二氧化碳气体,但不能制备氧气、氯气 |
| C.利用装置③可以检验铁与水蒸气反应的气体产物 |
| D.利用装置④可制备氢氧化亚铁,实验开始时应先关闭止水夹a |
您最近一年使用:0次
2022-01-22更新
|
337次组卷
|
3卷引用:浙江省台州市2021-2022学年高一上学期期末质量评估化学试题



