1 . 1875年,法国化学家布瓦博德朗发现了门捷列夫预言的“类铝”,即新元素镓。金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。某学校化学兴趣小组在实验室利用如图装置模拟制备三氯化镓,同时使用该装置验证卤素单质氧化性的相对强弱。
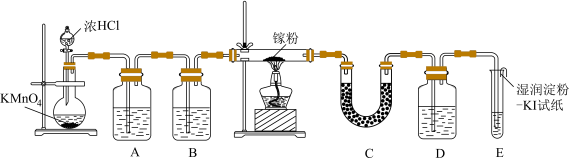
已知:①三氯化镓( )具有很强的吸湿性,在空气中吸收湿气而冒烟。
)具有很强的吸湿性,在空气中吸收湿气而冒烟。
②在氯气流中加热镓可制备 ,反应方程式
,反应方程式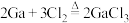 。
。
(1)镓(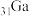 )元素在周期表中的位置是
)元素在周期表中的位置是___________ , 是共价化合物,其结构式为
是共价化合物,其结构式为___________ 。
(2)写出 与浓盐酸反应制取氯气的离子方程式(
与浓盐酸反应制取氯气的离子方程式( 中Mn被还原为
中Mn被还原为 ):
):___________ 。
(3)装置B中的试剂为___________ ;装置C中试剂的作用是___________ 。
(4)D中装有NaBr溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为___________ (只需写出一个现象即可)。
(5)装置E试管口内部放置湿润淀粉-KI试纸的主要目的是___________ 。
(6)请推测写 与NaOH反应的化学方程式
与NaOH反应的化学方程式___________ 。

已知:①三氯化镓(
 )具有很强的吸湿性,在空气中吸收湿气而冒烟。
)具有很强的吸湿性,在空气中吸收湿气而冒烟。②在氯气流中加热镓可制备
 ,反应方程式
,反应方程式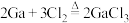 。
。(1)镓(
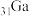 )元素在周期表中的位置是
)元素在周期表中的位置是 是共价化合物,其结构式为
是共价化合物,其结构式为(2)写出
 与浓盐酸反应制取氯气的离子方程式(
与浓盐酸反应制取氯气的离子方程式( 中Mn被还原为
中Mn被还原为 ):
):(3)装置B中的试剂为
(4)D中装有NaBr溶液,反应开始后能证明卤素单质氧化性相对强弱的现象为
(5)装置E试管口内部放置湿润淀粉-KI试纸的主要目的是
(6)请推测写
 与NaOH反应的化学方程式
与NaOH反应的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 氯亚铂酸钾 是制备抗肿瘤药物顺铂的重要中间体。工业上以废旧催化剂(主要含Pt,还含有Au、Ag、Al等金属)为原料,先制备氯铂酸钾
是制备抗肿瘤药物顺铂的重要中间体。工业上以废旧催化剂(主要含Pt,还含有Au、Ag、Al等金属)为原料,先制备氯铂酸钾 ,再还原得到氯亚铂酸钾
,再还原得到氯亚铂酸钾 ,同时实现硫酸铝晶体的回收利用,工艺流程如下:
,同时实现硫酸铝晶体的回收利用,工艺流程如下:

已知:①王水是浓盐酸和浓硝酸以3:1的体积比混合而成的溶液。
②滤液2主要含 、
、 ,且二者均为强酸。
,且二者均为强酸。
Ⅰ.制备氯亚铂酸钾
(1)滤渣的主要成分是___________ ,酸溶时将王水换成盐酸和过氧化氢的混合溶液,优点是___________ 。
(2)此流程中操作Ⅰ、Ⅱ、Ⅲ均使用到的硅酸盐仪器为___________ 。
(3)沉金过程发生的离子反应方程式为___________ ,该步反应说明氧化性
___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(4)盐酸肼(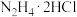 )是一种常用还原剂,还原过程生成一种无毒无害的气体,该过程发生的化学反应方程式为
)是一种常用还原剂,还原过程生成一种无毒无害的气体,该过程发生的化学反应方程式为___________ 。
(5)顺铂是抗癌药物,反铂不仅不能治疗癌症,还有较强毒性,二者结构如图所示:

推测中心原子Pt杂化方式肯定不是 杂化,理由是
杂化,理由是___________ ,且在水中的溶解度顺铂___________ (填“大于”或“小于”)反铂。
 是制备抗肿瘤药物顺铂的重要中间体。工业上以废旧催化剂(主要含Pt,还含有Au、Ag、Al等金属)为原料,先制备氯铂酸钾
是制备抗肿瘤药物顺铂的重要中间体。工业上以废旧催化剂(主要含Pt,还含有Au、Ag、Al等金属)为原料,先制备氯铂酸钾 ,再还原得到氯亚铂酸钾
,再还原得到氯亚铂酸钾 ,同时实现硫酸铝晶体的回收利用,工艺流程如下:
,同时实现硫酸铝晶体的回收利用,工艺流程如下:
已知:①王水是浓盐酸和浓硝酸以3:1的体积比混合而成的溶液。
②滤液2主要含
 、
、 ,且二者均为强酸。
,且二者均为强酸。Ⅰ.制备氯亚铂酸钾
(1)滤渣的主要成分是
(2)此流程中操作Ⅰ、Ⅱ、Ⅲ均使用到的硅酸盐仪器为
(3)沉金过程发生的离子反应方程式为

 (填“大于”或“小于”)。
(填“大于”或“小于”)。(4)盐酸肼(
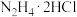 )是一种常用还原剂,还原过程生成一种无毒无害的气体,该过程发生的化学反应方程式为
)是一种常用还原剂,还原过程生成一种无毒无害的气体,该过程发生的化学反应方程式为(5)顺铂是抗癌药物,反铂不仅不能治疗癌症,还有较强毒性,二者结构如图所示:

推测中心原子Pt杂化方式肯定不是
 杂化,理由是
杂化,理由是
您最近一年使用:0次
名校
解题方法
3 . 铋酸钠(NaBiO3, M-280 g/mol) 是一种新型有效的光催化剂,也被广泛应用于制药业。某兴趣小组设计实验制取铋酸钠并探究其应用。
制取铋酸钠
利用白色且难溶于水的 Bi(OH)3在NaOH溶液中,在充分搅拌的情况下与Cl2反应制备 NaBiO3,实验装置如下图(加热和夹持仪器已略去)。
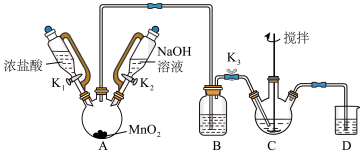
已知: NaBiO3粉末呈浅黄色,不溶于冷水,遇沸水或酸溶液迅速分解。
请按要求回答下列问题:
(1)仪器C的名称是:___________ :盛放浓盐酸的仪器优点是:___________ ;
(2)B装置盛放的试剂是:___________ ;
(3)C中发生的反应化学方程式为:___________ ;
(4)当观察到C中白色固体消失时,应关闭K3和K1,并停止对A加热,原因是:___________ ;
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是:___________ 、过滤、洗涤、干燥。
(6)实验完毕后,打开K2, 向A中加入 NaOH 溶液的主要作用是:___________ 。
制取铋酸钠
利用白色且难溶于水的 Bi(OH)3在NaOH溶液中,在充分搅拌的情况下与Cl2反应制备 NaBiO3,实验装置如下图(加热和夹持仪器已略去)。

已知: NaBiO3粉末呈浅黄色,不溶于冷水,遇沸水或酸溶液迅速分解。
请按要求回答下列问题:
(1)仪器C的名称是:
(2)B装置盛放的试剂是:
(3)C中发生的反应化学方程式为:
(4)当观察到C中白色固体消失时,应关闭K3和K1,并停止对A加热,原因是:
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是:
(6)实验完毕后,打开K2, 向A中加入 NaOH 溶液的主要作用是:
您最近一年使用:0次
2023高三·全国·专题练习
名校
解题方法
4 .  是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室用于制备氯气并用氯气制备和收集一定量纯净的
。如图是实验室用于制备氯气并用氯气制备和收集一定量纯净的 的装置(某些夹持装置等省略)。其中E中盛有液体(用于除去
的装置(某些夹持装置等省略)。其中E中盛有液体(用于除去 中的未反应的
中的未反应的 ,氯气几乎不溶于饱和食盐水)。
,氯气几乎不溶于饱和食盐水)。___________ 。
(2)请写出装置A中烧瓶内发生反应的离子方程式:___________ 。
(3)装置B中所盛试剂是___________ 。
(4)F为 收集装置,应选用下图的哪组装置来收集
收集装置,应选用下图的哪组装置来收集___________ (填序号),其中与装置E导管相连的导管口是___________ (填接口字母)。___________ 。
(6)将 通入冷的石灰乳中即制得漂白粉,漂白粉在使用时会与空气中
通入冷的石灰乳中即制得漂白粉,漂白粉在使用时会与空气中 反应,
反应, 为
为___________ (填“酸性氧化物”或“碱性氧化物”)。
 是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用
是一种广谱型消毒剂,它易溶于水而难溶于有机溶剂。实验室用 与
与 反应制得
反应制得 和
和 。如图是实验室用于制备氯气并用氯气制备和收集一定量纯净的
。如图是实验室用于制备氯气并用氯气制备和收集一定量纯净的 的装置(某些夹持装置等省略)。其中E中盛有液体(用于除去
的装置(某些夹持装置等省略)。其中E中盛有液体(用于除去 中的未反应的
中的未反应的 ,氯气几乎不溶于饱和食盐水)。
,氯气几乎不溶于饱和食盐水)。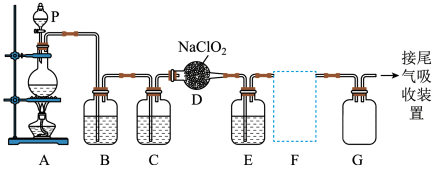
(2)请写出装置A中烧瓶内发生反应的离子方程式:
(3)装置B中所盛试剂是
(4)F为
 收集装置,应选用下图的哪组装置来收集
收集装置,应选用下图的哪组装置来收集
(6)将
 通入冷的石灰乳中即制得漂白粉,漂白粉在使用时会与空气中
通入冷的石灰乳中即制得漂白粉,漂白粉在使用时会与空气中 反应,
反应, 为
为
您最近一年使用:0次
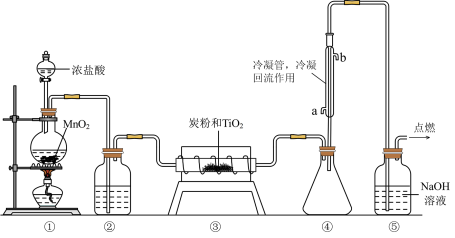
5 . 四氯化钛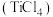 极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用
极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用 与炭粉、
与炭粉、 制备
制备 。下列说法正确的是
。下列说法正确的是
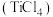 极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用
极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点-25℃,沸点136.4℃。某实验小组设计如下装置(部分加热和夹持装置省略),用 与炭粉、
与炭粉、 制备
制备 。下列说法正确的是
。下列说法正确的是
A. 产品最后在装置④中收集 产品最后在装置④中收集 |
| B.②中应盛装饱和氯化钠溶液 |
| C.反应时应先在③处加热,再开始①处的加热 |
| D.该实验设计存在不足,应在⑤后连接装有碱石灰的干燥管,防止空气中的水蒸气进入反应装置 |
您最近一年使用:0次
2023-11-15更新
|
629次组卷
|
4卷引用:新疆伊犁州霍城县江苏中学2023-2024学年高一上学期12月 化学试题
名校
6 .  具有强氧化性,
具有强氧化性, 具有还原性,某探究小组的同学学习氧化还原反应的知识后推测
具有还原性,某探究小组的同学学习氧化还原反应的知识后推测 与
与 可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。

Ⅰ.实验探究:
(1)装置A中盛装稀盐酸的仪器名称为___________ ,A装置发生的离子方程式为_____________________ ,B装置的作用是_____________________ ,里面盛放的试剂可以是___________ (填序号)。
A浓硫酸 B.碱石灰 C.无水硫酸铜
(2)下面是实验过程中的重要步骤,选出正确的操作顺序___________ 。
①用小试管收集气体,并检验其纯度
②停止加热,充分冷却后,关闭止水夹 和
和
③加热装有 的硬质玻璃管,使其逐渐熔化,反应一段时间
的硬质玻璃管,使其逐渐熔化,反应一段时间
④打开 和
和 ,滴加稀盐酸
,滴加稀盐酸
(3)在实验过程中观察到C中淡黄色固体逐渐变成白色,无水硫酸铜未变成蓝色,则 与
与 反应生成的产物为
反应生成的产物为___________ 。
Ⅱ.数据处理:
(4)实验结束以后,该小组的同学还想测定C装置内白色固体中未反应完的 含量。
含量。
操作流程如下:

①操作2的名称________________
②白色固体中 的质量分数为
的质量分数为________________ (用含 和
和 的式子表示)。
的式子表示)。
 具有强氧化性,
具有强氧化性, 具有还原性,某探究小组的同学学习氧化还原反应的知识后推测
具有还原性,某探究小组的同学学习氧化还原反应的知识后推测 与
与 可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
可以发生反应。为了验证他们的猜想,设计了如图所示的实验进行验证。
Ⅰ.实验探究:
(1)装置A中盛装稀盐酸的仪器名称为
A浓硫酸 B.碱石灰 C.无水硫酸铜
(2)下面是实验过程中的重要步骤,选出正确的操作顺序
①用小试管收集气体,并检验其纯度
②停止加热,充分冷却后,关闭止水夹
 和
和
③加热装有
 的硬质玻璃管,使其逐渐熔化,反应一段时间
的硬质玻璃管,使其逐渐熔化,反应一段时间④打开
 和
和 ,滴加稀盐酸
,滴加稀盐酸(3)在实验过程中观察到C中淡黄色固体逐渐变成白色,无水硫酸铜未变成蓝色,则
 与
与 反应生成的产物为
反应生成的产物为Ⅱ.数据处理:
(4)实验结束以后,该小组的同学还想测定C装置内白色固体中未反应完的
 含量。
含量。操作流程如下:

①操作2的名称
②白色固体中
 的质量分数为
的质量分数为 和
和 的式子表示)。
的式子表示)。
您最近一年使用:0次
名校
7 . 请选择适当的化学试剂和实验用品,用如图所示的装置进行实验(C中盛放的是过氧化钠),证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。

(1)A是实验室中制取CO2的装置,其中仪器m的名称是___________ ,写出A中发生反应的离子方程式 ___________ ;过氧化钠中阴阳离子个数比为 ___________ 。
(2)装置B中,加入的试剂是NaHCO3溶液,加入该试剂的目的是___________ 。
(3)写出C中发生反应主要的化学方程式:___________ 。加入该试剂的目的是 ___________ 。
(4)装置D中,加入的试剂是___________ 。
(5)能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有___________ 。
A.C装置中的淡黄色固体变为白色
B.D装置中无明显现象
C.F中收集到无色气体,该气体可以使带火星的木条复燃

(1)A是实验室中制取CO2的装置,其中仪器m的名称是
(2)装置B中,加入的试剂是NaHCO3溶液,加入该试剂的目的是
(3)写出C中发生反应主要的化学方程式:
(4)装置D中,加入的试剂是
(5)能证明“过氧化钠可在呼吸面具和潜水艇中做供氧剂”的实验现象有
A.C装置中的淡黄色固体变为白色
B.D装置中无明显现象
C.F中收集到无色气体,该气体可以使带火星的木条复燃
您最近一年使用:0次
名校
8 . 制备过氧化锶晶体的原理为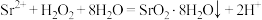 ,装置如下图所示。
,装置如下图所示。
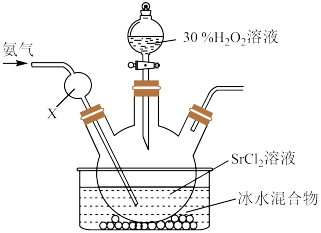
下列说法错误的是
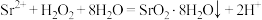 ,装置如下图所示。
,装置如下图所示。
下列说法错误的是
| A.该反应为氧化还原反应 | B.仪器X的作用是防倒吸 |
C.氨气的作用是中和 | D.冰水混合液可减少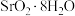 分解 分解 |
您最近一年使用:0次
2023-10-25更新
|
211次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高三上学期11月月考化学试题
9 . 某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:

(1)⑥操作方法的名称是_______ ;操作⑨包括:蒸发浓缩、_______ 、过滤、洗涤、低温干燥。
(2)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为_______ 。
乙同学取2.0mL④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为_______ 。
(3)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)=_______ 。
(4)在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c。试分析残留固体的成分为________ (填元素符号,下同),所得溶液中阳离子为_______ 。

(1)⑥操作方法的名称是
(2)某兴趣小组同学欲鉴别④中的金属阳离子,设计如下实验:
甲同学取2.0mL④溶液,滴加氢氧化钠溶液,产生白色沉淀且很快变为灰绿色,最后变为红褐色沉淀,其中涉及氧化还原反应的化学方程式为
乙同学取2.0mL④溶液,先加入几滴KSCN溶液,无明显现象,再加入几滴氯水,溶液变红,其中涉及氧化还原反应的离子方程式为
(3)若按上述工艺处理1000L该工业废水,制得320g铜,则该工业废水中c(Cu2+)=
(4)在Fe2(SO4)3溶液中,加入ag铜,完全溶解后,再加bg铁,充分反应后得到cg残余固体,且a>c。试分析残留固体的成分为
您最近一年使用:0次
名校
解题方法
10 . 硫酸亚硝酰合铁(Ⅱ)在化学分析、金属腐蚀抑制剂、染料工业、医药领域等方面具有重要的应用价值。某兴趣小组利用废铁屑为原料制备硫酸亚硝酰合铁(Ⅱ),并测定其化学式。
Ⅰ.用废铁屑制备 溶液
溶液
(1)将废铁屑放入 溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中
溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中 溶液的作用是
溶液的作用是___________ 。
(2)将处理好的铁屑放入锥形瓶,加入适量的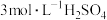 溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因___________ 。
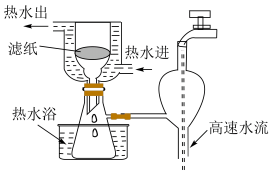
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是___________ 。
Ⅱ.用NO气体和 溶液制备硫酸亚硝酰合铁(Ⅱ)
溶液制备硫酸亚硝酰合铁(Ⅱ)
装置如图所示(加热及夹持装置略)。
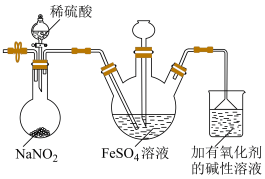
(3)圆底烧瓶中生成NO的同时还生成了 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(4)实验开始前需先鼓入 ,其目的是
,其目的是___________ 。
Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为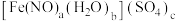 。
。
步骤i.用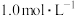 酸性
酸性 溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性
溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性 溶液16.00 mL(NO完全转化为
溶液16.00 mL(NO完全转化为 );
);
步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量 溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
(5)已知硫酸亚硝酰合铁(Ⅱ)中 的配位数为6,则化学式中
的配位数为6,则化学式中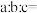
___________ 。
(6)酸性 溶液应盛装在
溶液应盛装在___________ (填“酸”或“碱”)式滴定管中,若滴定前未润洗该滴定管,会导致b的数值___________ (填“偏大”或“偏小”)。
Ⅰ.用废铁屑制备
 溶液
溶液(1)将废铁屑放入
 溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中
溶液中煮沸,冷却后倾倒出液体,用水洗净铁屑。该步骤中 溶液的作用是
溶液的作用是(2)将处理好的铁屑放入锥形瓶,加入适量的
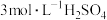 溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。
溶液,水浴加热至充分反应为止。趁热过滤,收集滤液和洗涤液。①废铁屑中含有的少量氧化铁无需在制备前除去,用离子方程式解释原因
②步骤中的过滤采用如下图装置,相对于普通过滤装置而言,其优点是

Ⅱ.用NO气体和
 溶液制备硫酸亚硝酰合铁(Ⅱ)
溶液制备硫酸亚硝酰合铁(Ⅱ)装置如图所示(加热及夹持装置略)。

(3)圆底烧瓶中生成NO的同时还生成了
 ,该反应的离子方程式为
,该反应的离子方程式为(4)实验开始前需先鼓入
 ,其目的是
,其目的是Ⅲ.测定硫酸亚硝酰合铁(Ⅱ)的化学式,其化学式可表示为
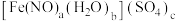 。
。步骤i.用
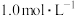 酸性
酸性 溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性
溶液滴定20.00 mL硫酸亚硝酰合铁(Ⅱ)溶液,滴定至终点时消耗酸性 溶液16.00 mL(NO完全转化为
溶液16.00 mL(NO完全转化为 );
);步骤ii.另取10.00 mL硫酸亚硝酰合铁(Ⅱ)溶液加入足量
 溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。
溶液,过滤后得到沉淀,将沉淀洗涤干燥称量,质量为2.33 g。(5)已知硫酸亚硝酰合铁(Ⅱ)中
 的配位数为6,则化学式中
的配位数为6,则化学式中
(6)酸性
 溶液应盛装在
溶液应盛装在
您最近一年使用:0次
2023-10-13更新
|
229次组卷
|
5卷引用:新疆石河子第一中学2023-2024学年高三上学期11月月考化学试题



