1 .  是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。 时各物质溶度积见下表:
时各物质溶度积见下表:
回答下列问题:
(1) 中
中 元素的化合价是
元素的化合价是 和
和_______ 。 的核外电子排布式为
的核外电子排布式为_______ 。
(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是_______ 。
(3)反应釜2中,加入 和分散剂的同时通入空气。
和分散剂的同时通入空气。
①反应的离子方程式为_______ 。
②为加快反应速率,可采取的措施有_______ 。(写出两项即可)。
(4)①反应釜3中, 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过_______ 。
②称取 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为_______ ,该副产物中 的质量分数为
的质量分数为_______ 。
 是一种用途广泛的磁性材料,以
是一种用途广泛的磁性材料,以 为原料制备
为原料制备 并获得副产物
并获得副产物 水合物的工艺如下。
水合物的工艺如下。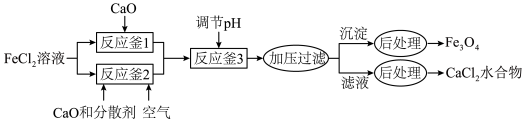
 时各物质溶度积见下表:
时各物质溶度积见下表:| 物质 |  |  |  |
溶度积 |  |  |  |
(1)
 中
中 元素的化合价是
元素的化合价是 和
和 的核外电子排布式为
的核外电子排布式为(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是
(3)反应釜2中,加入
 和分散剂的同时通入空气。
和分散剂的同时通入空气。①反应的离子方程式为
②为加快反应速率,可采取的措施有
(4)①反应釜3中,
 时,
时, 浓度为
浓度为 ,理论上
,理论上 不超过
不超过②称取
 水合物
水合物 ,加水溶解,加入过量
,加水溶解,加入过量 ,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用
,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用 标准溶液滴定,消耗
标准溶液滴定,消耗 。滴定达到终点的现象为
。滴定达到终点的现象为 的质量分数为
的质量分数为
您最近一年使用:0次
2023-09-28更新
|
4611次组卷
|
5卷引用:新疆喀什市第五中学2023-2024学年高三上学期12月大联考化学预测卷
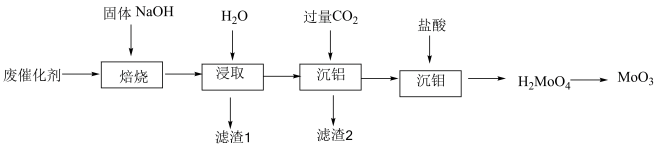
2 . 复合催化剂 常用于催化甘油脱水制丙烯醇的工业生产中,使用后的催化剂处理不当,会造成污染和浪费。一种处理该废催化剂的工艺如图所示。
常用于催化甘油脱水制丙烯醇的工业生产中,使用后的催化剂处理不当,会造成污染和浪费。一种处理该废催化剂的工艺如图所示。
 相关反应的平衡常数如下:
相关反应的平衡常数如下:
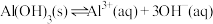
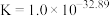

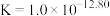
回答下列问题:
(1)焙烧前,需要将废催化剂研磨成粉末,目的是___________ 。
(2)滤渣1的用途有___________ ,___________ 。(答两条)
(3)浸取后的溶液中含有的主要的阴离子是___________ 。
(4)“沉铝”时,需要控制溶液的pH在___________ —___________ 范围内,氢氧化铝为胶状沉淀,可用于制备氧化铝,氧化铝的生产中,氢氧化铝的过滤洗涤结果的好坏直接影响产品氧化铝的质量,设备产能以及焙烧氧化铝的能耗等。过滤时,在氢氧化铝浆液中加入助滤剂的目的是___________ 。(答一条)
(5)“沉钼”时发生的离子方程式是___________ ,试评价下“沉铝”时用 的优点有
的优点有___________ 。(答一条)
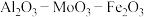 常用于催化甘油脱水制丙烯醇的工业生产中,使用后的催化剂处理不当,会造成污染和浪费。一种处理该废催化剂的工艺如图所示。
常用于催化甘油脱水制丙烯醇的工业生产中,使用后的催化剂处理不当,会造成污染和浪费。一种处理该废催化剂的工艺如图所示。
 相关反应的平衡常数如下:
相关反应的平衡常数如下: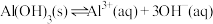
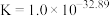

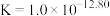
回答下列问题:
(1)焙烧前,需要将废催化剂研磨成粉末,目的是
(2)滤渣1的用途有
(3)浸取后的溶液中含有的主要的阴离子是
(4)“沉铝”时,需要控制溶液的pH在
(5)“沉钼”时发生的离子方程式是
 的优点有
的优点有
您最近一年使用:0次
3 . 硅铍钇矿(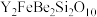 )是一种含钇族稀土元素和氧化铍为主的重要矿物,该矿含稀土约35%,含氧化铍约5%。一种生产工业氧化铍和稀土产品的工业流程如下:
)是一种含钇族稀土元素和氧化铍为主的重要矿物,该矿含稀土约35%,含氧化铍约5%。一种生产工业氧化铍和稀土产品的工业流程如下:
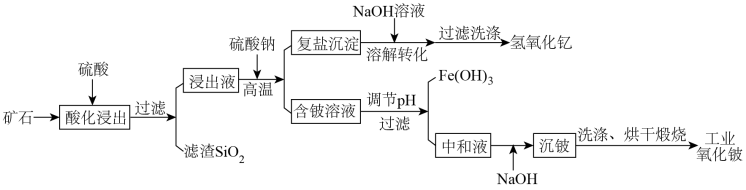
下列叙述错误的是
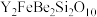 )是一种含钇族稀土元素和氧化铍为主的重要矿物,该矿含稀土约35%,含氧化铍约5%。一种生产工业氧化铍和稀土产品的工业流程如下:
)是一种含钇族稀土元素和氧化铍为主的重要矿物,该矿含稀土约35%,含氧化铍约5%。一种生产工业氧化铍和稀土产品的工业流程如下:
下列叙述错误的是
A.硅铍钇矿(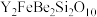 )中Y的化合价为+3 )中Y的化合价为+3 |
| B.流程中,没有氧化还原反应发生 |
C.检验氢氧化铍是否洗涤干净,可用 溶液 溶液 |
D.若复盐沉淀的化学式是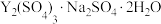 ,则溶解转化的方程式是 ,则溶解转化的方程式是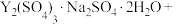 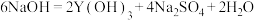 |
您最近一年使用:0次
4 . As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水[砷主要以亚砷酸(H3AsO3)形式存在]通过如下流程转化为粗As2O3。
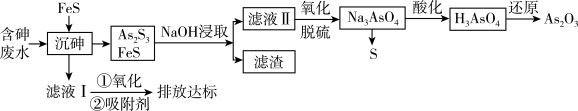
已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq) 2
2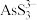 (aq)
(aq)
Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
(1)As2S3中砷元素的化合价为_______ 价。
(2)“沉砷”过程中FeS是否可以用过量的Na2S替换_______ (填“是”或“否”);请从平衡移动的角度解释原因:_______ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,写出脱硫的离子反应方程式_______ 。
(4)用SO2“还原”过程中,发生反应的化学方程式为_______ 。若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有_______ 。
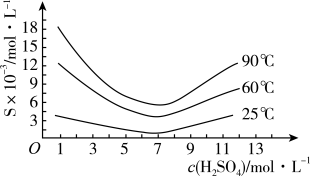
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是_______ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。若沉降后上层清液中c(Ca2+)为2×10-3mol/L,则溶液中 的浓度为
的浓度为_______ mol/L。(已知Ksp[Ca3(AsO4)2]=8×10-19)

已知:Ⅰ. As2S3+ 6NaOH = Na3AsO3 + Na3AsS3+ 3H2O
Ⅱ. As2S3(s) + 3S2-(aq)
 2
2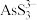 (aq)
(aq)Ⅲ.砷酸(H3AsO4)在酸性条件下有强氧化性,能被SO2、氢碘酸等还原。
(1)As2S3中砷元素的化合价为
(2)“沉砷”过程中FeS是否可以用过量的Na2S替换
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,写出脱硫的离子反应方程式
(4)用SO2“还原”过程中,发生反应的化学方程式为
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示。为了提高粗As2O3的沉淀率,“结晶”需要控制的具体条件是

(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为Ca3(AsO4)2沉淀。若沉降后上层清液中c(Ca2+)为2×10-3mol/L,则溶液中
 的浓度为
的浓度为
您最近一年使用:0次
2022-05-03更新
|
203次组卷
|
2卷引用:新疆昌吉州2022届高三第二次诊断性测试理科综合化学试题
名校
5 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图所示。下列说法不正确 的是
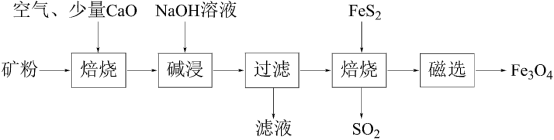

| A.“焙烧”时产生的气体可以用NaOH溶液吸收 |
| B.滤液中的铝元素主要以[Al(OH)4]-形式存在. |
| C.可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色则证明产品中含有FeO |
| D.可用磁选操作的原因是Fe3O4具有磁性 |
您最近一年使用:0次
2022-02-28更新
|
813次组卷
|
5卷引用:新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题
新疆昌吉教育体系2021-2022学年高三上学期第三次模考化学试题(已下线)第十单元 化学实验基础(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)福建省南平高级中学2021-2022学年高三上学期12月月考化学试题(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)
解题方法
6 . 已知:普通铁+水蒸气 铁的氧化物+氢气,铁的氧化物+氢气
铁的氧化物+氢气,铁的氧化物+氢气 “引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
“引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:

下列关于上述装置和实验的分析错误 的是
 铁的氧化物+氢气,铁的氧化物+氢气
铁的氧化物+氢气,铁的氧化物+氢气 “引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
“引火铁”+水蒸气,其中“引火铁”为颗粒很细、反应活性很高的铁粉。某实验小组使用普通铁粉、20%的盐酸及其他试剂制备“引火铁”,装置图(铁架台、铁夹、铁网、石棉网、加热仪器等略去)如下:
下列关于上述装置和实验的分析
| A.A、Ⅰ中加入普通铁粉,G中可加入碱石灰 |
| B.A中生成磁性氧化铁,E中生成“引火铁” |
| C.需要加热的仪器只有A、E |
| D.D用于收集氢气,F处的尾气中有氢气与水蒸气 |
您最近一年使用:0次
名校
7 . 硫酸亚铁铵晶体[x(NH4)2SO4·yFeSO4·zH2O] [ M=(132x+152y+18z)g·mol-1 ]是常见的补血剂。
已知:①硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
②FeSO4溶液与(NH4)2SO4反应可得到硫酸亚铁铵。
(1)FeSO4溶液的制备。将铁粉、一定量 H2SO4溶液反应制得FeSO4溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是_______ (用离子方程式表示)。
(2)制备x(NH4)2SO4·yFeSO4·zH2O。向制备得到的FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为_______ 。
(3)产品化学式的确定——NH 含量的测定
含量的测定
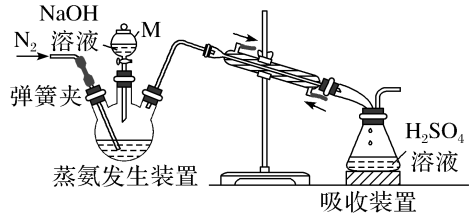
I.准确称取58.80 g晶体,加水溶解后,将溶液注入三颈烧瓶中;
II.准确量取50.00 mL 3.030 mol·L-1 H2SO4溶液于锥形瓶中;
III.向三颈烧瓶中通入氮气,加入足量NaOH浓溶液,加热,蒸氨结束后取下锥形瓶;
IV.用0.120 mol·L-1的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00 mL NaOH标准溶液。
①装置M的名称为_______ 。
②通入N2的作用为_______ 。
③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_______ 。
④若步骤IV中,未用NaOH标准溶液润洗滴定管,则n(NH )将
)将_______ (填“偏大”、“偏小”或“不变”)。
(4)产品化学式的确定——SO 含量的测定
含量的测定
I.另准确称取58.80 g晶体于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
II.将得到的溶液过滤得到沉淀,洗涤沉淀3~4次;
Ⅲ.灼烧沉淀至恒重,称量,得沉淀质量为69.90 g。
结合实验(3)和(4),通过计算得出硫酸亚铁铵晶体的化学式为_______ 。
已知:①硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
②FeSO4溶液与(NH4)2SO4反应可得到硫酸亚铁铵。
(1)FeSO4溶液的制备。将铁粉、一定量 H2SO4溶液反应制得FeSO4溶液,其中加入的铁粉需过量,除铁粉不纯外,主要原因是
(2)制备x(NH4)2SO4·yFeSO4·zH2O。向制备得到的FeSO4溶液中加入一定质量的(NH4)2SO4固体,在70℃~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。乙醇的作用为
(3)产品化学式的确定——NH
 含量的测定
含量的测定
I.准确称取58.80 g晶体,加水溶解后,将溶液注入三颈烧瓶中;
II.准确量取50.00 mL 3.030 mol·L-1 H2SO4溶液于锥形瓶中;
III.向三颈烧瓶中通入氮气,加入足量NaOH浓溶液,加热,蒸氨结束后取下锥形瓶;
IV.用0.120 mol·L-1的NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00 mL NaOH标准溶液。
①装置M的名称为
②通入N2的作用为
③蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是
④若步骤IV中,未用NaOH标准溶液润洗滴定管,则n(NH
 )将
)将(4)产品化学式的确定——SO
 含量的测定
含量的测定I.另准确称取58.80 g晶体于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
II.将得到的溶液过滤得到沉淀,洗涤沉淀3~4次;
Ⅲ.灼烧沉淀至恒重,称量,得沉淀质量为69.90 g。
结合实验(3)和(4),通过计算得出硫酸亚铁铵晶体的化学式为
您最近一年使用:0次
2021-12-04更新
|
369次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市2023届高三下学期第二次质量检测理综化学试题
8 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水的处理剂,制备流程如图所示:

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是___ 。
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的___ (填标号),反应的离子方程式为___ 。
a.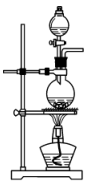 b.
b.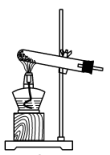
c.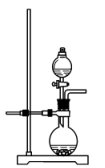 d.
d.
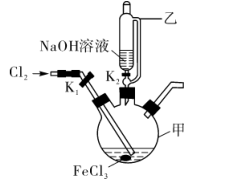
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为____ ,实验时应先打开活塞K2的原因是____ ,为了提高氯气的利用率,可采取的措施是__ 。
(4)验证酸性条件下氧化性 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,___ (实验中须使用的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)。
(5)根据K2FeO4的制备实验得出:氧化性Cl2> ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___ 。

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的
a.
 b.
b.
c.
 d.
d.
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为

(4)验证酸性条件下氧化性
 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,(5)根据K2FeO4的制备实验得出:氧化性Cl2>
 ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-25更新
|
487次组卷
|
2卷引用:新疆喀什地区疏附县2022届高三下学期第一次模拟化学试题
9 . 以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3,Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图:

已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)写出“氧化”时发生反应的离子方程式__ 。
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用__ (填编号)。
A.Cu B.CuCO3 C.NaOH D.MnCO3
(3)“除杂2”除去的主要离子是__ (填离子符号)。
(4)除MnO2外该流程中可以循环使用的物质是__ 。
(5)工业上采用如图所示的方法获得MnO2,Mn2+将在__ 极(填“C”或“D”)发生反应生成MnO2,电极反应式为___ 。

(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__ 。[已知:H2S的电离常数K1=1.0×10-7,K2=7.0×10-15;Ksp(MnS)=1.4×10-15]

已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10、Ksp(MnF2)=5.0×10-3
(1)写出“氧化”时发生反应的离子方程式
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用
A.Cu B.CuCO3 C.NaOH D.MnCO3
(3)“除杂2”除去的主要离子是
(4)除MnO2外该流程中可以循环使用的物质是
(5)工业上采用如图所示的方法获得MnO2,Mn2+将在

(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解题方法
10 . 利用磷石膏脱钙渣制备轻质碳酸钙流程如下:
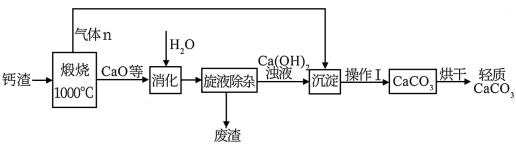
已知:磷石膏脱硫钙渣的成分
25℃时,几种物质的溶解情况
回答下列问题:
(1)煅烧前钙渣要进行粉碎处理,目的是_______ ,煅烧时发生的主要反应的化学方程式是__________ 。
(2)CaO消化后的产物是_________ (填化学式),消化时,水量过少,会造成产率下降,原因是________ 。
(3)旋液除杂时,难溶物下降, 形成悬浊液上升,实现了难溶物和悬浊液的分离,废渣的主要成分有
形成悬浊液上升,实现了难溶物和悬浊液的分离,废渣的主要成分有_________ 。
(4) 浊液中含有少量的
浊液中含有少量的________ (填化学式),它的存在________ (填“影响”或“不影响”)产品的纯度。
(5)操作Ⅰ的名称是___________ ,流程中,气体a如果没有全部被 浊液吸收,造成的后果有
浊液吸收,造成的后果有__________ 。

已知:磷石膏脱硫钙渣的成分
| 成分 |  |  |  |  | 其他 |
| 含量(%) | 87.35 | 1.60 | 1.77 | 9.20 | 0.08 |
| 物质 |  |  |  |
| 溶解度或溶解情况 | 0.165g | 不溶 | 0.2g |
(1)煅烧前钙渣要进行粉碎处理,目的是
(2)CaO消化后的产物是
(3)旋液除杂时,难溶物下降,
 形成悬浊液上升,实现了难溶物和悬浊液的分离,废渣的主要成分有
形成悬浊液上升,实现了难溶物和悬浊液的分离,废渣的主要成分有(4)
 浊液中含有少量的
浊液中含有少量的(5)操作Ⅰ的名称是
 浊液吸收,造成的后果有
浊液吸收,造成的后果有
您最近一年使用:0次



